基于超高效液相色譜-四極桿飛行時間質譜聯用技術的血瘀模型大鼠血漿代謝組學分析
楊秀娟, 楊志軍, 李 碩, 鄧 毅*, 楊延澤, 曼 瓊, 李鵬杰
(1. 甘肅中醫藥大學藥學院, 甘肅 蘭州 730000;2. 甘肅省高校中(藏)藥化學與質量研究省級重點實驗室, 甘肅 蘭州 730000)
血瘀證是中醫臨床常見的證型,血瘀理論始載于《黃帝內經》[1]。目前,依據血瘀病因病機可建立如寒凝、氣虛、外傷、郁怒等血瘀證動物模型,急性血瘀是其中之一。七情中“憂怒”和六淫中的“寒邪”為急性血瘀主要病因,在情緒暴怒時機體會分泌大量的腎上腺素。可給予大鼠皮下注射鹽酸腎上腺素(Adr)模擬暴怒時的機體狀態,并施以冰水浴刺激模擬“寒邪”刺激,二者合用可綜合建立大鼠急性血瘀模型[2]。
代謝組學可從整體角度對機體生理及病理條件下產生的變化做出代謝應答,從內源性代謝物層面反應生物學事件,研究生命活動規律,已成為疾病診斷、病理生理等研究的重要手段。超高效液相色譜-四極桿飛行時間質譜(UPLC-Q-TOF/MS)法具有高通量、高分離能力、高靈敏度和專屬性等優勢,可使基質干擾減少,改善極端復雜樣品的分離狀況[3,4]。
本研究采用UPLC-Q-TOF/MS技術測定血瘀模型大鼠血漿代謝組學數據,采用多元統計學方法篩選與血瘀證相關的生物標志物,分析代謝通路變化規律,研究血瘀證形成的代謝機制,為臨床診斷血瘀證及開發相應的藥物提供參考依據。
1 實驗部分
1.1 儀器、試劑與實驗動物
Triple TOF 5600+質譜儀(美國AB SCIEX公司); Agilent 1290 Infinity LC超高壓液相色譜儀(美國Agilent公司); ACQUITY UPLC BEH Amide色譜柱(100 mm×2.1 mm, 1.7 μm,美國Waters分司)。SA-6000全自動血流變檢測儀(北京賽科希德科技有限公司); Sysmex CA-1500全自動血凝儀(鄭州瑞郎光學光源醫療電子有限公司);微量采血管40 μL(淄博來緒醫用器材有限公司); 5430R低溫高速離心機(德國Eppendorf公司); AL104電子分析天平(德國Mettler-Toledo公司)。
無特定病原體(SPF)級遠交群大鼠(Sprague Dawley, SD)16只,雌雄各半,體重為180~220 g,由甘肅中醫藥大學動物實驗中心提供,動物許可證號為SCXK(甘)2015-0002。適應性飼養一周后開始實驗。
1.2 血瘀證大鼠模型的建立及分組
按照文獻[2,5,6]的方法復制血瘀大鼠模型。SD大鼠隨機分為空白對照組和血瘀模型組,每組8只。空白對照組不給予刺激,血瘀模型組于第7天皮下注射鹽酸腎上腺素注射液(0.8 mg/kg)共2次,間隔時間為4 h。第1次皮下給予鹽酸腎上腺素2 h后,將大鼠置于0 ℃冰水中游泳4 min,取出,擦干體表,2 h后再次皮下注射鹽酸腎上腺素注射液0.8 mg/kg,禁食過夜,造成大鼠急性血瘀模型。
1.3 樣品采集與血液流變學檢測
造模后第9天腹主動脈取血,記錄大鼠體重及體征變化。腹主動脈采血5 mL,加入已添加肝素鈉的離心管中,記為樣本1,用于測定血液流變學等指標。腹主動脈采血2 mL,收集在含有肝素鈉的離心管中,以3 000 r/min的速度于室溫離心10 min,取上清分裝至1.5 mL離心管中,每管0.2 mL,置于-80 ℃冰箱凍存,用于測定血漿中代謝物,記為樣本2。
采用全自動血流變檢測儀測定全血黏度(WBV)(1、5、50、100和200/s切變率)、血漿黏度(PV)。
1.4 凝血功能相關指標測定
腹主動脈取血2 mL,加入已添加檸檬酸二鈉的抗凝管中,采用全自動血凝儀測定活化部分凝血活酶時間(APTT)、凝血酶原時間(PT)、纖維蛋白原(FIB)。
1.5 樣品制備
取1.3節樣本2,在4 ℃環境下緩慢解凍后,取各組樣本100 μL分別加入400 μL預冷甲醇/乙腈溶液(1∶1, v/v),渦旋混合,-20 ℃靜置10 min,以12 000 r/min的速度于4 ℃離心20 min,取上清真空干燥。質譜分析時加入100 μL乙腈水溶液(乙腈:水=1∶1, v/v)復溶,渦旋,以12 000 r/min的速度于 4 ℃離心15 min,取上清液進樣分析。
人人都說內蒙古的羊肉好吃。為什么好吃?其實也沒什么奧秘,無非內蒙古的羊是吃沙蔥的羊,沙蔥本身去膻氣,羊肉固然就少有膻味。
分別取按1.3節樣本2方法處理的空白對照組和血瘀模型組樣本各30 μL,混合,即得質控(quality control, QC)樣本,用于測定進樣前儀器狀態及平衡色譜-質譜系統,并評價整個實驗過程中系統的穩定性。
1.6 UPLC-Q-TOF/MS分析條件
樣品采用Agilent 1290 Infinity LC超高效液相色譜系統(UPLC)進行分析。使用HILIC色譜柱進行分離;柱溫為25 ℃;流速為0.3 mL/min;進樣量為2 μL。流動相組成:A為含0.2%(體積分數,下同)乙酸銨的0.05%氨水,B為乙腈。梯度洗脫程序為:0~1.0 min, 95%B; 1.0~14.0 min, 95%B~65%B; 14.0~16.0 min, 65%B~40%B; 16.0~18.0 min, 40%B; 18.0~18.1 min, 40%B~95%B; 18.1~23.0 min, 95%B。整個分析過程中樣品置于4 ℃自動進樣器中。為避免儀器檢測信號波動而造成的影響,采用隨機順序進行樣本的連續分析。樣本隊列中插入QC樣品,用于監測和評價系統的穩定性及實驗數據的可靠性。
分別采用電噴霧電離(ESI)正離子和負離子模式進行檢測。樣品經UPLC分離后用Triple TOF 5600+質譜儀進行分析。HILIC色譜分離后的ESI源條件如下:噴霧氣(Gas1): 0.41 MPa;輔助加熱氣(Gas2): 0.41 MPa;氣簾氣(CUR): 0.21 MPa;離子源溫度:600 ℃;離子肼電壓漂移(ISVF):±5 500 V(正負兩種模式);飛行時間質譜掃描質荷比范圍:60~1 000;產物掃描質核比范圍:25~1 000;飛行時間質譜掃描積累時間:0.20 s/spectrum;產物離子掃描積累時間:0.05 s/spectrum。二級質譜采用數據相關采集(IDA)獲得,采用高靈敏度模式,IDA設置如下:排除同位素4 Da;每個周期監測候選離子:6;去簇電壓(DP):±60 V(正負兩種模式);碰撞能量:(35±15) eV。
1.7 數據分析
原始數據經ProteoWizard轉換成.mzML格式,然后采用XCMS程序進行峰對齊、保留時間校正和提取峰面積。代謝物結構鑒定采用精確質量數匹配(<25×10-6)和二級譜圖匹配的方式,檢索數據庫。對XCMS提取得到的數據,刪除組內缺失值>50%的離子峰。采用SIMCA-P14.1進行模式識別,數據經Pareto-scaling預處理后,進行多維統計分析,包括無監督主成分分析(PCA),有監督偏最小二乘法判別分析(PLS-DA)和正交偏最小二乘法判別分析(OPLS-DA)。單維統計分析包括變異倍數(FC)分析、T檢驗及火山圖。
2 結果和討論
2.1 模型驗證
2.1.1證候變化
與空白對照組比較,造模后血瘀大鼠出現了弓背、聳毛、毛色無光澤等證候表現,蜷縮少動,喜扎堆,畏寒喜暖,四肢發冷,寒戰,反應遲鈍,爪尾部紫暗,耳緣及鼻唇發白,飲水、進食量減少,大便濕爛,肛門污穢。根據中醫理論,造模大鼠出現上述證候,符合中醫血瘀的辨證范疇。
2.1.2血液流變學變化
如表1所示,與空白對照組相比,血瘀模型組大鼠中WBV 1、5、50、100和200/s切變率顯著升高,PV顯著升高,差異有統計學意義。
2.1.3凝血功能變化
如表2所示,血瘀模型組大鼠PT、APTT值分別為(8.22±0.28) s和(35.17±1.40) s,與空白對照組相比,數值顯著降低,差異有統計學意義(P< 0.01); FIB值為(4.54±0.39) g/L,數值顯著升高,差異有統計學意義(P<0.01)。
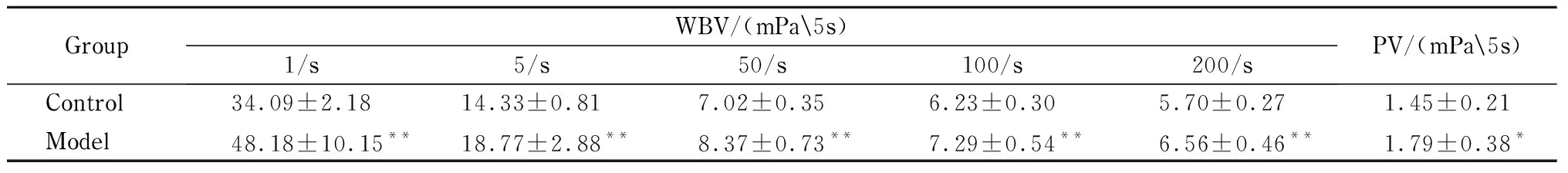
表 1 血瘀大鼠全血及血漿黏度分析結果(n=8)Table 1 Results of the whole blood viscosity (WBV) and plasma viscosity (PV) analysis of the blood-stasis rats (n=8)
*P<0.05, **P<0.01, compared with the control group.

表 2 血瘀大鼠凝血指標(n=8)Table 2 Coagulation index in the blood-stasis rats (n=8)
PT: prothrombin time; FIB: fibrinogen; APTT: activated partial thromboplastin time. **P<0.01, compared with the control group.
綜上所述,顯示造模成功。
2.2 質量控制
將QC樣本的總離子流圖進行譜圖重疊(n=6),結果見圖1。結果表明,各色譜峰的響應強度和保留時間基本重疊,說明在整個試驗過程中儀器誤差引起的變異較小,采用XCMS軟件對代謝物的離子峰進行提取,將空白對照組、血瘀模型組和QC樣本提取得到的峰采用Pareto-scaling進行PCA分析,正、負離子模式下QC樣本緊密聚集在一起,表明本試驗的重復性好,結果見圖2。
綜上所述,本次試驗的儀器分析系統穩定性較好,試驗數據穩定可靠,在試驗中獲得的代謝譜差異能反映樣本自身間的生物學差異。
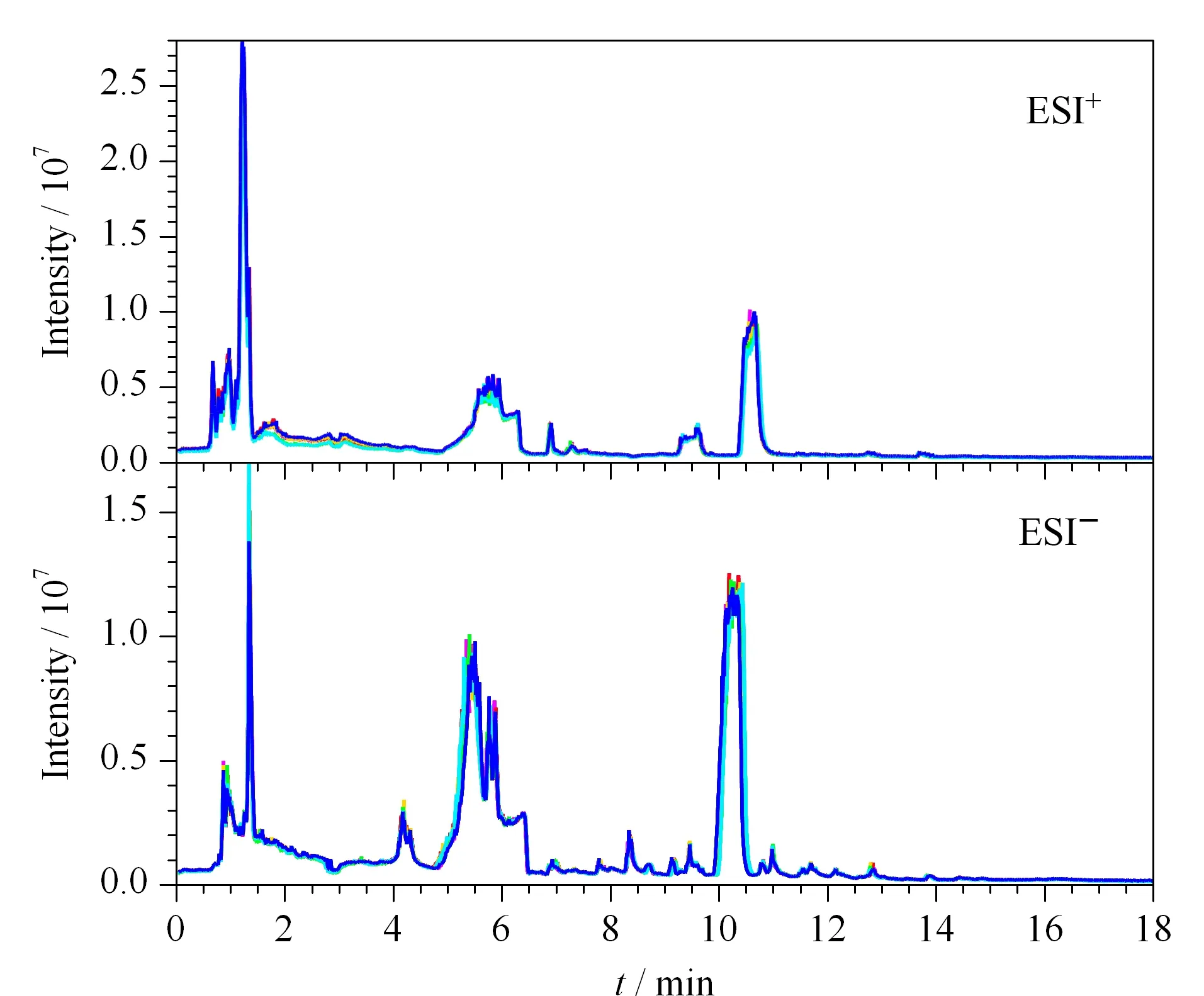
圖 1 質控血漿樣品總離子流圖(n=6)Fig. 1 Total ion current (TIC) chromatograms of quality control (QC) plasma samples (n=6)
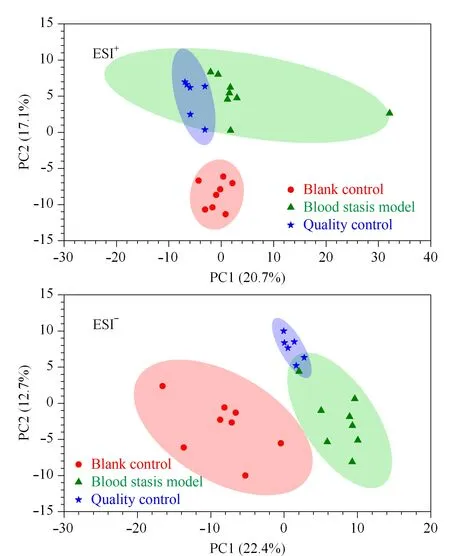
圖 2 電噴霧電離模式下血漿樣本的PCA得分圖Fig. 2 Principal component analysis (PCA) score plots of the plasma samples in the electrospray ionization mode
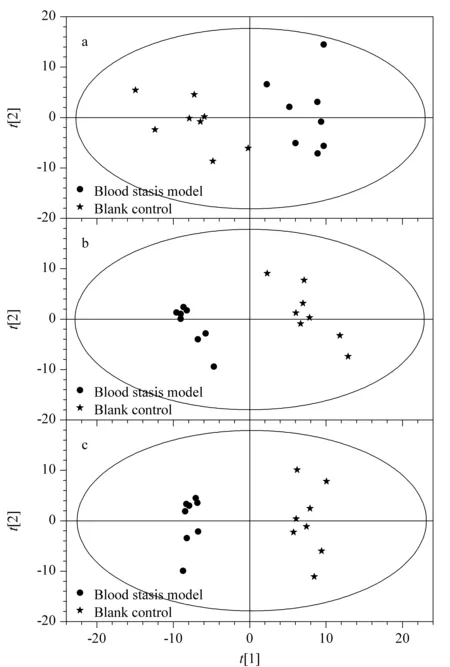
圖 3 空白對照組與血瘀模型組大鼠血漿代謝物的(a)PCA、 (b)PLS-DA和(c)OPLS-DA圖Fig. 3 (a) PCA, (b) differentiation analysis of super- vised partial least squares method (PLS-DA) and (c) orthogonal partial least squares discriminant analysis (OPLS-DA) of the rat plasma metabolites in the blank control group and blood stasis model group
2.3 多變量統計分析
血漿樣品經HILIC色譜分離條件得到數據,經處理后得到PCA圖(見圖3a),結果顯示,第一主成分(PC1)和第二主成分(PC2)維度上,空白對照組與血瘀模型組有一定的分離趨勢。參考文獻[7],采用PLS-DA和OPLS-DA建立代謝物表達量與樣品類別之間的關系模型,來實現對樣品類別的預測。PLS-DA是一種有監督的判別分析統計方法,運用偏最小二乘回歸建立代謝物表達量與樣品類別之間的關系模型,來實現對樣品類別的預測,建立空白對照組與血瘀模型組的PLS-DA模型,經7次循環交互驗證得到的模型評價參數R2Y、Q2(R2Y表示模型對Y變量的解釋率,Q2表示模型預測能力)分別為0.995、0.854(正離子模式)和0.996、0.911(負離子模式),R2Y和Q2均不小于0.5,表明模型穩定可靠(見圖3b)。OPLS-DAD在PLS-DA的基礎上進行修正,濾除與分類信息無關的噪音,提高了模型的解析能力和有效性,建立空白對照組與模型組的OPLS-DA的模型,從圖3可知,空白對照組與血瘀模型組分離趨勢較好。經7次循環交互驗證得到的模型評價參數(R2Y、Q2)分別為0.967、0.816(正離子模式)和0.978、0.879(負離子模式),R2Y和Q2均不小于0.5,表明模型穩定可靠(見圖3c)。
2.4 單變量統計分析
采用FC分析、T檢驗及火山圖對空白對照組與血瘀模型組的數據進行單變量分析,可篩選出血瘀模型大鼠的差異代謝物,以FC>2.0且P<0.05作為篩選標準,FC指血瘀模型組相對于空白對照組的變化倍數。火山圖中偏離軸線的點為FC>2.0且P<0.05的差異代謝物(見圖4)。將所得到的差異代謝物進行聚類分析,得到熱圖(見圖5)。當篩選的代謝物合理準確,同組樣本可通過聚類出現在同一簇(cluster)中,聚在同一簇內的代謝物具有相似的表達模式,本試驗結果表明,空白對照組與血瘀模型組可明顯聚為兩類,表明所篩選的代謝物合理。
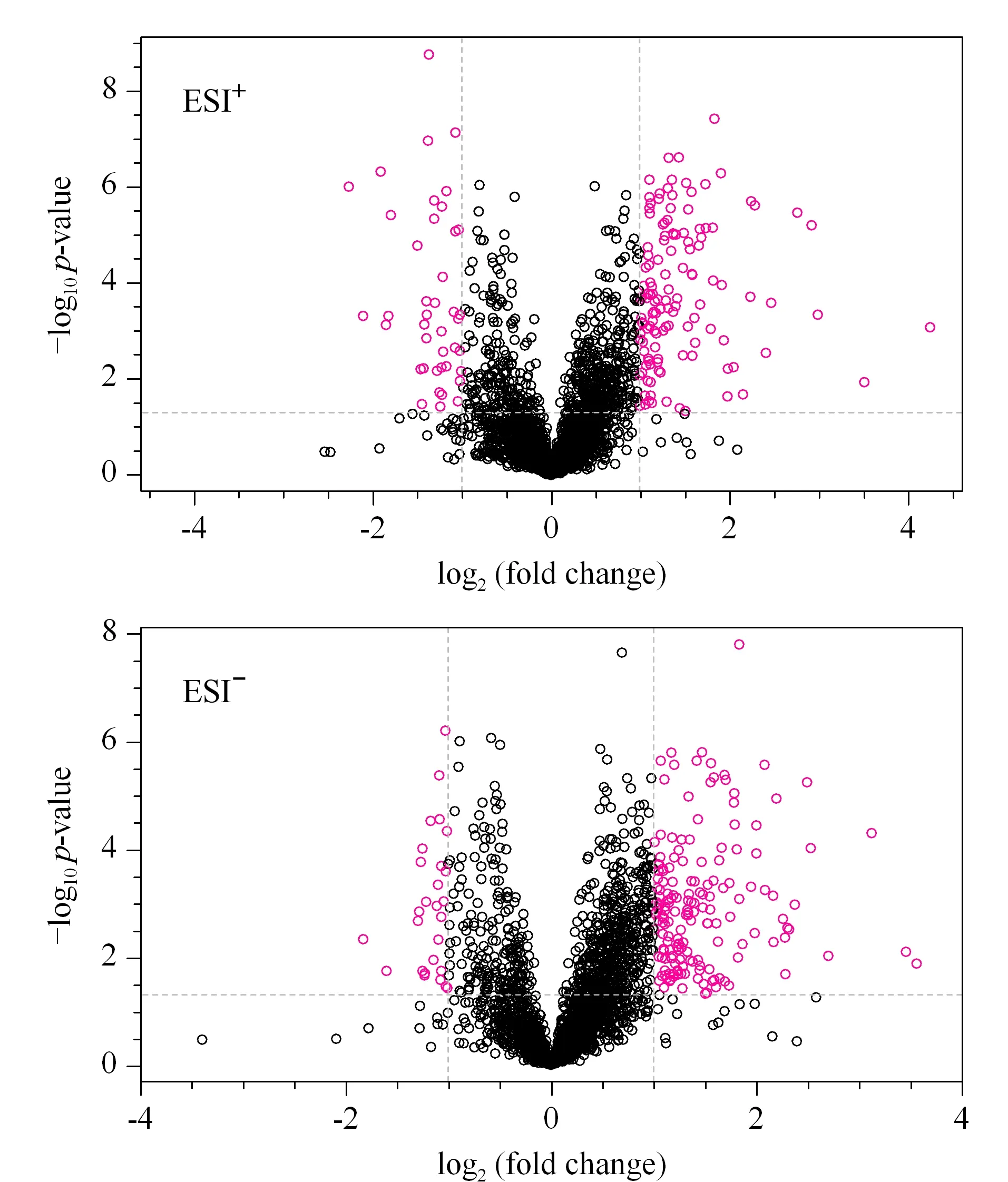
圖 4 空白對照組與血瘀模型組大鼠血漿代謝物火山圖Fig. 4 Volcano map of the rat plasma metabolites in the blank control group and blood stasis model group
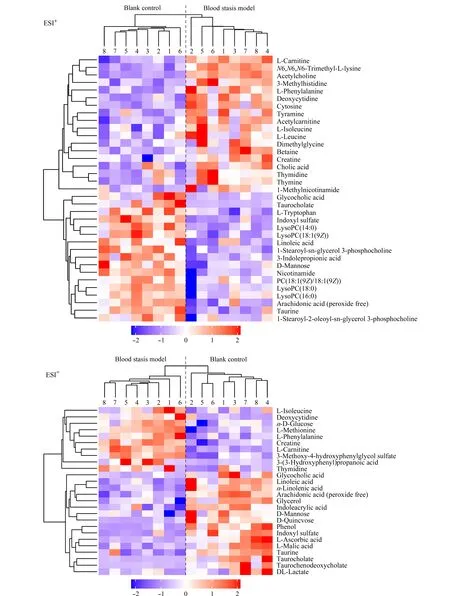
圖 5 空白對照組與血瘀模型組大鼠血漿代謝物熱圖Fig. 5 Heat map of the rat plasma metabolites in the blank control group and blood stasis model group
2.5 差異代謝物篩選及鑒別
與空白對照組比較,血瘀模型組共篩選出差異代謝物46個,以FC來評價血瘀模型組與空白對照組間代謝物變化的顯著性,FC>1,代表代謝物相對含量升高,用“↑”表示;FC<1,代表代謝物相對含量降低,用“↓”表示。與空白對照組比較,血瘀模型組中乙酰膽堿、N6,N6,N6-三甲基-L-賴氨酸、胞嘧啶、乙酰肉堿、3-甲基組氨酸、甜菜堿、酪胺、異亮氨酸、胸腺嘧啶、二甲基甘氨酸、膽酸、甲基煙酰胺、肉堿、肌氨酸、蛋氨酸、3-甲氧基-4羥基苯基乙二醇-硫酸鹽、苯基丙氨酸、葡萄糖、3-羥苯基丙酸、脫氧胞苷、胸苷、葡萄糖、乳酸顯著上調,吲哚丙酸、磷脂酰膽堿(PC)(14∶0)、PC(18∶1(9Z))、PC(18∶0)、PC(16∶0)、PC(18∶1(9Z)/18∶1(9Z))、甘露醇、甘油、色氨酸等代謝物顯著下調,見表3。
將篩選所得差異代謝物輸入KEGG數據庫(www.kegg.jp/kegg/mapper.html)。與空白對照組比較,血瘀模型組中亞油酸、亞麻酸、LysoPC(16∶0)、LysoPC(14∶0)、LysoPC(18∶0)、LysoPC(18∶1(9Z))、PC(18∶1(9Z)/18∶1(9Z))、1-硬脂酰-2-油酰-sn-甘油3-磷脂酰膽堿(SOPC)、花生四烯酸等代謝物水平顯著降低,乙酰膽堿水平升高。這些代謝產物主要參與亞油酸代謝、亞麻酸代謝、甘油磷脂代謝及花生四烯酸代謝,表明脂質代謝物和膽堿類物質可能在血瘀疾病中被干擾,這與相關報道[8-10]一致。
脂質及甘油磷脂代謝:通過給予大鼠鹽酸腎上腺素和冰水浴后,血瘀模型中磷脂酰膽堿代謝速度加快,磷脂酰膽堿在磷脂酶A2的作用下轉化為花生四烯酸,花生四烯酸可進一步轉化為血栓烷A2、血栓烷B2,造成血瘀及更嚴重的血栓等一系列心血管疾病[11]。LysoPC也是通過磷脂酶A2的作用由磷脂酰膽堿產生的,而磷脂酶A2可調控血管張力并誘發內皮功能障礙[12]。在血瘀形成中,LysoPC可抑制轉錄活動組織因子和NF-κB,通過調控組織因子的表達參與血栓形成[13]。
氨基酸代謝:苯丙氨酸是一種人體必需的芳香族氨基酸,機體的生長發育和正常生理機能的維持需要穩定的苯丙氨酸代謝狀態。苯丙氨酸在血漿中水平升高可阻斷苯丙氨酸代謝,從而導致血瘀。酪胺、苯酚參與酪氨酸代謝,在血瘀狀態下,由于酪氨酸羥化酶和多巴胺-β-羥化酶2種合成限速酶的表達可使得兒茶酚胺和酪胺生成增加[14],在本試驗中,酪胺水平升高,酪胺參與酪氨酸代謝,酪氨酸是神經遞質和激素的前體,包括腎上腺素、去甲腎上腺素等,在體內具有增強新陳代謝的作用。腎上腺素和去甲腎上腺素結合引起血管收縮,增加血液黏度[9]形成血瘀。色氨酸是蛋白質生物合成的基礎,是神經遞質5-羥色胺合成的前體,5-羥色胺是體內重要的神經調節物質,具有很強的收縮血管作用[15],由于體內血瘀的形成,造成主要參與色氨酸代謝的L-色氨酸含量在血瘀模型中降低。異亮氨酸屬于支鏈氨基酸,其合成所需的碳骨架來源于糖無氧代謝和有氧代謝的中間產物[16],牛磺酸與亞牛磺酸代謝通路側面反映了機體能量代謝水平,血瘀模型中牛磺酸、牛磺膽酸鹽含量下降,表明血瘀模型大鼠體內能量代謝紊亂[17]。
半乳糖代謝和糖酵解:葡萄糖、甘油、甘露糖、乳酸參與了半乳糖代謝和糖酵解,說明在血瘀證的病理變化中,心肌需要更多的能量,此時主要通過糖酵解來供應[18]。
綜上,血瘀模型主要與脂質代謝(LysoPC(14∶0)、LysoPC(18∶1(9Z))、LysoPC(18∶0)、LysoPC(16∶0))、不飽和脂肪酸生物合成(花生四烯酸、亞油酸、亞麻酸)、糖酵解(葡萄糖、DL-乳酸)、半乳糖代謝(D-甘露糖、葡萄糖、甘油、乳酸)、亞油酸代謝(SOPC、亞油酸、花生四烯酸)、甘油磷脂代謝(SOPC、乙酰膽堿)、牛磺酸與亞牛磺酸代謝(牛磺酸、牛磺膽酸鹽)、氨基酸代謝(色氨酸、異亮氨酸、苯丙氨酸)、酪氨酸代謝(酪胺、苯酚)等代謝通路有關。
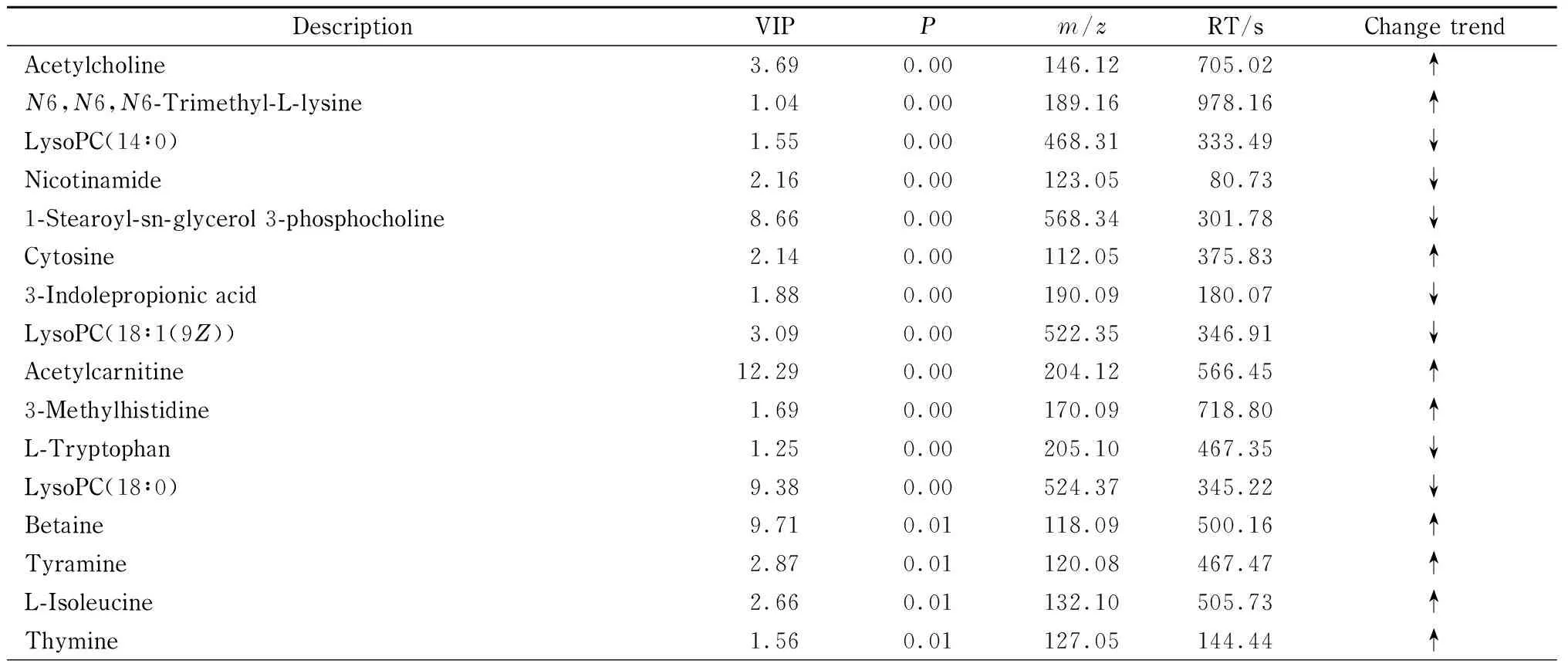
表 3 電噴霧電離模式下空白對照組與血瘀模型組中的差異代謝物Table 3 Different metabolites of the plasma sample in the blank control group and blood stasis model group in the electrospray ionization mode
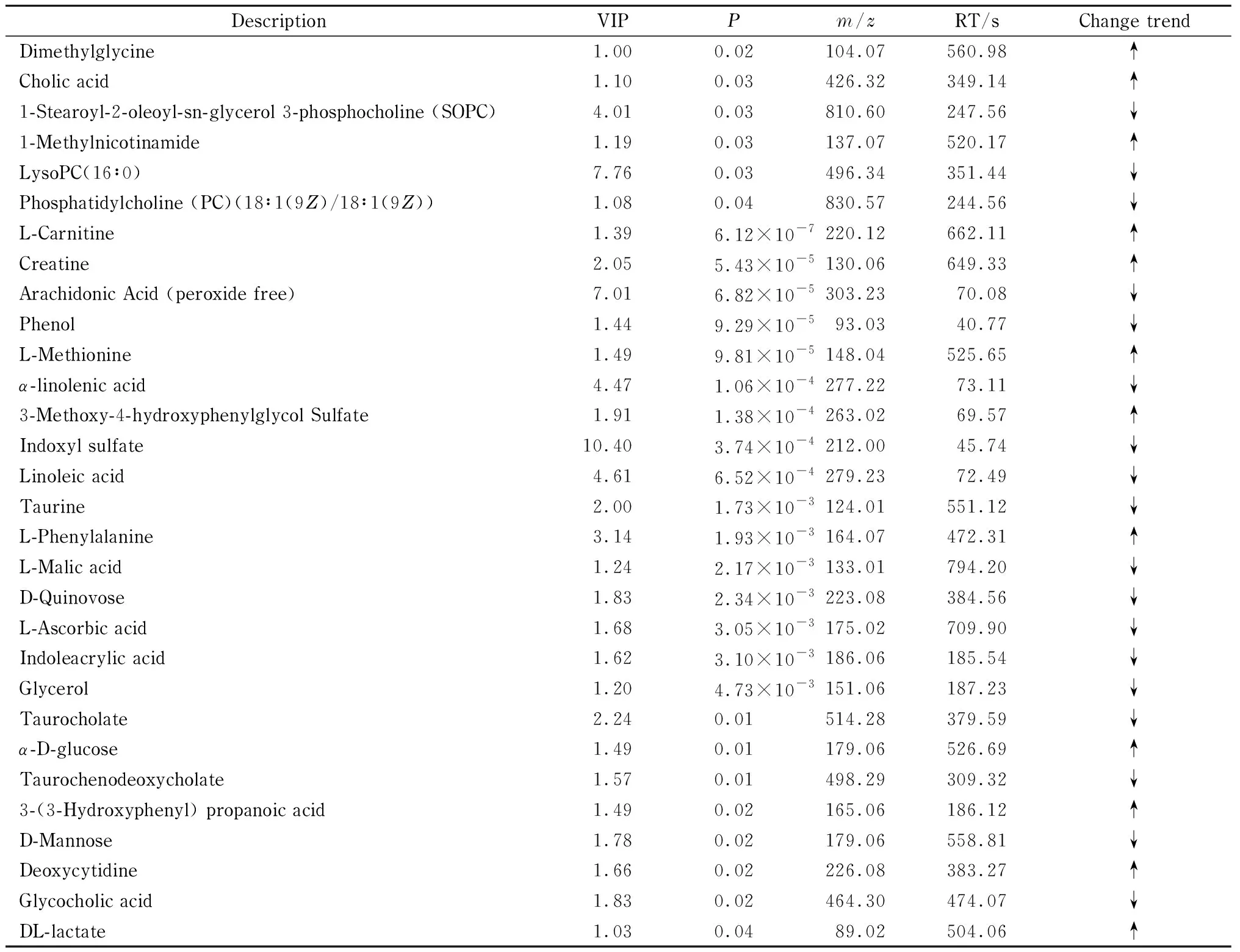
表 3 (續)Table 3 (Continued)
VIP: variable importance for the projection; RT: retention time; ↑: up-regulated; ↓: down-regulated.
3 結論
本文利用代謝組學的分析手段檢測血瘀模型大鼠中代謝物的變化,與空白對照組相比,血瘀模型在脂質代謝、糖酵解、氨基酸代謝及不飽和脂肪酸代謝方面發生不同程度的紊亂,與現有文獻[7,8]報道情況基本相符。通過對相關代謝物及代謝通路進行深入分析,發現“生物標志物群/譜”能全面反應機體代謝功能的變化,也能更好地對疾病證候進行判別歸類分析,并為研究與血瘀證相關疾病的(冠心病、腦血栓等)機制、篩查或臨床藥物治療提供一種新的思路。

