鞘內阻斷趨化因子配體12/趨化因子受體4趨化因子軸對選擇性神經損傷模型大鼠前扣帶皮層中膠質細胞原纖維酸性蛋白質表達的影響
黃雪花 戴麗華 楊悅橙 馬 柯
神經病理性疼痛(NP)是由軀體感覺系統的損傷或疾病引起的疼痛。NP疼痛程度劇烈,臨床治療效果欠佳,發病機制復雜不清,中樞敏化是其重要的發病機制之一。研究結果表明,星形膠質細胞在中樞敏化中具有重要作用[1],膠質細胞原纖維酸性蛋白(GFAP)是中樞神經系統中星形膠質細胞的特征性標志物,而趨化因子在NP中具有重要作用[2]。趨化因子受體(CXCR)4在體內大部分組織和器官上都有表達,趨化因子配體(CXCL)12/CXCR4趨化因子軸參與體內多種生理或病理生理功能,包括NP、人類免疫缺陷病毒侵染、造血功能、胚胎發育和腫瘤遷移等,因此趨化因子及其受體可能成為疾病治療新的分子靶點。本研究建立選擇性神經損傷(SNI)模型,觀察造模后大鼠前扣帶皮層(ACC)中GFAP的表達情況,并觀察鞘內注射CXCR4抑制劑AMD3100阻斷CXCL12/CXCR4趨化因子軸對大鼠ACC中GFAP表達和大鼠痛覺超敏的影響,旨在為治療NP提供新的理論依據。
1 材料與方法
1.1 實驗動物 96只健康、清潔級雄性Sprague-Dawley(SD)大鼠由上海交通大學醫學院附屬新華醫院動物實驗中心提供,體重220~260 g,動物生產許可證號為SCXK(滬)2013-0016,動物使用許可證號為SYXK(滬)2013-0106。
1.2 主要儀器和試劑 化學發光成像系統(型號為Chemidoc XRS,美國Bio-Rad公司),Western凝膠電泳套件(EPS-300,上海精密儀器儀表公司),全波長酶標儀(BIO-TEK,上海旦鼎國際貿易有限公司),熒光顯微鏡(DMI-3008,德國Leica公司)。AMD3100(批號為 A5602,美國Sigma公司),抗 GFAP抗體(英國 Abcam 公司),抗GAPDH抗體(上海碧云天生物技術有限公司)。
1.3 分組 將96只大鼠飼養于空氣過濾系統適應環境2 d,隨機分為假手術未治療組、假手術治療組、SNI未治療組、SNI治療組,每組24只。
1.4 鞘內置管和利多卡因測試 于大鼠腹腔內注射10%水合氯醛(290~340 mg/kg)麻醉后,將其妥善固定,在L4與L5間隙處消毒,作長1.0~1.5 cm的皮膚縱向切口,依次切開皮膚和淺筋膜,顯露肌層,在棘突旁用尖刀背部鈍性分離附著于L4至L5棘突一側的肌肉,暴露白色椎板,在L4與L5兩關節突結合處內側,用無齒鑷子夾著聚乙烯硬膜外導管前端,輕柔地將導管向上置入。如置管順利,則大鼠會出現甩尾反射,此時導管內可見清亮的腦脊液流出。鞘內置管后第2天行利多卡因測試。取出并剪除聚乙烯導管盲端,應用25μL微量注射器注射2%利多卡因7μL,以大鼠雙下肢出現暫時性癱瘓現象作為鞘內置管成功的標志。
1.5 SNI動物模型的制備和AMD3100鞘內注射 根據Decosterd和Woolf[3]描述的方法,于大鼠腹腔內注射10%水合氯醛(290~340 mg/kg)后,將其置于俯臥位,常規消毒鋪巾,縱向切開左側大腿的皮膚、淺筋膜,斷開股二頭肌,充分暴露坐骨神經及其末端腓腸神經、腓總神經和脛神經分支。SNI未治療組和SNI治療組用5/0絲線分別結扎腓總神經和脛神經并予切斷,保留腓腸神經完整;假手術未治療組和假手術治療組僅暴露但不結扎神經。術后均肌內注射青霉素4萬~5萬U預防感染。假手術治療組和SNI治療組術后鞘內連續注射AMD3100 10μL(含AMD3100 1μg,每天1次,連續2周),假手術未治療組和SNI未治療組在同時間點鞘內注射等量0.9%氯化鈉溶液。
1.6 機械性刺激縮足閾值(PWT)測定 根據Tal等[4]的方法,于SNI術前和首次注藥后7、14、21、28、35 d上午測定大鼠PWT。將大鼠放置在有機玻璃箱(86 cm×20 cm×14 cm)內,箱的底面為有孔的金屬篩網,讓大鼠在有機玻璃箱內適應30 min后,用von-Frey細絲(美國North Coast Medical公司)垂直刺激大鼠左后足底部外側皮膚,刺激值由小逐漸增大,大鼠出現抬足或舔足行為視為陽性反應,記錄出現陽性反應時的刺激數值,循環測試3次取平均值。
1.7 ACC取材和海馬中GFAP蛋白質水平檢測①Western印跡法檢測ACC中GFAP蛋白質表達水平:每組分別于首次注藥后14、21、28、35 d各取4只大鼠,腹腔內注射麻醉后用鍘刀快速斷頭,用咬骨鉗鉗掉大腦兩側的顱骨,剝除腦膜,取出完整的大腦,分離ACC,隨即放入液氮中保存備用。稱取等量組織標本后,按比例加入蛋白酶抑制劑和細胞裂解液,組織勻漿后,4℃12 879×g離心15 min,取上清液,采用二辛可寧酸法(BCA法)測定蛋白質濃度。加入十二烷基硫酸鈉上樣緩沖液,變性30 min(55℃),蛋白質電泳轉至聚偏二氟乙烯膜,轉膜75 min(恒流300 m A),5%脫脂牛奶室溫封閉2 h,一抗4℃搖床孵育過夜(GFAP 1∶5 000,GAPDH 1∶8 000)。以Tris-HCl緩沖鹽溶液(TBS)+吐溫(TBST)緩沖液沖洗3次,每次10 min;HRP酶標二抗室溫孵育1 h;再次以TBST緩沖液沖洗3次,每次10 min;ECL顯色曝光。以內參照與目標蛋白質的灰度比值表示目的蛋白質的相對表達量。② 免疫熒光法觀察ACC中GFAP蛋白質表達情況:每組分別于首次注藥后14、28 d各取4只大鼠,在腹腔內注射麻醉后,將大鼠沖洗至通體變白,以4℃4%多聚甲醛溶液約300 m L灌注固定,灌注時間為20~25 min。灌注完畢后取出完整的大腦,固定和脫水后包埋制作冰凍切片。將30μm切片經5%驢血清加0.3%Triton X-100封閉破膜0.5 h后,將GFAP 1∶1 000加入1% 牛血清白蛋白(BSA)4℃孵育過夜,熒光標記二抗37℃孵育45 min,置于熒光顯微鏡下觀察并拍照。細胞扁平、胞體突起較多較粗,有多個分枝,熒光染色深者為陽性細胞。
1.8 統計學處理 應用SPSS 16.0統計學軟件。呈正態分布的計量資料以±s表示。4組PWT總趨勢比較采用重復測量方差分析,成組設計的多個樣本均數的比較采用單因素方差分析。以P<0.05為差異有統計學意義。
2 結 果
2.1 PWT的變化 術前4組間PWT基礎值的差異均無統計學意義(P值均>0.05),SNI未治療組首次注藥后7、14、21、28、35 d的PWT值均顯著低于假手術未治療組和假手術治療組同時間點(P值均<0.01),SNI治療組首次注藥后14、21、28、35 d的PWT值均顯著高于SNI未治療組同時間點(P值均<0.01)。見表1。
表1 4組大鼠術前和注藥后各時間點的PWT值比較 (N=24,±s,g)

表1 4組大鼠術前和注藥后各時間點的PWT值比較 (N=24,±s,g)
與假手術未治療組比較:①P<0.01;與假手術治療組比較:②P<0.01;與SNI未治療組比較:③P<0.01
組別 術前 首次注藥后7 d 首次注藥后14 d 首次注藥后21 d 首次注藥后28 d 首次注藥后2 23.42±3.08 24.41±0.29假手術治療 24.01±4.52 22.52±3.18 23.31±2.91 24.19±2.85 23.51±3.86 23.82±4.21 SNI未治療 23.46±4.82 4.72±4.43①② 3.67±1.67①② 4.44±1.67①② 4.80±1.79①② 5.33±1.15①②SNI治療 23.80±4.61 8.28±5.43 6.71±2.55③ 7.64±1.75③ 8.25±1.28③ 8.00±1.63 35 d假手術未治療 23.12±3.12 21.67±5.02 21.60±4.02 23.84±4.9③
2.2 Western印跡法檢測ACC中GFAP蛋白質水平 首次注藥后14和21 d,4組間大鼠ACC中GFAP蛋白質相對表達量的差異均無統計學意義(P值均>0.05)。首次注藥后28和35 d,SNI未治療組大鼠ACC中GFAP蛋白質相對表達量均顯著高于假手術未治療組和假手術治療組同時間點(P值均<0.05),SNI治療組大鼠ACC中GFAP蛋白質相對表達量均顯著低于SNI未治療組同時間點(P值均<0.05),假手術未治療組與假手術治療組間大鼠ACC中GFAP蛋白質相對表達量的差異均無統計學意義(P值均>0.05)。見表2。
表2 4組大鼠注藥后各時間點ACC中GFAP蛋白質相對表達量比較 (N=4,±s)

表2 4組大鼠注藥后各時間點ACC中GFAP蛋白質相對表達量比較 (N=4,±s)
與假手術未治療組比較:①P<0.05;與假手術治療組比較:②P<0.05;與SNI未治療組比較:③P<0.05
組別 首次注藥后14 d 首次注藥后21 d 首次注藥后28 d 首次注藥后1.00±0.00 1.00±0.00 1.00±0.00 1.00±0.00假手術治療 1.02±2.21 1.08±2.89 1.16±2.05 1.03±3.14 SNI未治療 1.01±0.12 1.19±0.87 2.69±2.98①② 2.62±4.87①②SNI治療 1.12±0.32 1.28±0.11 1.28±2.13③ 1.34±0.02 35 d假手術未治療③
2.3 免疫熒光法觀察ACC中GFAP的蛋白質表達 在首次注藥后14 d時,4組大鼠ACC中GFAP蛋白質表達無明顯異常;而在首次注藥后28 d時,SNI未治療組大鼠ACC中GFAP蛋白質表達明顯增多,主要表現為陽性細胞數增多,著色較深。見圖1。
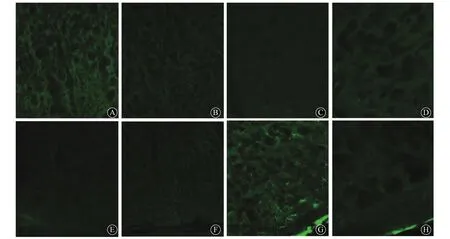
圖1 4組大鼠首次注藥后14和28 d時ACC中GFAP蛋白表達(免疫熒光染色,×400)
3 討 論
本研究結果提示,鞘內阻斷CXCL12/CXCR4趨化因子軸可以引起中樞神經系統ACC中GFAP表達水平降低,緩解NP的癥狀。
NP的一個重要發病機制是中樞敏化。研究[5]結果表明,除神經元之外,神經元周圍的膠質細胞(星形膠質細胞和小膠質細胞)在慢性疼痛中樞敏化的產生和維持中發揮著不可忽視的作用。在正常情況下,神經系統中的星形膠質細胞和小膠質細胞處于未激活狀態,但在神經損傷或神經系統疾病時會被激活,處于反應性狀態,并參與神經疾病的發生和發展過程。CXCL12/CXCR4趨化因子軸是由CXCL12與其特異性受體CXCR4相互作用而構成的與細胞間信息傳遞、細胞遷移有密切關系的耦聯分子對[6-7]。大量研究結果表明,在骨癌痛、炎性痛、腫瘤轉移等模型中CXCR4表達均上調[8-9],抑制CXCR4可緩解痛覺過敏。CXCL12及其受體CXCR4如何參與NP的發生和維持,以及其是否與膠質細胞有關目前尚未知曉。
本研究在SNI模型大鼠鞘內注射CXCR4特異性抑制劑AMD3100阻斷CXCL12/CXCR4趨化因子軸,采用免疫熒光法觀察大鼠ACC中GFAP蛋白質表達,結果顯示,SNI未治療組和SNI治療組大鼠ACC中GFAP蛋白質表達在首次注藥后14、21 d前與假手術未治療組和假手術治療組的差異均無統計學意義;但在首次注藥后28、35 d時SNI未治療組ACC中GFAP蛋白質表達明顯上調,而SNI治療組ACC中GFAP蛋白質表達量明顯低于SNI未治療組。由此可以推測,CXCL12/CXCR4趨化因子軸參與NP的發生和維持與星形膠質細胞有關。Tanga等[10]應用實時反轉錄PCR技術研究脊神經橫斷損傷模型發現,外周神經損傷后,小膠質細胞激活早于星形膠質細胞。可以推測,外周神經損傷后首先導致小膠質細胞活化,活化的小膠質細胞產生趨化因子、細胞因子,產生的趨化因子與神經元表面的CXCR結合后產生更多的趨化因子、細胞因子,這些趨化因子激活星形膠質細胞,使星形膠質細胞持續高表達。星形膠質細胞活化與趨化因子CXCL12和神經元表面CXCR4結合有關,也與NP持續存在有關。星形膠質細胞參與較晚期的NP,維持較持久的疼痛狀態。鞘內注射AMD3100后可能阻斷了小膠質細胞釋放的CXCL12與神經元表面CXCR4結合,阻止星形膠質細胞的進一步激活和兩者之間的級聯放大效應,從而阻止中樞敏化,緩解患者的疼痛。
ACC參與痛覺特別是痛情緒信息的編碼[11]。對于罹患殘肢痛、患肢痛、腦卒中后疼痛等NP患者來說,慢性疼痛無疑是一種痛苦的記憶。本研究結果顯示,4組術前PWT基礎值的差異無統計學意義,SNI未治療組在首次注藥后7、14、21、28、35 d的PWT均顯著低于假手術未治療組和假手術治療組同時間點,提示NP制模成功;同時SNI治療組在首次注藥后14、21、28、35 d時的PWT顯著高于SNI未治療組同時間點,表明通過鞘內阻斷CXCL12/CXCR4趨化因子軸可以緩解NP,且NP早期緩解不明顯,與遲發性GFAP表達減少基本相符。提示在NP時ACC中GFAP的生成與CXCL12/CXCR4趨化因子軸有關,而GFAP水平影響NP的疼痛程度。
綜上所述,CXCL12/CXCR4趨化因子軸在SNI模型中參與痛覺過敏的形成,其機制可能與中樞神經系統內ACC中星形膠質細胞的激活有關。星形膠質細胞參與較晚期的NP,維持較持久的疼痛狀態。不過目前尚不清楚CXCL12/CXCR4趨化因子軸與膠質細胞的相互作用與何種信號通路有關,尚需進一步深入研究。

