綿羊miR-1基因前體序列的多態性分析
,,,,,
(石河子大學 生命科學學院,新疆 石河子 832003)
MicroRNA(miRNA)是一類新型高度保守的含有21~25個核苷酸的內源性非編碼RNA,它能通過與真核生物中的靶mRNA特異性相互作用,在轉錄后水平調節基因的表達[1-2]。miRNA已經成為新的基因調控者,其表達具有組織特異性,同時廣泛存在于生物學過程中并發揮重要作用,例如細胞分化與細胞增殖[3-4]、卵母細胞成熟與卵巢卵泡發育[5-6]、代謝與細胞凋亡[7-8]、骨骼肌生長[9]。
在miRNA上存在一段識別靶位點的序列,這個序列也被稱為“種子序列”[10]。如果在種子序列區域發生突變,將會影響miRNA與靶基因的識別,以致于引發一系列疾病[11]。通過對人的miR-96研究發現,在其種子序列區域發生的突變,會導致常染色體顯性,從而引起漸進性聽力喪失[12]。在miR-206的種子序列區域構建人工突變,會破壞它與人表皮生長因子受體hER-α-1和hER-α-2識別位點的結合[13]。
肌細胞生成是控制肌肉增殖和分化相關轉錄因子網絡協調的復雜過程[14]。大量證據表明,miRNA可以通過增強轉錄控制來調控肌肉的生長和分化,在形態學中發揮重要作用[15]。通過大量研究發現,肌肉中含有一系列肌源性miRNA(Myogenic microRNA,myomiR),包括miR-1、miR-133a、miR-133b、miR-206、miR-208、miR-208b、miR-486、miR-499等[16-19]。因此,myomiR功能的改變可能會顯著影響肌肉表型,所以miRNA在骨骼肌的生長和發育過程中起著十分重要的調控作用[20]。
研究表明,miR-1在綿羊骨骼肌中的表達量很高[21],但是miR-1在不同綿羊群體中的多態性檢測以及功能分析還未見報道。目前,miRNA多態性的相關研究主要集中在其與疾病發生之間的關系上,而對其他的生物學功能研究較少。因此,以綿羊miR-1基因前體序列為研究對象,采用不對稱聚合酶鏈式反應-單鏈構象多態性(PCR-SSCP)技術分別對具有不同產肉性能的引進品種(薩福克羊)和地方品種(湖羊)綿羊群體進行單核苷酸多態性(SNP)檢測,并分析其與綿羊產肉量之間的相關性,為優良產肉型綿羊的選育提供依據。
1 材料和方法
1.1 樣品采集與基因組提取
40份湖羊的肌肉組織采集自新疆烏魯木齊屠宰場,39份薩福克羊的肌肉組織采集自新疆昌吉州瑪納斯縣新澳畜牧有限責任公司。將采集到的肌肉樣品儲存在凍存管內,做好標記后放在-80 ℃冰箱中保存備用。剪取湖羊、薩福克羊的肌肉組織,使用基因組DNA提取試劑盒提取肌肉組織的基因組DNA。通過Nanodrop 1000對提取的基因組DNA進行OD(260/280)值檢測。
1.2 引物設計與合成
由于綿羊miR-1基因前體的成熟序列還未公布,故從miRBase數據庫查詢牛miR-1基因的前體序列(登錄號為MI0009719,ID為bta-miR-1),與NCBI綿羊基因組數據庫進行比對,截取前體序列及其左右側翼各200 bp的序列,設計特異性引物,送至北京睿博興科生物技術有限公司合成。引物序列如表1所示。

表1 綿羊miR-1基因前體PCR引物序列
1.3 PCR擴增
PCR反應體系(20 μL):2×TaqPCR MasterMix 10 μL,上游引物與下游引物(10 μmol/L)各0.5 μL,DNA模板(20 ng/μL) 2 μL,加ddH2O至20 μL。PCR反應條件:94 ℃預變性5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 50 s,共30個循環;72 ℃延伸10 min,4 ℃保存。PCR產物采用1%瓊脂糖凝膠進行電泳檢測。
1.4 綿羊miR-1基因前體序列的不對稱PCR-SSCP分析
由于傳統的PCR-SSCP技術存在變性不完全的缺陷,因此,本研究采用不對稱PCR-SSCP擴增的方法,即用1.3中的PCR產物為模板,利用其中1條引物與另1條引物以不同添加比例進行第2次PCR擴增,擴增出目的片段的單鏈(ssDNA)。第2次PCR擴增反應體系也為20 μL,其中2×TaqPCR MasterMix 10 μL,上游引物與下游引物(1條引物的濃度與第1次PCR擴增一致,與另1條引物濃度的比例為100∶1)各0.5 μL,模板(第1次PCR擴增產物)2 μL,加ddH2O至20 μL。
1.5 不對稱PCR-SSCP檢測
取4 μL擴增的單鏈DNA,與3 μL上樣緩沖液進行充分混合,樣品在非變性聚丙烯酰胺凝膠(10%PAGE,Acr∶Bis=39∶1)中進行電泳,電泳條件:4 ℃、120 V過夜,12~14 h左右終止電泳。凝膠處理采用銀染的方法進行,具體步驟包括:固定、染色、顯影、觀察并拍照。根據帶型的不同,選取與之相對應的PCR產物送至北京睿博興科生物技術有限公司進行測序分析。
1.6 單核苷酸多態性SNP位點對miR-1基因前體序列構象的影響分析
測序后獲得突變基因序列及突變位點,采用RNA二級結構在線預測軟件(http://rna.urmc.rochester.edu/RNAstructureWeb/index.html)對野生型和突變型的綿羊miR-1基因前體序列進行二級結構預測,并通過ΔG的變化比較2種構象的差異及穩定性。
1.7 數據處理
利用SPSS軟件對SNP位點在不同產肉性能綿羊品種中的基因型頻率、等位基因頻率和Hardy-Weinberg平衡進行計算。
2 結果與分析
2.1 不對稱PCR-SSCP分型及測序
利用設計的特異性引物對湖羊和薩福克羊2種不同產肉性能綿羊品種的基因組DNA進行PCR擴增,miR-1基因前體序列的PCR擴增片段為254 bp,與預期結果一致,達到PCR-SSCP檢測的標準,可用于檢測,部分PCR擴增產物瓊脂糖凝膠電泳結果如圖1A所示。PCR-SSCP分析結果如圖1B所示,miR-1基因前體序列在以上2種不同產肉性能綿羊品種中具有3種基因型(AA型、AG型和GG型)。
將3種基因型所對應的PCR產物進行回收純化后測序,并通過序列比對分析,結果發現,在綿羊miR-1基因前體序列的下游115 bp處發現1個A→G的單堿基突變(圖1C)。
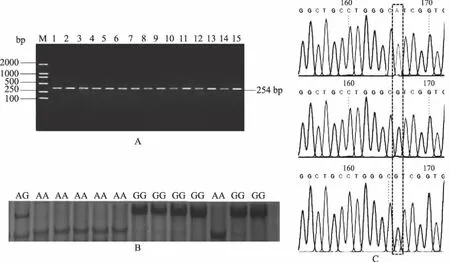
A.部分PCR產物瓊脂糖凝膠電泳,M為DL2000 DNA Marker,1—15為部分PCR產物; B.部分樣品非變性聚丙烯酰胺凝膠電泳,AA、AG和GG分別為檢測到的3種帶型; C.不同基因型樣品測序峰圖,單峰為純合子AA和GG,套峰為雜合子AG圖1 miR-1基因前體序列PCR產物凝膠電泳與PCR-SSCP分型和測序結果
2.2 miR-1基因前體序列SNP位點的基因型頻率和等位基因頻率
通過PCR-SSCP分型后,對2個不同產肉性能綿羊品種的miR-1基因前體序列SNP位點進行基因型頻率與等位基因頻率計算,同時檢測該SNP位點在各群體中是否處于Hardy-Weinberg平衡,結果如表2所示。薩福克羊是從國外引進的典型優良肉羊品種,有較高的產肉性能,其中GG基因型頻率為0.74,屬于優勢基因型,G等位基因頻率為0.76,是A等位基因頻率的3.17倍。而湖羊屬于我國地方品種,相比之下產肉性能差,在湖羊群體中沒有檢測到AA基因型。一方面可能是由于在湖羊中不存在此基因型,另一方面可能是樣本量較少的緣故。遺傳分析結果表明,薩福克羊在該SNP位點處于Hardy-Weinberg平衡狀態(P>0.05),湖羊處于不平衡狀態(P<0.05)。
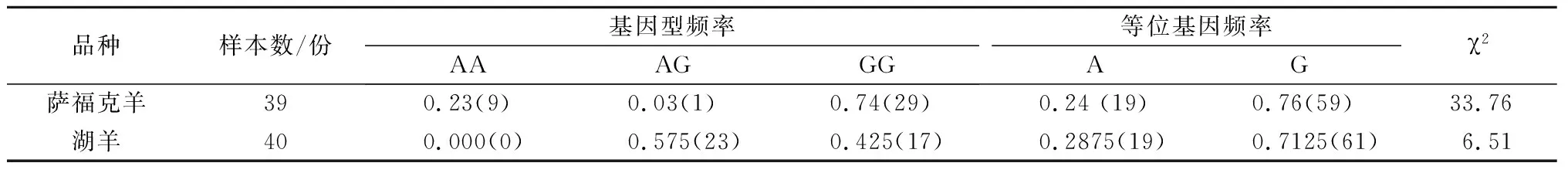
表2 miR-1基因前體序列SNP位點基因頻率與基因型頻率及Hardy-Weinberg平衡狀態
注:括號內為不同基因型或等位基因的個體數。
2.3 miR-1基因前體序列的同源性分析
從NCBI數據庫中查詢綿羊(NC 019470.2)、牛(NC 007311.6)、馬(NC 009151.2)、人(NC 018931.2)、猩猩(NC 012611.1)、豬(NC 010459.5)、小鼠(NC 000068.7)的miR-1前體序列及其側翼各200 bp序列,使用MEGA 5.0軟件對miR-1基因前體序列的同源性進行分析并構建進化樹,結果如圖2所示,綿羊miR-1基因前體序列與偶蹄目中牛的同源性達到100%,由于小鼠在進化上較落后,因此同源性較差。

圖2 miR-1基因前體序列的遺傳進化樹
2.4 SNP位點對 miR-1基因前體序列構象及穩定性的影響
采用RNA二級結構在線預測軟件(http://rna.urmc.rochester.edu/RNAstructureWeb/index.html)對野生型和突變型綿羊的miR-1基因前體序列進行二級結構預測,結果如圖3所示,當miR-1基因前體成熟序列下游115 bp 處的堿基A發生單堿基突變后,miR-1基因前體序列的二級結構發生巨大變化,由-117.7 kJ/mol降低到-119.2 kJ/mol,△G降低1.5 kJ/mol,使其二級結構更加穩定。由于該突變發生在頸環結構的頸部,這種改變很有可能會對miR-1的靶基因造成影響,并最終使其對靶基因的調控發生改變。
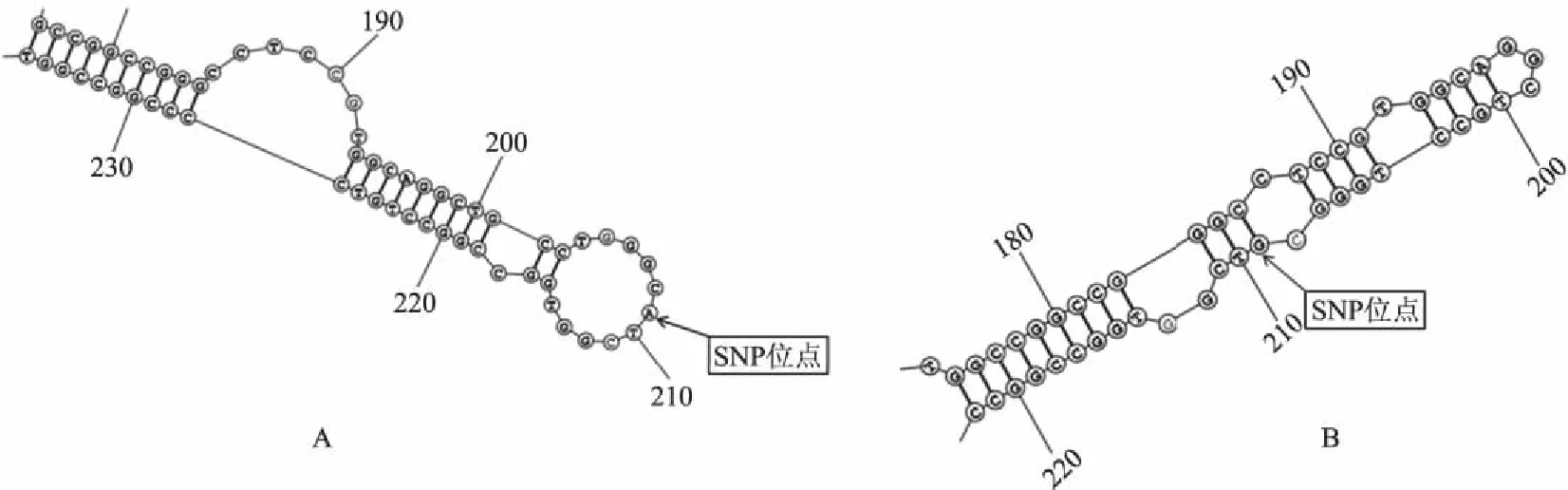
A.野生型綿羊的miR-1基因前體序列;B.突變型綿羊的miR-1基因前體序列圖3 綿羊 miR-1基因前體序列二級結構預測
3 結論與討論
miRNA在生物體內參與調控基因表達。近年來,對調控骨骼肌基因相關的研究已經成為一個熱點,同時也受到科學家們的廣泛關注。基因變異會導致miRNA介導的基因調控發生異常,進而可能會導致表型發生改變[22]。近幾年的研究發現,肌肉生長抑制素(Myostatin,MSTN)與miRNA密切相關,miRNA能夠參與MSTN基因的調控,特克賽爾(Texel)綿羊的肌肉異常發達就是由于MSTN基因mRNA的3′-UTR發生突變引起,它能夠與肌肉特異性miRNA相關的miR-1和miR-206創建靶點,從而下調MSTN基因的表達[23]。此外,myomiR也可通過調節多種靶基因廣泛影響肌肉的發育和功能[24-26]。科學家在對果蠅和家蠶的研究中發現,miR-1也是生存相關的重要基因,含有其突變體的幼蟲肌肉組織呈現萎縮狀態,而且幼蟲的運動逐漸減少直至死亡[27-28]。因此,miRNA基因的遺傳變異可以改變miRNA的生物發生和它們與靶mRNA的結合[29-30],如果該突變發生在種子序列區域,還將會導致靶向功能下降,并最終引起性狀發生改變,繼而引發一系列疾病[11-13]。
本研究確定了綿羊miR-1基因前體序列中存在1個SNP位點,它與miRNA初級轉錄物區域內的miRNA前體序列相連并位于其下游。同時評估了miR-1基因前體序列的該SNP位點對綿羊產肉性能的影響,發現其與綿羊的產肉性能存在明顯的相關性,可能會增加綿羊的產肉量。本研究所選用的薩福克羊是從國外引進的優良肉羊品種,G等位基因頻率達到0.76,是A等位基因頻率的3.17倍。湖羊是我國地方品種,產肉性能方面不及薩福克羊。同時,由于湖羊群體可能受到雜交改良與選育的影響,因此在湖羊群體中野生純合AA基因型未檢測到,GG基因型向優勢基因型進行過渡。由此可見,該SNP位點可能是選育優良產肉型綿羊的重要依據。與此同時,對綿羊miR-1基因前體序列突變前后的二級結構進行預測發現,該突變位點可能會對miR-1的靶基因造成影響,從而影響其調控,進一步影響到骨骼肌的生長和發育。
綜上,綿羊產肉性能的高低不僅取決于基因的遺傳,還取決于miRNA的表觀遺傳學控制。目前,miRNA的研究重點主要在醫學方面,近幾年,對于miRNA的研究方向也逐漸向畜牧生產方面進行過渡,本研究為優良產肉型綿羊的選育提供有力的支持。

