成年商品豬大腸腸道菌群的計數與分析
■李 慧 楊大容 劉寶生
(江西農業大學動物科學技術學院,江西南昌330045)
動物腸道菌群與動物的生長及健康關系密切,成年動物腸道中長期定居著大約1014個微生物個體,是動物自身體細胞數量的十倍[1]。在這些微生物個體中,其中絕大部分是細菌。這些細菌按動物腸道內營養物質及微環境的不同而進行相對穩定的分布[2],可以為宿主提供相當于自身擁有基因數量150倍以上的額外基因儲備[3]。這些基因增強了動物自身的代謝能力,可為宿主合成機體必需的氨基酸、維生素,同時還可降解協助宿主從自身無法降解的非淀粉多糖中獲得能量[4]。因此很多學者已經將動物腸道內的微生物菌群當作機體的一個重要的器官來看待[5]。
豬是畜牧業中提供肉食品的重要雜食性經濟動物,同時也是研究人的腸道內生菌群的主要模型動物[6]。在過去的幾十年間,雖然在豬腸道菌群的結構、功能及與宿主關系等多方面都開展了很好的研究[7-8],但到目前為止,豬腸道內生菌群的真實狀況卻仍然不夠清楚。本研究利用5種常用的培養基,通過對成年健康商品豬的大腸腸道不同區段內正常菌群的分離、計數,從而分析健康成年豬大腸腸道正常菌群的結構,同時也比較不同培養基對豬腸道菌群分離培養的效果。
1 材料與方法
1.1 樣品的采集
從江西省某大型生豬屠宰加工基地隨機選擇健康成年商品肉豬3頭,鑒于菌群分離計數的工作量比較大,為避免腸道菌群在樣品保存過程中產生明顯變化,本研究的樣品采集分3次獨立進行,每次只采集1頭豬的腸道內生菌群。采樣時,利用生豬生產加工基地的生產設備和人員進行豬的屠宰,生豬宰殺完成后,完整地取出豬的整個腸道,置于冰盒中,迅速轉運回實驗室進行腸道菌群的采集。
在腸道菌群采集時,根據豬大腸的解剖學結構分為盲腸、結腸和直腸三段。同時根據每段腸段的長短不同,分別采集2、3、3個樣品。在盲腸段,采樣點分別為回盲口附近和盲腸的盲端頂端,結腸段為降部中段、圓錐頂部和升部中段,直腸段則在前、中、后部分別采集殘留在直腸中的糞便。無菌操作,分別從各采樣點采集20~30 g的腸內容物至事先已滅過菌的50 ml離心管中,盲腸部分的樣品分別標記為M1、M2,結腸部分的樣品分別標記為J1~J3,直腸部分的樣品標記為Z1~Z3。所有樣品均加蓋密封,然后置于4℃冰箱中保存備用。
1.2 培養基的制備
本試驗共選用了5種常用的非選擇性培養基:PCA(plate count agar)、NA(nutrient agar)、TSA(tryptic soy agar)、LB 營養瓊脂(Luria-Bertani nutrient agar)和 標 準 Ⅰ號 瓊脂(standard I nutrient agar,StdI)。按培養基(配方組成見表1)的制備操作說明,分別用直徑為9 cm的一次性無菌培養皿制備好相應的瓊脂平板,備用。
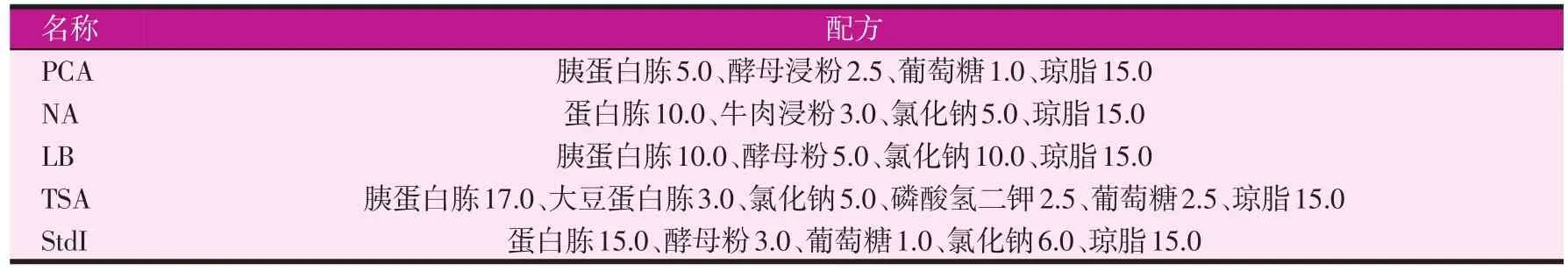
表1 五種常用非選擇性培養基的配方(g/l)
1.3 腸道菌群的分離與培養
1.3.1 樣品的前處理
從4℃冰柜中取出事先采集并保存的豬腸道各腸段樣品,準確稱量并記錄裝有目標腸段樣品的試管總重量。無菌操作,用滅菌后的不銹鋼干凈藥勺移取目標腸段樣品約1 g,轉入一個15 ml的離心管中,用滅菌生理鹽水進行10倍稀釋,然后將離心管置于旋渦振蕩器上高速振蕩5~10 min。為盡可能地避免因為儲存而導致的樣品中菌群數量的減少,每次采集的樣品必須在3 d內完成菌群的分離與培養。
1.3.2 樣品的十倍梯度稀釋
無菌操作,用滅菌生理鹽水,將充分混勻震散的腸道菌群按10倍梯度稀釋法依次制備成最適涂板計數的三個連續梯度稀釋液。根據預備試驗的結果,不同腸段樣品的三個最適連續稀釋梯度依次選擇為:盲腸 10-5、10-6、10-7,結腸 10-7、10-8、10-9,直腸10-7、10-8、10-9。
1.3.3 腸道菌群的培養
本試驗采用平板涂布法對樣品中的菌群進行分離培養,五種不同的培養基分別同時接種相同的三個連續梯度稀釋液。無菌操作,用移液器移取各樣品的連續梯度稀釋液100 μl于事先制備并標記好的培養基平板中央,用玻璃涂抹棒將菌液在整個平板表面涂抹均勻,每一樣品同一稀釋度每次涂布兩個平行平板。將涂布好后吸收完全的平板轉移至37℃的培養箱中倒置培養18~24 h,待其長成清晰而又不互相粘連的菌落時即可開始進行菌落計數。
1.3.4 菌落計數
根據菌群分離的效果,選取菌落數在30~300個之間的平板進行計數,對同一類型的粘連菌落只計數一次,不同類型的重疊菌落單獨計數。每一樣品每個稀釋度的最終菌落數為兩個平行平板的平均值。
1.4 數據處理
不同腸段或采樣點之間菌群數量的差異,以及不同培養基對腸道菌群計數效果的差異均采用SAS 9.4的ANOVA或GLM過程進行方差分析,當P<0.05時,表示差異顯著。
2 結果
2.1 不同腸段的菌群計數結果
按菌落計數的規則,從連續梯度平板中,選擇平行性好,菌落數在30~300個之間的平板進行菌落計數。不同培養基對各腸段不同采樣點菌群計數的結果見表2。
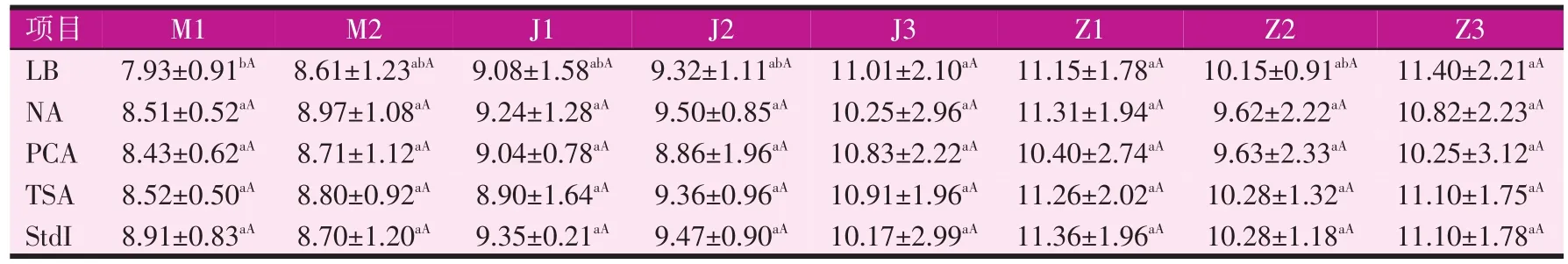
表2 五種培養基對成年豬大腸不同腸段菌群計數結果[lg(cfu)/g]
從表2可以看出,從回盲口(M1)到直腸前段(Z1),隨著采樣位點的向后延伸,腸道內生菌群活菌數量呈現遞增趨勢,但經SAS 9.4的ANOVA過程統計分析的結果表明,除LB培養基的結腸J3位點及直腸Z1、Z3位點的活菌數顯著(P<0.05)高于盲腸的M1位點外,其余各腸段采樣點間活菌數量均無顯著差異(P>0.05)。試驗中所用到的其他4種培養基對豬大腸中不同位點菌群的活菌計數結果均未呈現顯著性差異(P>0.05)。
從上述各腸段不同位點的活菌計數結果來看,盲腸的M1與M2位點,結腸的J1、J2與J3位點,以及直腸的Z1、Z2、Z3三個位點在五種不同的培養基中,菌群計數結果均顯示差異不顯著(P>0.05)。這一結果說明在成年豬同一腸段的不同位點之間,其菌群的活菌數量沒有明顯差異。因此,我們可以將盲腸、結腸和直腸內的不同位點之間的樣品計數結果進行合并分析,從而可以得出不同培養基對成年商品豬盲腸、結腸和直腸內菌群的計數結果(見表3)。合并后的數據采用SAS 9.4的GLM過程進行組間方差顯著性檢驗,差異顯著性水平仍為P=0.05。
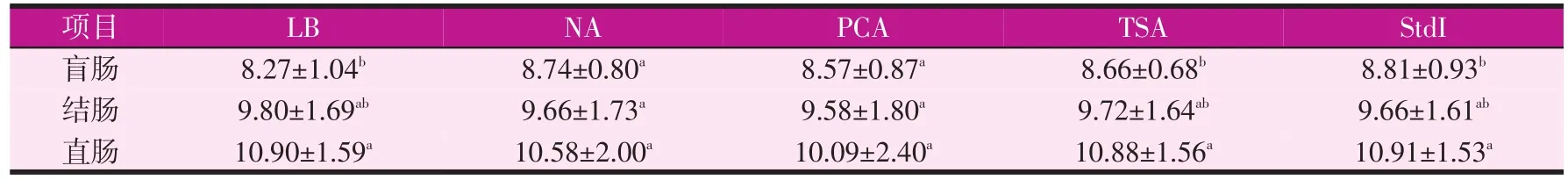
表3 不同培養基對豬大腸段的活菌計數結果[lg(cfu)/g]
從表3中可以看出,5種培養基中,NA、PCA兩種培養計數所得結果盲腸、結腸和直腸之間沒有明顯區別(P>0.05),而培養基LB、TSA和StdI的培養結果則顯示出直腸內的固有菌群數量明顯比盲腸多(P<0.05)。有趣的是,在所有的5種培養基中,結腸內活菌的計數結果均與盲腸和直腸無顯著性差異(P>0.05),這從一個方面說明了結腸不僅在結構上是盲腸向直腸的過渡,而且在腸道內生菌群數量上,也具有過渡的特征。
2.2 不同培養基對豬腸道菌群計數的影響
本試驗選用5種實驗室常用的非選擇性培養基對豬大腸不同位點的內生菌群進行活菌計數的結果見表2。經SAS統計分析,結果表明5種培養基對豬大腸相同位點樣品的菌群活菌計數結果均不存在顯著性差異(P>0.05)。但從表3合并后分析的數據結果來看,培養基NA、PCA檢測的結果要比LB、TSA和StdI的稍低。因此,如果從最大限度地培養腸道菌群數量的角度出發,培養基LB、TSA和StdI的效果要比NA和PCA好。
3 討論
3.1 成年商品豬大腸不同腸段腸道可培養菌群的分布
在動物腸道內,不同腸段因為其功能不同,腸內容物的組成和性狀差異很大,因此,腸內容物中微生物的種類和數量也不可能完全一樣。在本試驗中,因為五種不同培養基對同一位點的菌群計數結果無顯著性差異(P>0.05,見表2),因此,我們可將同一腸段不同培養基的計數結果取平均值作為該腸段的檢測值,進一步分析各腸段間菌群數量的關系。結果表明,在豬的大腸中,從盲腸到直腸,整個腸段的內生菌群數量沿腸管的延續方向向后逐漸增加,盲腸、結腸和直腸之間,其內生菌群的數量均具有顯著性差異(P<0.05,見表4)。Butine等[9]曾對生長肥育豬盲腸和結腸的厭氧菌群進行活菌計數,結果同樣表明結腸內的活菌數量顯著高于盲腸。

表4 豬大腸不同腸段間的活菌計數統計分析[lg(cfu)/g]
3.2 不同培養基對豬腸道菌群分離培養的影響
不同的培養基配方,因為其營養組成成分的差異性,必然會對所培養的菌群具有一定的選擇性。本試驗的結果表現為:不同培養基對豬腸道同一位點菌群的活菌計數結果可能不同。在用LB培養基進行活菌計數時,J3、Z1和Z3的菌群數量明顯要比M1多(P<0.05),而其他四種培養基雖然都存在順著腸道的延續,從前至后菌群數量逐漸增加的趨勢,但未呈現顯著性差異(P>0.05)。
4 結論
本試驗利用5種實驗室常用的非選擇性培養基對成年商品豬大腸內8個位點的內容物進行了活菌計數,結果表明從盲腸、結腸到直腸,腸道內生菌群的數量沿腸道向后依次顯著增加(P<0.05),同時,在盲腸、結腸和直腸的同一節段內,不同位點的菌群數量差異不顯著(P>0.05),即同一節段之間菌群活菌數量相似。本試驗的結果可為進一步研究飼料中不同添加劑對豬腸道正常菌群的影響提供依據。

