C H F=C H C l分子的特性研究
梁冬梅 荊 濤 * 孫光宇
(1.凱里學院理學院,貴州 凱里 556011;2.貴州師范學院物理與電子工程學院,貴州 貴陽 550018)
0 引言
近年來的實驗和理論研究發現, 二鹵代乙烯類化合物順式構型的穩定性明顯優于反式構型的穩定性[1-4]。并且,樊曉偉等[5]對化合物二氟代乙烯使用不同的基組進行計算發現, 使用小基組計算的總能量和軌道能量并不收斂, 甚至會給出錯誤的能級排序, 而使用較大基組計算的數值更接近于實驗值。 因此, 為了給出正確的計算結果,本文使用與文獻[5]相同的基組進行計算。
1 理論和計算方法
外電場存在時,哈密頓量H 可用下式求出,H=H0+Hint, (1)
上式中Hint的含義為, 當分子處在偶極近似條件下,外電場和分子體系之間的相互作用。 其表達式為,Hint=-μ·F (2)
在(2)式中,變量μ 表示偶極矩。
若哈密頓量Hint為零,有H=H0, (3)
從Grozema 等[6-7]創立的模型看,有外電場存在時的激發能Eexc為,
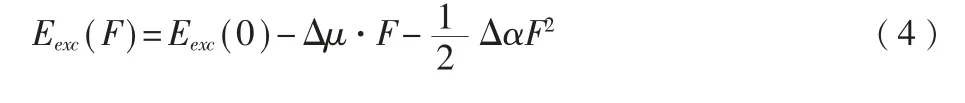
其中,在無外電場時的激發能,Eexc(F)=Eexc(0)。(5)
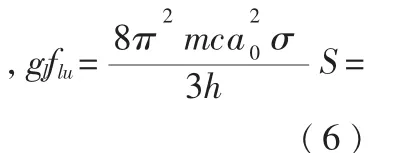
在上面的公式中包含了幾個重要的量, 它們分別是加權因子、線強度和波數,用字母表示為gl、S、σ,加權因子的大小為1,線強度的單位為e2a2
0。
按照CHF=CHF 分子的標準坐標, 在B3LYP/6-311++G(3df, 3pd)基組的基礎上對該分子的基態結構進行優化, 在此基礎上對其激發態能量等物理量進行了計算。 所有計算均在Gaussian03 軟件包[9]進行。
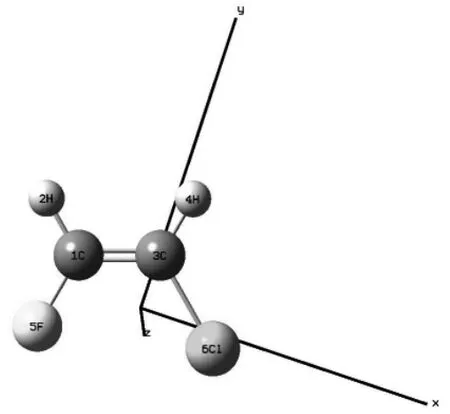
圖1 CHF=CHCl 分子的基態結構
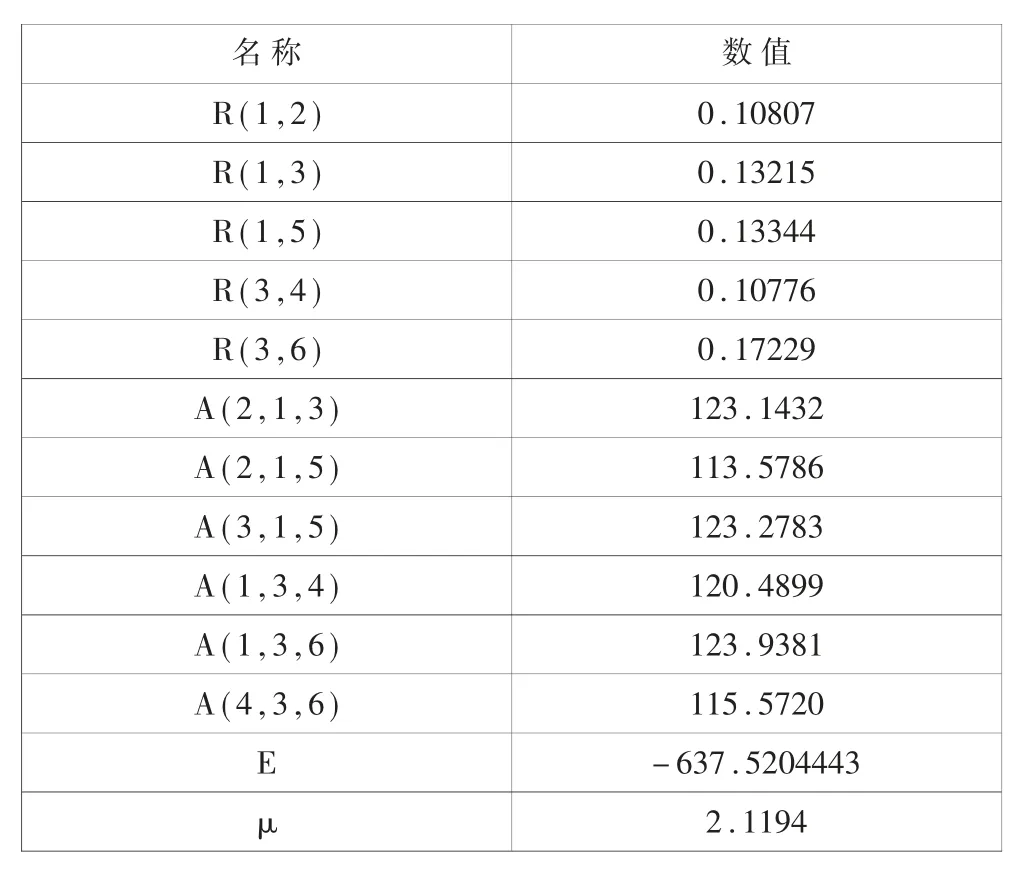
表1 優化的CHF=CHCl 分子基態鍵長(R/nm)、鍵角(A/deg)、總能量(E/a.u.)和偶極矩(μ/debye)
2 計算結果與討論
2.1 CHF=CHCl 分子的基態穩定構型
CHF=CHCl 分子的結構如圖1 所示。采用密度泛函理論(DFT)中的B3LYP,以6-311++G(3df,3pd)作為基函數,對其進行結構優化,得到該分子的基態鍵長、鍵角和總能,如表1 所示。
從表1 可以看出,分子的鍵長在0.10776~0.17229 nm之間變化,鍵角在113.5786~123.2783deg 之間變化,基態總能量為-637.5204443 a.u.,偶極矩為2.1194。
2.2 CHF=CHCl 分子的激發特性
在得到CHF=CHCl 分子穩定構型的基礎上, 采用CIS-B3LYP/6-311++G(3df, 3pd)方法研究了該分子的前8 個激發態的激發能E、激發波長λ 和振子強度,如表2 所示。
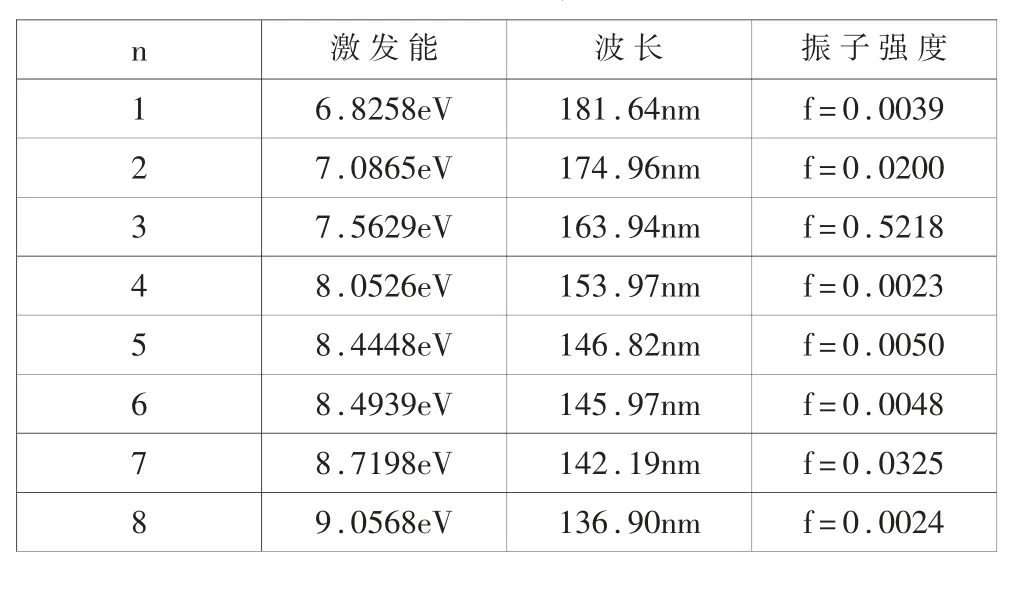
表2 分子CHF=CHCl 的激發態能量、激發波長和振子強度
通過表2 可以得出以下規律, 分子從基態躍遷到前8 個激發態, 激發態能量不斷增大, 激發態波長不斷減少。 如圖2 所示, 激發能從6.8258eV 增加到9.0568eV,而波長從181.64nm 下降到136.90nm。 振子強度就是振子數,從表2 可以看出,在從基態躍遷到激發態的過程中,振子強度并不為零,但大小不同。特別是從基態躍遷到第三個激發態, 振子強度f 達到了0.5218,有明顯的電子躍遷發生, 而從基態躍遷到第七個激發態,振子強度f 為0.0325,振子強度比較小,在實驗上即使有電子躍遷發生,也非常微弱,基本上觀察不到。 其它從基態躍遷到此激發態(n=1,2,4,5,6,8),振子強度非常小,在實驗上觀察不到躍遷發生。
3 結論
本文采用B3LYP/6-311++G(3df,3pd)方法得到了CHF=CHCl 分子的基態穩定構型, 討論了分子的總能量、偶極矩和激發特性。 結論如下:
(1) 分 子 的 鍵 長 在0.10776 ~0.17229nm 之 間 變 化,鍵角在113.5786 ~123.2783deg 之間變化, 基態總能量為-637.5204443 a.u.,偶極矩為2.1194。
(2) 采用CIS-DFT 方法研究了分子的激發特性。分子的激發波長隨激發能的增大逐漸減小, 變化的快慢與激發能的變化快慢相關, 但并沒有在可見光區出現。 振子強度的大小不受激發能的影響, 電子躍遷的情況較為復雜。 從基態躍遷到第三激發態, 可以觀察到明顯的電子躍遷, 其它情況的振子強度較小, 基本上觀察不到躍遷現象發生。

