DEX與異丙酚在中重度顱腦損傷患者鎮(zhèn)痛鎮(zhèn)靜中的應用效果及對血清β-內啡肽、炎癥因子、腦氧代謝的影響
張立群,韓 俊,陳祖濤
流行病學研究證實,中重度顱腦損傷(severe traumatic brain injury,TBI)的發(fā)病率可達273~493/1萬人[1]。臨床上TBI能夠導致患者病死風險的顯著上升,增加患者多器官功能障礙風險[2]。TBI患者體內存在明顯的腎上腺素-交感神經系統(tǒng)的激活,體內多種病理性因子能夠顯著增加患者的疼痛體驗,加劇體內的氧化應激性損傷[3]。對于TBI的鎮(zhèn)痛治療具有重要的價值,其不僅能夠降低患者的疼痛評分,同時還能夠抑制局部兒茶酚胺的釋放并減輕腦組織局部自由基的損傷。現階段臨床上主要通過異丙酚進行鎮(zhèn)痛鎮(zhèn)靜治療,雖然其能夠在短時間內改善患者的焦慮、躁動不安和疼痛等癥狀,但治療后患者體內的氧化應激性反應仍然較為明顯[4]。右美托咪定(dexmedetomidine,DEX)是中樞性的a2受體激動劑,能夠有效發(fā)揮鎮(zhèn)靜和鎮(zhèn)痛的效果,抑制腎上腺素-髓質系統(tǒng)的激活,降低氧化應激反應的程度,進而輔助治療TBI[5-6]。筆者醫(yī)院2015年1月—2016年12月收治119例中重度TBI患者,對比DEX及異丙酚鎮(zhèn)痛鎮(zhèn)靜治療的臨床效果,以指導臨床上TBI的鎮(zhèn)痛鎮(zhèn)靜治療。
臨床資料
1 一般資料
對筆者醫(yī)院2015年1月—2016年12月連續(xù)收治的119例中重度TBI患者進行前瞻性研究,采用隨機數字表法分為DEX組59例、異丙酚組60例。DEX組:男性39例,女性20例;年齡28~66歲,平均45.5歲;入院時GCS 6~13分,平均9.6分;入院時心率(74.3±13.2)次/min,收縮壓(SBP)(112.2±9.6)mmHg。異丙酚組:男性43例,女性17例;年齡25~65歲,平均43.8歲;入院時GCS評分6~13分,平均9.4分;入院時心率(75.0±11.8)次/min, SBP(110.8±10.2)mmHg。兩組研究對象的年齡、性別、入院時基本情況比較,差異無統(tǒng)計學意義(P>0.05)。
納入標準:(1)患者創(chuàng)傷史明確;(2)GCS評分6~13分;(3)入院時患者的SBP>95mmHg;(4)心率>60次/min;(5)在筆者醫(yī)院實施開顱手術治療;(6)本研究獲得醫(yī)學倫理委員會的批準、患者家屬的知情同意。
排除標準:(1)腦血管病史;(2)顱內占位病變、顱內動脈瘤破裂;(3)精神疾病;(4)免疫疾病;(5)既往伴有認知功能障礙;(6)伴有全身其他部位重大創(chuàng)傷;(7)出現休克、腦疝。
2 鎮(zhèn)痛、鎮(zhèn)靜方法
異丙酚組:給予異丙酚(四川國瑞藥業(yè),批號:13060514),負荷劑量為0.5~2.5mg/kg,在10min內注射完畢,2~5mg/(kg·h)靜脈維持72h,效果不佳可追加使用嗎啡鎮(zhèn)痛。DEX組:采用DEX(辰欣藥業(yè)股份有限公司,國藥準字H20090248)鎮(zhèn)痛,0.5~1.5μg/kg,30min靜脈滴注完畢,0.3~0.8μg/(kg·h)靜脈維持48h,鎮(zhèn)痛效果不佳可追加使用嗎啡鎮(zhèn)痛。
3 指標檢測方法
采集入院后靜脈血,離心后收集上清液,采用化學發(fā)光法檢測皮質醇、β-內啡肽(β-EP)水平,檢測儀器為美國Bio-Rad全自動酶標儀,配套試劑盒購自羅氏檢測公司;采用全自動生化法檢測白細胞介素-6(IL-6)、白細胞介素-10(IL-10)、腫瘤壞死因子-α(TNF-α)值,配套試劑盒購自南京碧云天生物檢測公司。
采用雅培i-STAT 300血氣分析儀檢測靜脈血氧飽和度(SjvO2)、頸內靜脈血氧分壓(PjvO2)、氧飽和度(SaO2)及血紅蛋白(Hb),腦含氧量(CjvO2)=Hb×1.36×SjvO2+0.031×PjvO2;腦氧攝取率(CEO2)=SaO2-SjvO2,CaO2=Hb×1.36×SaO2+0.031×PaO2,動脈-頸內靜脈球部血氧差[D-(a-jv)O2]=CaO2-CjvO2。
4 鎮(zhèn)痛鎮(zhèn)靜效果評估
采用Riker評分對患者的鎮(zhèn)痛鎮(zhèn)靜效果進行評估,主要包括7分:拉拽氣管內插管、試圖拔出各種導管插管、翻越床欄、攻擊醫(yī)護人員、在床上輾轉掙扎;6分:需要保護性束縛或反復的語言提醒、咬氣管插管;5分:焦慮或躁動、經語言勸阻提示可以安靜;4分:安靜、易喚醒、服從指令;3分:嗜睡、言語刺激及輕搖可以喚醒、能服從指令,但是又迅速入睡;2分:對軀體刺激有反應、不能交流及服從指令、有自主運動;1分:不能喚醒。
5 統(tǒng)計學分析
結 果
1 兩組患者Riker評分比較
給藥前,兩組患者的Riker評分差異無統(tǒng)計學意義(P>0.05),給藥2、4、12h后,DEX組的Riker評分均低于異丙酚組(P<0.05)。見表1。
2 兩組患者血清皮質醇、β-EP水平比較
給藥前,兩組患者的血清皮質醇、β-EP水平差異無統(tǒng)計學意義(P>0.05);給藥12h后,DEX組的血清皮質醇、β-EP水平均低于異丙酚組(P<0.05)。見表2。
3 兩組患者血清炎癥因子比較
給藥前,兩組患者的血清IL-6、IL-10、TNF-α水平差異無統(tǒng)計學意義(P>0.05);給藥12h后,DEX組的血清IL-6、IL-10、TNF-α水平均低于異丙酚組(P<0.05)。見表3。
4 兩組患者腦氧代謝指標比較
給藥前,兩組患者的CjvO2、D-(a-jv)O2、CEO2水平差異無統(tǒng)計學意義(P>0.05);給藥12h后,DEX組的D-(a-jv)O2、CEO2水平均低于異丙酚組(P<0.05),CjvO2水平高于異丙酚組(P<0.05)。見表4。
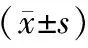
表1 兩組患者Riker評分比較
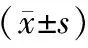
表2 兩組患者血清皮質醇、β-EP水平比較
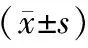
表3 兩組患者血清炎癥因子比較
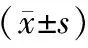
表4 兩組患者腦氧代謝指標比較
討 論
臨床上TBI 的發(fā)生在直接損傷腦組織的同時,還可通過其誘導的體內氧化應激反應、炎癥因子的激活及代謝性毒素的蓄積,進而促進殘留正常神經元鞘膜組織的損傷,導致腦組織低氧缺血性損害的發(fā)生[7]。特別是在合并有基礎性的高血壓或者糖尿病的患者中,TBI誘導的體內神經毒性因子的富集更明顯,星形膠質細胞的水腫和凋亡更嚴重[8]。臨床上對TBI患者的鎮(zhèn)痛鎮(zhèn)靜治療具有以下兩方面的意義:(1)有效的鎮(zhèn)靜鎮(zhèn)痛治療能夠顯著改善患者神經系統(tǒng)癥狀;(2)有效的鎮(zhèn)痛鎮(zhèn)靜治療能夠阻斷炎癥因子的釋放,抑制交感神經的興奮,降低神經元細胞的耗氧量,保護殘留的神經纖維。
異丙酚能夠通過對中樞神經系統(tǒng)的鈉離子和γ-氨基丁酸的調控作用,進而發(fā)揮鎮(zhèn)痛鎮(zhèn)靜作用。但長期的臨床隨訪研究認為,單純異丙酚輔助治療TBI的臨床效果較為局限,其治療后的TBI患者體內的交感-腎上腺素髓質系統(tǒng)激活的表現仍然較為明顯,體內的β-內啡肽(β-EP)及皮質醇水平仍然較高[9-10]。DEX能夠通過作用于中樞神經系統(tǒng)的a2受體,抑制神經纖維電沖動的傳遞,抑制腎上腺素-髓質系統(tǒng)的激活,降低患者體內的氧化應激性反應[11]。部分研究者探討了DEX在輔助治療TBI患者中的表現,認為DEX能夠顯著提高其抗焦慮、鎮(zhèn)痛的效果,并抑制血清炎癥因子IL-6、IL-10、TNF-α水平[12],但對于DEX治療后的皮質醇、β-EP及氧代謝指標的研究不足。
Riker評分是評估患者鎮(zhèn)靜效果的評分系統(tǒng),Riker評分越低鎮(zhèn)靜效果越好。本組DEX組鎮(zhèn)靜治療后的Riker評分明顯下降,低于異丙酚組,差異較為明顯,提示了DEX對于TBI患者鎮(zhèn)靜的臨床效果。通過匯集不同的相關文獻,筆者認為這主要與DEX以下兩方面的作用有關[13-14]:(1)DEX能夠顯著抑制中樞性a2受體,抑制中樞腦干藍斑神經沖動的傳出,進而發(fā)揮鎮(zhèn)靜效果;(2)DEX能夠參與到膽堿能神經信號通路的調控過程中,抑制膽堿能神經元的激活和突觸沖動的傳遞,進而發(fā)揮鎮(zhèn)靜效果。周文來等[15]也認為,DEX輔助鎮(zhèn)痛鎮(zhèn)靜治療后,TBI患者的Riker評分可平均下降25%以上,特別是在DEX治療時間較長、或聯(lián)合嗎啡鎮(zhèn)痛治療的過程中,Riker評分的下降程度更高。血清皮質醇能夠評估腎上腺素系統(tǒng)的激活程度,促進氧化自由基對于神經元的損傷,β-EP的表達能夠抑制呼吸、循環(huán)中樞,導致心血管中樞的調控障礙。本次研究中DEX治療后的TBI患者血清皮質醇、β-EP均明顯下降,低于異丙酚組,差異較為明顯,提示了DEX對于血清皮質醇、β-EP的抑制作用,這主要由于DEX能夠抑制交感-腎上腺髓質系統(tǒng)的活性,并能夠穩(wěn)定下丘腦-垂體系統(tǒng),抑制其過度激活導致的β-EP的合成和釋放。IL-6、IL-10、TNF-α是評估患者體內炎癥反應的指標,IL-6、IL-10、TNF-α的上升能夠加劇腦組織的損傷,增加腦血管的水腫,DEX治療后的患者其IL-6、IL-10、TNF-α明顯下降,低于異丙酚組,提示了DEX對于患者體內炎癥反應的抑制作用,這主要由于DEX能夠抑制NF-κB炎癥性信號通路的激活,并能夠抑制巨噬細胞的活性,降低炎癥因子的釋放速度。CjvO2、D-(a-jv)O2、CEO2的變化是評估腦氧代謝的指標,DEX組的D-(a-jv)O2、CEO2水平明顯下降,而CjvO2水平明顯上升,提示DEX能夠提高局部腦組織區(qū)域血氧水平,但CEO2存在一定的下降趨勢,提示DEX可能影響到了腦組織攝取利用氧的能力,考慮可能與DEX對于患者心率和血壓的影響能夠在一定程度上干擾腦組織利用氧的能力有關。
本次研究的創(chuàng)新在于探討了DEX治療TBI后患者體內的皮質醇、β-EP等指標的改變,認為DEX能夠更為顯著地發(fā)揮鎮(zhèn)痛鎮(zhèn)靜效果,抑制TBI患者體內的腎上腺-髓質系統(tǒng)以及體內的炎癥反應,并改善腦組織氧代謝水平。

