毛細管PCR芯片電泳快速檢測NDM-1耐藥菌方法的建立*
王秋平
(南華大學附屬第一醫院檢驗科,湖南衡陽 421001)
濫用抗生素的問題由來已久,2000年出現了多重耐藥假單胞菌和肺炎克雷伯菌。2010年8月The Lancet Infectious Diseases雜志報道了抗生素抗新德里金屬-β-內酰胺酶(NDM-1)超級細菌。NDM-1是一種新鑒定的對β-內酰胺類抗生素具有廣譜水解作用的酶,是編碼碳青霉烯類酶基因家族成員之一。NDM-l可以水解碳青霉烯類抗生素,以及頭孢菌素和青霉素。攜帶該基因的細菌對幾乎所有一線治療重癥感染的廣譜抗生素,如青霉素類、頭孢菌素類、頭霉素類等β-內酰胺和碳青霉烯類抗生素均耐藥,僅對多黏菌素E及米諾環素衍生物——替加環素敏感,被稱為“超級細菌”[1-2]。由于這類細菌的廣譜耐藥特性,有必要進行早期快速鑒定,從而為控制醫院內感染和臨床治療提供及時準確的指導[3]。傳統細菌耐藥基因檢測通常采用細菌分離培養和藥物敏感性試驗[3],這些方法雖然有效,但由于檢測時間較長,難以實現快速檢測,臨床工作中急需快速有效的NDM-1陽性細菌鑒定方法。采用毛細管聚合酶鏈反應(PCR)擴增試劑可以簡化操作并縮短分析時間,滿足快速檢測的需要。本研究采用直接PCR擴增試劑MightyAmp DNA Polymerase,嘗試將直接PCR擴增與微流控芯片電泳技術結合用于NDM-1陽性細菌快速鑒定,擬建立一種快速、高靈敏的檢測方法,實現早期指導臨床用藥和控制醫院內感染,現報道如下。
1 資料與方法
1.1一般資料 (1)標本來源:收集本院2016-2017年對碳青霉烯類抗生素不敏感的80株腸道桿菌(美羅培南MIC≥2 μg/mL)和60株鮑曼不動桿菌(亞胺培南MIC≥64 μg/mL)。所有菌株使用法國梅里埃公司VITEK-2 Compact全自動細菌鑒定藥敏分析儀進行鑒定和藥敏試驗檢測。以大腸埃希菌ATCC 25922及銅綠假單胞菌ATCC 27853作為質量控制菌株。(2)引物設計:根據參考文獻[2]按基因序列(FN396876)設計PCR特異引物序列,上游:5′-GGCGGAATGGCTCATCACGA-3′,下游:5′-CGCAACACA GCCTGACTTTC-3′,擴增片段長度286 bp。PCR引物由上海生物工程公司合成。
1.2試劑與儀器 寶生物工程(大連)有限公司的MightyAmp DNA Polymerase試劑盒,DL2000 DNA Marker,瓊脂糖。江蘇興化宏泰硅氟制品廠的聚四氟乙烯毛細管,美國Bio-Rad公司MyCycler PCR擴增儀、電泳儀,英國UVI公司凝膠成像分析儀和紫外分析儀。美國貝克曼庫爾特公司臺式冷凍離心機,法國梅里埃公司VITEK-2 Compact全自動細菌鑒定藥敏分析儀。研究采用塑型十字架結構聚甲基丙烯酸甲酯(PMMA)電泳芯片[4],芯片的有效分離通道長度設定為4 cm,電泳分析激光誘導在熒光芯片分析儀上完成。該儀器由芯片電泳平臺、光學檢測系統、高壓電源控制和操作軟件組成,檢測方式為共聚焦激光誘導熒光。毛細管PCR裝置參考文獻[4-5]。
1.3方法
1.3.1產NDM-1細菌的實驗室篩查和表型確認 采用K-B紙片擴散法,(1)按照美國臨床和實驗室標準化協會的改良方法進行,制備菌液濃度為0.5麥氏濁度,采用無菌棉簽取已制備好的菌液,在水解酪蛋白(M-H)瓊脂表面均勻涂布接種3次,每次平板旋轉60°,最后沿平板內緣涂抹1周。平板置室溫干燥3~5 min后用無菌鑷子取美羅培南(10 μg)和亞胺培南(10 μg)紙片,檢測美羅培南和亞胺培南的抑菌環直徑。(2)乙二胺四乙酸(EDTA)協同試驗篩選金屬酶表型,0.5麥氏單位的待檢菌涂布M-H平板,貼2張亞胺培南紙片,相距1.0~1.5 cm,其中一張紙片上面滴加0.5 mol/L EDTA 10 μL。35 ℃過夜培養,亞胺培南加EDTA與亞胺培南紙片抑菌圈之差≥5 mm者為金屬酶陽性。
1.3.2產NDM-1細菌基因診斷 采用常規PCR檢測,PCR擴增反應體系分別是MightyAmp DNA Polymerase酶0.5 μL,MightyAmp PCR Buffer12.5 μL,引物F(10 μmol/L)1.0 μL,引物R(10 μmol/L)1.0 μL,ddH2O 8.0 μL,菌液標本2.0 μL,總體積25.0 μL。在臺式PCR儀上反應條件98 ℃,2 min,98 ℃ 10 s,68 ℃ 10 s 40個循環。高效振蕩流毛細管PCR檢測:毛細管PCR反應體系同上,毛細管PCR反應條件:將上述PCR反應液振蕩,充分混勻,毛細管PCR裝置中毛細管順序吸入5 μL礦物油和3 μL PCR反應液。液滴首先運動至98 ℃區停留2 min,繼而在98 ℃和68 ℃區間往返運動40個循環。液滴運動速度為120 μL/min,每個循環在68 ℃區暫停10 s。毛細管PCR產物檢測同上。PCR產物的電泳分析,瓊脂糖電泳分析,配制2%瓊脂糖凝膠板,按試劑標準操作配置2%的瓊脂糖凝膠。取DNA相對分子質量標準液(DL2000)5 μL,直接上樣。電泳儀電壓為100 V,約30 min后停止電泳。置于UV紫外分析儀下觀察并照相,根據擴增產物長度得出判斷結果。微流控芯片電泳分析:用實驗室自制的激光誘導熒光芯片分析儀檢測。將PCR產物用無菌雙蒸水稀釋20倍。先利用真空泵讓電泳緩沖液各10 μL灌滿通道,同時將10 μL稀釋后的樣品加入樣品池中。用1.2%HPMC作為篩分介質,緩沖液為1×PCR Buffer,電泳分離電壓為1.2 kV,分離時間設定為300 s。采用50~800 bp DNA ladder Marker和待測PCR產物按1∶1比例在相同條件下進行芯片電泳,根據500 bp DNA ladder Marker和內標物(50 bp和800 bp DNA片段)的相對遷移時間確定待測樣品中特異PCR擴增產物的DNA片段。微流控芯片利用DNA電泳分析,通過比較待測樣品與標準樣品的遷移時間確定DNA片段大小。
1.3.3微流控芯片法檢測NDM-1耐藥菌敏感度 細菌培養和計數-平板涂布計數法:將耐藥菌接種于新鮮血平板上,培養18~24 h。將培養好的單個菌落從血平板上刮下來,溶于2 mL 0.45%的無菌鹽水中,充分振蕩混勻;分別在24個EP管內加入900 μL無菌生理鹽水,排成3排,按順序編號。從前面配好的菌液中取出100 μL加到第1個EP管內,則第1個EP管內細菌濃度為標本的1/10;同法,從第1個EP管中取出100 μL加到第2個EP管內,則第2個EP管內細菌濃度為標本的1/100。依此類推,第8個EP管細菌濃度為原標本的1/108。制備好營養培養基,高壓消毒滅菌。將培養基溶解,待冷卻50 ℃左右,倒入平板。取稀釋好的菌液1 mL鋪皿。35 ℃培養24~28 h后,看平皿上菌落數。選取細菌數量在30~300的菌液濃度進行計數。原菌液標本每毫升的細菌濃度=某一濃度3個平板的菌落總數/3×10(該濃度菌液的稀釋倍數)(CFU/mL)。敏感度考察:將已經涂布平板中的原菌液標本按107、106、105、104、103、102、101、100梯度稀釋,分別作為PCR模板,PCR反應體系和循環條件同前。考察免核酸提取PCR的敏感度。
1.3.4測序驗證 將免核酸提取PCR產物送大連寶生物進行測序,用chromas145軟件進行分析,并在Pub Med上與FN396876.1序列進行比對。
1.4方法學評價及臨床標本檢測 對毛細管液滴PCR反應體系和反應條件進行優化,分析評價該方法的特異度和敏感度;本研究采用碳青霉烯類酶陽性K-B紙片法和毛細管PCR結合微流控芯片電泳對本院檢驗科微生物實驗室2016-2017年收集的80株耐藥腸道桿菌(美羅培南MIC≥2 μg/mL)和60株鮑曼不動桿菌(亞胺培南MIC≥64 μg/mL)耐藥菌進行篩查,并對耐藥菌標本進行NDM-1基因檢測。
2 結 果
2.1不同酶濃度對毛細管液滴PCR效果的影響 本試驗比較4種酶用量,加入MightyAmp DNA Polymerase酶分別是0.1、0.3、0.5、0.7 μL,結果發現,酶的濃度與毛細管液滴PCR效果隨酶濃度的增加而升高,當酶加入量為0.5 μL時趨向于飽和,因此,本試驗酶加入量以0.5 μL為最優,見圖1。

圖1 試驗酶加入量對PCR的影響
2.2不同標本量對毛細管液滴PCR效果的影響 為了考察MightyAmp DNA Polymerase酶的最合適檢測標本體積,將不同菌液體積(1、2、3、5、7 μL)進行毛細管PCR。結果發現,標本加入量到5 μL時,PCR效率有所下降;當標本加入量為7 μL時,PCR受到明顯抑制,并且有纖維凝固團產生,見圖2。因此,最合適檢測標本的體積為2 μL。
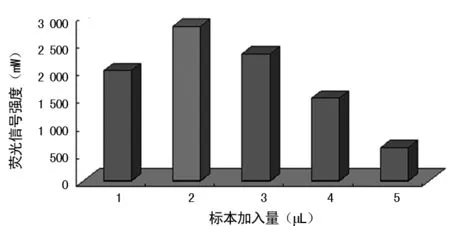
圖2 標本量對毛細管液滴PCR的影響
2.3不同退火溫度和延伸時間對毛細管液滴PCR效果的影響 為了考察在毛細管液滴PCR上退火溫度和延伸時間對PCR效果的影響,將同一陽性標本采用同樣的PCR反應體系,退火溫度分別為62、65、68、71、74 ℃,比較芯片電泳熒光信號強弱。發現芯片電泳熒光信號退火溫度為68 ℃較強,但不是最理想。每個循環中在68 ℃區暫停10 s,將退火和延伸加長,從而延長反應時間,芯片電泳熒光信號達最大值,PCR擴增效果相當成功,見圖3、4。

圖3 退火溫度對毛細管PCR的影響
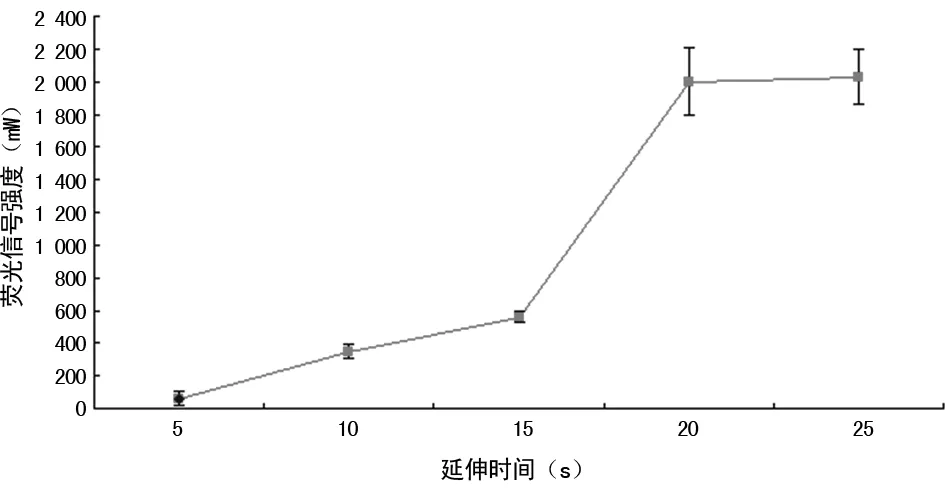
圖4 延伸時間對毛細管PCR的影響
2.4臨床耐藥菌篩選、表型確認及毛細管PCR微流控芯片電泳結果 EDTA協同試驗篩選金屬酶結果顯示,陽性6株,毛細管PCR微流控芯片電泳檢測NDM-1陽性2株,同時進行普通PCR檢測結果也是2株NDM-1陽性。攜帶NDM-1耐藥菌在血平板上的培養情況見圖5A;藥敏紙片美羅培南和亞胺培南抑菌圈直徑為6 mm≤22 mm,該耐藥菌碳青霉烯類酶陽性,見圖5B;K-B紙片結果為:EDTA復合紙片抑菌環直徑25 mm,比單藥紙片直徑6 mm增大≥5 mm,因此該耐藥菌金屬酶陽性,見圖5C。NDM-1陽性菌毛細管液滴PCR微流控芯片檢測結果見圖6;對應的瓊脂糖電泳結果見圖7。

圖5 NDM-1陽性血平板培養和K-B紙片藥敏試驗結果
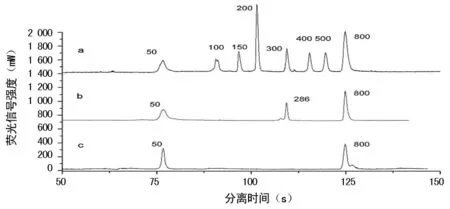
注:a為DNA marker;b為有NDM-1基因擴增產物;c為無NDM-1基因擴增產物
圖6 NDM-1基因檢測芯片電泳結果

注:M為DL2000 Marker;1為無NDM-1基因擴增產物;2、3為有NDM-1基因耐藥菌擴增產物
圖7 NDM-1基因檢測瓊脂糖電泳結果
2.5芯片毛細管液滴PCR特異性考察 經過試驗優化,按最優PCR反應體系和反應條件,對該陽性PCR產物進行測序。芯片檢測結果與測序結果在Pub Med上與FN396876.1序列進行比對,100%符合。
2.6芯片毛細管液滴PCR檢出限考察 將已經涂布平板中的原菌液標本按107、106、105、104、103、102、101、100梯度稀釋,分別作為PCR模板,PCR反應體系和循環條件同前。PCR產物在芯片電泳和2%瓊脂糖電泳上檢測。芯片電泳可以檢測到最低菌液濃度為1.15×101CFU/mL,相比瓊脂糖電泳最低菌液濃度1.5×103CFU/mL更靈敏。
2.7臨床標本檢測 本試驗采用碳青霉烯類酶陽性K-B紙片法和毛細管PCR結合微流控芯片電泳對本院檢驗科微生物實驗室2016-2017年收集的80株耐藥腸道桿菌(美羅培南MIC≥2 μg/mL)和60株鮑曼不動桿菌(亞胺培南MIC≥64 μg/mL)耐藥菌進行篩查,結果顯示,K-B紙片法檢出碳青霉烯類酶陽性6株,其中金屬酶陽性2株;采用毛細管PCR結合微流控芯片電泳方法篩選出2株NDM-1基因陽性,并經DNA測序驗證,確證攜帶NDM-1基因。
3 討 論
“超級細菌”最早發現于2008年,源自一名印度籍的瑞典患者體內的一種細菌。由于多種抗生素對該細菌均無效,于是一種具有特殊性的基因被檢測出來,這個基因就是NDM-編碼基因[6]。碳青霉烯酶抗生素是革蘭陰性菌醫院內感染最后一線治療藥物,碳青霉烯酶耐藥的產生將嚴重威脅到全球衛生治療系統[7]。最近發現的NDM-1引起人類的廣泛關注,也被大眾媒體報道。盡管報道病例數非常少,影響還不是很大,但診斷實驗室需要發展一種快速檢測的方法,以備將來醫院內感染暴發流行時應用。
目前,產NDM-1細菌的實驗室常規診斷包括Etest法表型篩查試驗、改良霍奇試驗表型確證試驗及自動化鑒定與藥敏試驗等,但是都無法區分耐藥類型和耐藥基因,且需要時間長,特異度低[8]。分子診斷檢測方法彌補了常規方法的不足,可在1 h內完成檢測,具有高敏感度和特異度。通常PCR前需要消耗大量時間進行標本DNA提取和前處理。用瓊脂糖凝膠電泳分析PCR產物需要進行瓊脂糖凝膠的制備,而且電泳時間需要30 min以上,整個PCR操作過程不僅費時費力,而且還需要昂貴的儀器。
本研究采用的毛細管振蕩流PCR裝置,使用量注射泵驅動PCR液滴在不同恒定溫區往返運動,因無需加熱模塊的升溫和降溫過程,所以大大縮短了PCR時間。并且,該系統使用標準毛細管作為PCR反應器,價格便宜,且毛細管PCR只需3 μL PCR反應液,節約試劑,大大降低了檢測成本。本研究采用改良型Mighty Amp DNA聚合酶,直接從臨床標本中擴增目的片段,無需核酸提取預處理,將標本直接進行PCR,有望實現集成化核酸分析。此外,本研究用微流控芯片電泳分析PCR產物,分離檢測時間為300 s,相比常規瓊脂糖電泳檢測大大縮短了時間,而且本方法檢測敏感度高,細菌檢測敏感度為1.15×101CFU/mL。本研究中K-B紙片法檢出碳青霉烯類酶陽性為6株,其中金屬酶陽性2株;毛細管PCR結合微流控芯片電泳篩選出2株NDM-1基因陽性,同時進行普通PCR檢測結果也是2株NDM-1陽性,經DNA測序驗證,這2株確證攜帶NDM-1基因。另外4株可能含有碳青霉烯類酶的其他耐藥基因型,還需進一步深入研究。本方法檢測結果經過測序驗證,完全符合,由此說明本方法對NDM-1基因檢測準確性高、特異性強。
總之,該方法在40 min內實現產NDM-1耐藥菌擴增產物的快速分離檢測,細菌檢測敏感度為1.15×101CFU/mL,對NDM-1基因檢測準確性高、特異性強,具有快速、廉價等特點,適合超級細菌NDM-1的早期快速現場診斷。

