微小核糖核酸與抗血小板藥物反應異質性的相關研究進展
劉軍,尹彤*
(1解放軍總醫院心血管內科,2國家老年疾病臨床醫學研究中心, 北京 100853)
血小板在血栓形成和延續的過程中發揮重要作用[1],血小板異常激活會導致一系列血栓風險事件發生,如腦卒中、心肌梗死等,而血小板功能異常還會導致嚴重出血。因此,抗血小板藥物在心腦血管血栓性疾病的防治過程中發揮核心作用。目前,臨床應用的抗血小板藥物主要包括阿司匹林和P2Y12受體拮抗劑(如氯吡格雷、替格瑞洛)等。抗血小板藥物是一把雙刃劍,抗血栓不足會導致嚴重心腦血管缺血性事件發生, 抗血栓過度又會導致嚴重出血事件。研究發現,抗血栓不足和過度所導致的嚴重缺血和出血事件均會導致患者預后不良,并增加死亡事件的發生風險[2,3]。新型抗血小板藥物(如P2Y12受體拮抗劑替格瑞洛)能夠提供更快、更強有效的抗栓效果,但由于抗血小板反應性的個體差異,仍有近10%的高危患者因高血小板反應性發生嚴重的心血管事件[3,4]。因此,如何預測抗血小板藥物的抗栓療效,實現個性化抗血小板藥物治療,一直是心腦血管領域研究的熱點和亟待解決的難題。
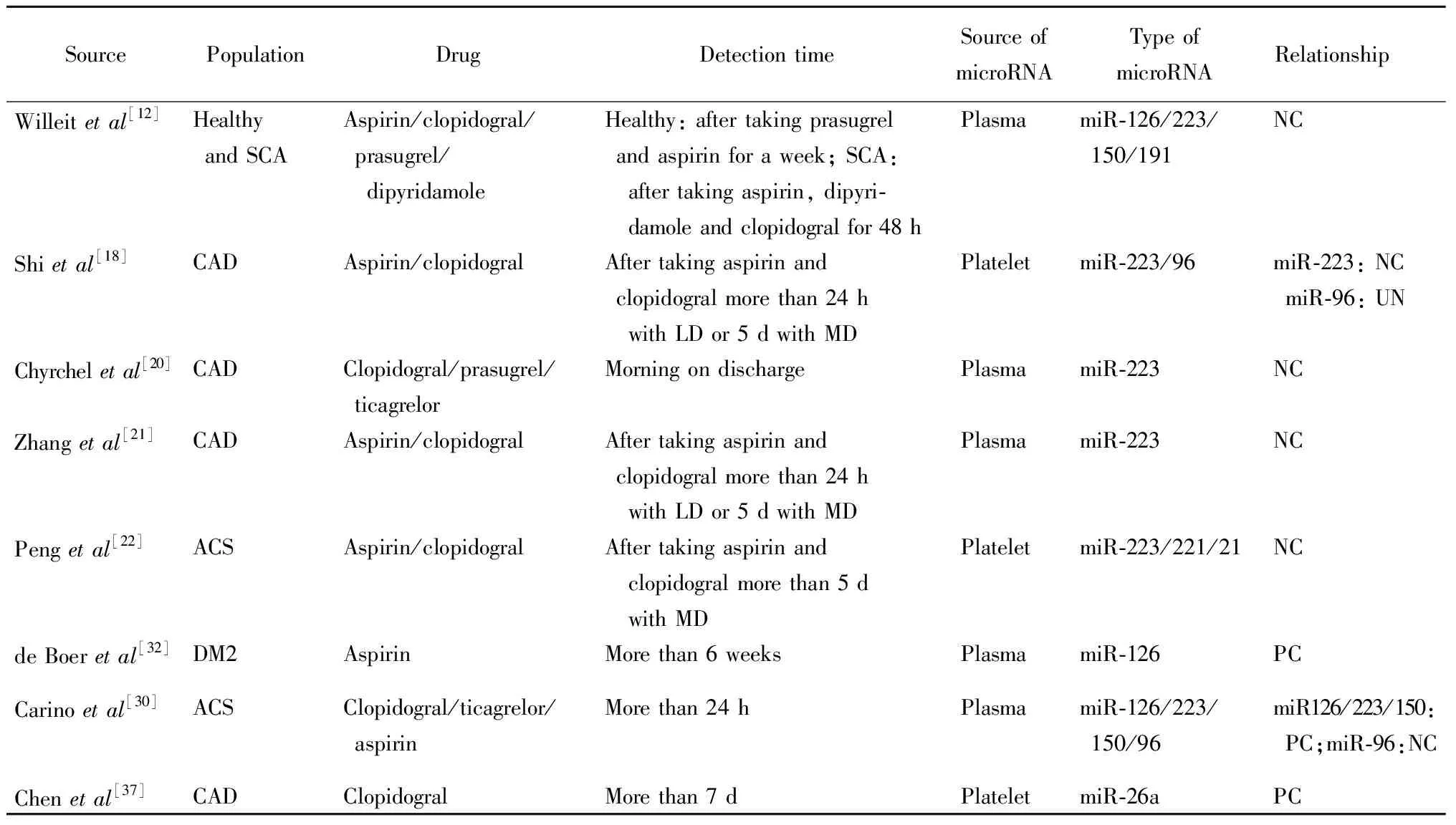
表1 血小板miRNA與抗血小板藥物反應性相關研究
ACS: acute coronary syndrome; CHD: coronary heart disease; SCA: symptomatic atherosclerosis; CAD: coronary artery disease; DM2: type 2 diabetes mellitus; LD: loading dose; MD: maintaining dose; NC: negative correlation; UN: uncorrelated; PC: positive correlation
目前,臨床應用的預測抗血小板反應性的方法主要包括血小板功能檢測(如光密度比濁法、血栓彈力圖等)和藥物基因組學檢測,但這些方法均有局限性,尚無法充分預測抗血小板藥物反應性的差異。血小板是由巨核細胞胞質片段脫落而形成,盡管沒有細胞核,但血小板中存在大量微粒,其中包括核糖核酸(ribonucleic acid,RNA)等物質[5,6],尤其是存在豐富的微小RNA(micro ribonucleic acid,microRNA)[7]。microRNA是非編碼RNA家族中的一員,通過影響信使RNA(messenger ribonucleic acid,mRNA)的穩定性,負性調控mRNA轉錄,對信號通路和細胞間作用發揮調節功能。近年來多項研究顯示,血小板microRNA與抗血小板藥物反應性密切相關,其中包括能夠調控P2Y12受體編碼基因(P2RY12)表達的miR-223和miR-126,這為尋找能夠預測抗血小板藥物反應性個體差異的生物標志物提供了新的線索。鑒于此,本文將針對血小板microRNA與抗血小板藥物反應性的相關性進行如下綜述。
1 microRNA在血小板中的表達情況
microRNA在血小板中表達極為豐富,目前通過各類研究方法(包括芯片篩查、逆轉錄聚合酶鏈式反應等)發現人類血小板中約有250~375種microRNA[7,8]。而早在2011年,Nagalla等[8]對19名健康志愿者的外周血進行血小板提純后,通過芯片分析發現,血小板中總共存在284種microRNA,其中以miR-223的含量最為豐富,其次為miR-126,miR-21,let-7f等,這與隨后的幾個研究結果一致[10]。這些microRNA在血小板中發揮著多種功能,包括血小板mRNA翻譯和表達的調控、血小板反應性的生物標志物、成熟的巨核細胞microRNA水平的標志物等[9,11-13]。
2 血小板microRNA與抗血小板藥物反應性的相關研究
自從2009年Landry等[7]首先報道了血小板中miR-223與血小板P2Y12受體通路相關后,一系列關于血小板microRNA與抗血小板藥物反應性之間的關聯性和潛在機制的研究開始問世(表1)。其中,miR-223和miR-126與P2Y12受體拮抗劑抗血小板反應性的相關性備受關注。
2.1 miR-223與抗血小板藥物反應異質性的相關性及作用機制
miR-223是一類小的非編碼RNA,其編碼基因位于X染色體的Q12基因位點[14,15]。最初研究發現其在造血系統中發揮著重要作用[16],能夠促進粒細胞分化和抑制紅系細胞分化[15,17]。隨后研究發現,在血小板和巨核細胞中其表達同樣十分豐富,因此在血栓形成過程中可能具有重要的調控作用,其能靶向調控位于X染色體上的7個mRNA的表達,包括與編碼腺苷二磷酸(adenosine diphosphate,ADP)受體P2Y12的mRNA 結合,抑制P2Y12受體表達[18,19]。
由于血小板中的miR-223-P2Y12 mRNA通路在血小板功能調控方面具有重要的作用[7],因此P2Y12受體及miR-223也成為臨床研究的重要分子,特別是miR-223與血小板對P2Y12受體拮抗劑氯吡格雷反應性的相關研究較多。Willeit等[12]首次發現抗血小板治療能夠降低血小板源性microRNA的表達,他們通過對9名男性健康志愿者進行普拉格雷聯合阿司匹林抗血小板藥物干預,采用TaqMan定制探針,測定血漿中92種microRNA含量,結果發現,其中包括miR-223在內的8種microRNA發生顯著變化。隨后,作者選取了33例頸動脈粥樣硬化患者,其中隨機選取8例服用阿司匹林聯合雙嘧達莫,4例服用阿司匹林+氯吡格雷,其余單用阿司匹林。結果發現,隨著抗血小板治療的加強,血漿中血小板miR-223表達降低。國內Shi等[18]對冠心病患者血小板中microRNA與氯吡格雷抗血小板反應性的關系進行研究,他們選取了33例需行經皮冠狀動脈介入術(percutaneous coronary intervention,PCI)治療的冠心病患者,給予300 mg負荷劑量的氯吡格雷后,通過血小板反應指數和血小板聚集區別高血小板反應性和低血小板反應性。在提取血小板microRNA后,通過聚合酶鏈式反應(polymerase chain reaction,PCR)觀察2組microRNA的表達差異,結果發現,低表達miR-223與氯吡格雷抗血小板反應性減低相關。隨后的幾項研究也同樣證實,血小板miR-223的表達水平與抗血小板藥物反應性相關。波蘭亞捷隆大學開展的一項包括21例非ST段抬高急性冠脈綜合征(acute coronary syndrome,ACS)患者血漿中miR-223表達情況的研究[20],以及后續一項包括62例不穩定心絞痛患者的研究進一步證實,miR-223具有獨立預測氯吡格雷低反應性的能力,并且隨著血小板抑制率增高其表達增加[21]。我們課題組前期研究還發現,在氯吡格雷低反應性ACS患者的血小板中,miR-223比高反應性組表達降低,但是上述相關性僅見于攜帶CYP2C19*2的患者中,提示miR-223對氯吡格雷抗血小板反應性的影響受氯吡格雷代謝相關基因CYP2C19的影響[22]。
前期研究證實,血小板P2Y12受體是miR-223的靶點之一,能夠調節血小板功能(包括血小板聚集和顆粒分泌),且能被ADP激活,是一類G蛋白偶聯受體。miR-223能夠穩定地與人類P2Y12受體mRNA的3′非翻譯區(untranslated region,UTR)端結合,并且血小板P2Y12受體mRNA能夠與Ago2形成免疫共沉淀,miR-223還可調控P2Y12受體水平,進而影響血小板功能[7]。miR-223降低可能會促進P2Y12表達,增加血小板對ADP的敏感性。因此,血小板中miR-223的降低可用于預測P2Y12受體拮抗劑抗血小板的反應性[18]。如果在新生血小板中上調miR-223表達,將會減少ADP受體表達,從而維持血小板的穩定狀態。而另一項動物實驗顯示,miR-223對血小板產生及其功能的影響并不明顯[23]。Leierseder等[23]對miR-223基因敲除小鼠與野生型小鼠進行對比發現,二者血小板的數量、形態、壽命及血小板表面活性物質均無明顯差異。血小板聚合度實驗顯示,敲除miR-223基因并沒有對小鼠血凝塊回縮速度、血小板聚集等產生影響。原因可能在于miR-223基因敲除小鼠的P2Y12受體編碼基因P2RY12 mRNA的3′UTR端并沒有miR-223的結合位點。前期研究顯示,miR-223正是通過結合基因P2RY12 mRNA的3′UTR端,調控P2Y12受體表達,從而影響血小板活性。
miR-223還可能是通過其直接作用于凝血因子相關蛋白,進而導致血小板聚集和血栓風險增加,削弱抗血小板藥物的反應性。在條件性敲除miR-223基因的小鼠中,凝血酶誘導的血小板聚集增加,大塊穩定血栓形成,血塊回縮時間延遲,血小板擴散增加,同時血小板之間或者血小板與白細胞之間會自發性聚集。蛋白組學分析顯示,上述功能性改變與一系列蛋白表達增加相關,包括β1整合蛋白、kindlin-3以及凝血因子XⅢ-A。凝血因子XⅢ-A是miR-223的直接靶向結合物,參與維持纖維蛋白凝血塊的穩定性,延遲血塊回縮時間。在miR-223敲除小鼠中,血塊回縮減弱,但用腐胺抑制凝血因子XⅢ-A后,血塊回縮正常(圖1)[24]。
總之,血小板miR-223能夠通過靶向結合人類P2Y12受體mRNA的3′UTR端,或者與凝血相關蛋白結合而影響血小板的活性,其中,與P2Y12受體結合在血小板活化過程中發揮著重要作用,是多種抗血小板藥物的作用靶點。因此,降低血小板miR-223的表達可能會引起P2Y12受體活性增加,進而引起血小板活性增加。推測降低血小板miR-223的表達可能會增加血栓疾病風險,如心肌梗死等。多項觀察性研究也證實降低血小板miR-223的表達與P2Y12受體拮抗劑作用減弱相關。
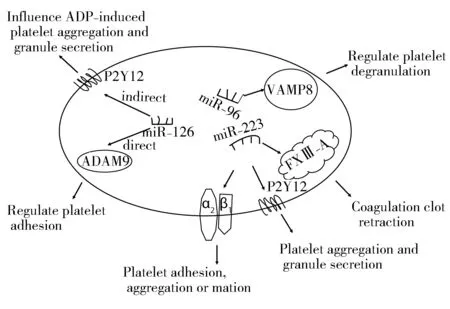
圖1 血小板microRNA影響血小板反應性信號通路機制
2.2 miR-126與抗血小板藥物反應異質性的相關性及作用機制
2002年,Lagos等[25]通過測序首次在小鼠的心臟中發現了miR-126。從動物到人類,miR-126序列非常保守,在脊椎動物中,miR-126來源于編碼內皮細胞特異分泌肽的Egfl7基因的第7個內含子[26,27],可以調控新生血管內皮芽細胞的移動和定位[28]。miR-126具有內皮細胞特異性,在內皮細胞中表達異常豐富,對維持細胞完整性具有重要作用。但循環中的miR-126并不完全來源于內皮細胞。巨核細胞同樣表達miR-126,而循環中的miR-126則更多來源于血小板[12,29]。
Willeit等[12]首次發現抗血小板治療能夠降低血小板源性microRNA的表達,其中包括miR-126。無論在健康人還是頸動脈粥樣硬化患者中,隨著抗血小板治療的加強,血漿中血小板miR-126表達降低。Carino等[30]研究發現,將抗血小板治療藥物從氯吡格雷換成強效抗血小板藥物替格瑞洛后,血漿中的miR-126表達水平下降。
一系列研究顯示,血漿中血小板miR-126能夠作為生物標志物預測PCI術后患者心血管不良事件的發生[31]。但是,由于抗血小板治療能夠降低血漿中miR-126的表達,因此在以血漿miR-126作為冠心病生物標志物時,應考慮血小板抑制劑如阿司匹林對其表達的影響[32]。
前期研究發現,在小鼠中抑制miR-126的表達能夠降低花生四烯酸誘導的血小板聚集[12]。骨髓巨核細胞中含有豐富的miR-126,miR-126的過表達能夠降低靶基因去整合素樣金屬蛋白酶9(A disintegrin and metalloproteinase domain 9,ADAM9)的表達,而ADAM9能夠降低膠原誘導的血小板聚集[33]。上述研究證實,miR-126可能通過直接作用于ADAM9,導致血小板聚集功能改變,進而導致抗血小板藥物反應異質性的發生。還有研究發現,在miR-126-3p敲除小鼠的全血中,P2Y12受體表達顯著降低,由于P2Y12受體在血小板中的表達遠遠超過其在白細胞[34]和紅細胞[35]中的表達,因此,miR-126還可能通過間接作用于P2Y12受體的表達,導致抗血小板藥物反應的異質性(圖1)。
總之,抗血小板治療能夠影響血漿中miR-126的表達水平,隨著抗血小板強度的增加,miR-126的表達水平降低。同時,血漿miR-126還可作為心肌梗死及其他心血管不良事件的生物標志物,但是需要考慮抗血小板藥物的影響。動物實驗初步證實,miR-126對抗血小板藥物反應異質性的影響機制可能與其對血小板靶基因ADAM9的直接作用和對P2Y12受體的間接作用有關,但是確切機制仍需進一步探索。
2.3 其他microRNA與抗血小板藥物反應性的相關研究
除了miR-223和miR-126以外,血小板來源的其他microRNA也被證實能夠與血小板活性相關基因相互作用,進而影響抗血小板藥物的反應性。Kondkar等[36]研究證實,過表達miR-96能夠通過靶向結合囊泡相關膜蛋白8(vesicle-associated membrane protein 8,VAMP8)-mRNA,抑制血小板活性,但在氯吡格雷治療的冠心病患者中,并沒有發現miR-96與抗血小板反應性相關[18]。Chen等[37]發現,血小板中過表達miR-26a與PCI術后患者氯吡格雷抵抗引起的高血小板反應性相關。Wang等[38]發現,miR-31能夠通過抑制血小板活化過程中的重要分子信號血栓素A2(thromboxane A2,TBXA2)受體起到抗血小板作用。本課題組前期研究發現,在服用氯吡格雷抗血小板治療的ACS患者中,高血小板反應性組血小板miR-221和miR-21的表達均顯著低于低血小板反應性組,表明血小板microRNA的表達與ACS患者氯吡格雷抗血小板療效相關[22]。Willeit等[12]研究發現,抗血小板藥物能夠影響miR-150和miR-191的表達。
3 展望
在生物學和病理生理學領域,人們對血小板microRNA重要性的認識正在逐漸增加,這為血小板microRNA的臨床轉化應用提供了重要的科學依據。越來越多的研究證實,microRNA的表達量能夠反映循環中血小板的反應性。目前對血小板活性的評估主要基于血小板的體外活性檢測,因此難以反應體內抗血小板藥物的療效。血小板microRNA表達水平的變化能夠反應體內抗血小板藥物的反應性,未來有必要深入探討血小板microRNA指導下的個體化抗栓治療是否能夠改善臨床預后。目前,microRNA仍需人工提取,因此有必要發展快速提取和監測microRNA的手段,加速microRNA的臨床轉化應用。除此之外,由于樣本分離及樣本組成會對microRNA的表達產生影響,因此,有必要對血小板microRNA的檢測流程進行標準化。隨著生物醫療技術的不斷進步,相信將來有望通過對血小板microRNA的實時監測,實現對抗血小板藥物的個體化選擇和應用。

