中老年男性2型糖尿病合并骨質疏松患者骨轉換標志物的變化
朱慧靜,楊明明,朱昕,王惠麗,程霖,成興波,裴育
(1蘇州大學附屬第一醫院內分泌科,蘇州 215006;2菏澤市立醫院內分泌科,菏澤 274000;3解放軍總醫院內分泌科,北京 100853)
隨著人口老齡化,2型糖尿病(type 2 diabetes mellitus,T2DM)和骨質疏松癥(osteoporosis,OP)的患病率均迅猛增加,成為危害國人健康的重大公共衛生問題。糖尿病性骨質疏松癥(diabetic osteoporosis,DOP)是糖尿病在骨骼系統的重要并發癥之一,其發病率為20%~60%,且骨折風險明顯高于普通人群[1]。女性DOP已經受到廣泛關注,而男性患者隨著年齡增長,同樣存在骨代謝異常或骨質疏松等合并癥。雖然雙能X線骨密度儀(dual-energy X-ray absorptiometry,DXA)測定骨密度(bone mineral density,BMD)是目前國際上診斷OP的金標準[2],但BMD檢查存在滯后性,其有意義的變化至少需要半年以上才能由DXA檢測出來[3];且其僅能反映骨量的變化,不能完全代表骨強度。骨轉換標志物(bone turnover markers,BTMs)是骨組織本身的代謝(分解與合成)產物,能夠早期反映骨代謝的狀況,在骨折風險的預測中有一定價值。本文通過比較中老年男性DOP和OP患者BTMs的差異,旨在探討男性T2DM患者骨代謝的特點,分析DOP的危險因素。
1 對象與方法
1.1 研究對象
2016年3月至2017年10月在蘇州大學附屬第一醫院內分泌科住院的中老年男性T2DM患者中,選取符合OP診斷標準的40例作為實驗組(糖尿病性骨質疏松組,DOP組);同期在體檢中心接受健康查體的中老年男性中,選取符合OP診斷標準的40例作為對照組(骨質疏松組,OP組)。糖尿病診斷采用1999年世界衛生組織(World Health Organization,WHO)糖尿病診斷標準,骨質疏松診斷采用1998年WHO骨質疏松診斷標準。排除標準:(1)有嚴重心腦血管、肝、腎、肺部疾病、血液系統疾病、惡性腫瘤等;(2)有營養不良、甲狀腺、甲狀旁腺疾病、皮質醇增多癥等;(3)曾服用過或正在服用抗骨質疏松藥物、糖皮質激素、免疫抑制劑等影響骨代謝的藥物;(4)過度飲酒或吸煙;(5)近6個月內有骨折史或持續臥床達3個月以上。本研究方案經醫學倫理委員會批準,所有研究對象均簽署知情同意書。
1.2 方法
詳細記錄患者的年齡、糖尿病病程,測量身高、體質量,計算體質量指數(body mass index,BMI)。采用美國GE-LUNAR公司的DXA檢測腰椎(L1-4)、股骨頸和全髖部的骨密度,單位以g/cm2表示。靜脈抽血,日立7600全自動生化分析儀測空腹血糖(fasting plasma glucose,FPG)、堿性磷酸酶(alkaline phosphatase,ALP)、鈣(calcium,Ca)、磷(phosphor,P)、血肌酐(serum creatinine,SCr), 高壓液相色譜法檢測糖化血紅蛋白(glycosylated hemoglobin A1c,HbA1c)。另留一份血樣,分離血清,-70℃保存,采用羅氏電化學發光法測定血清骨鈣素(osteocalcin, OC)、1型前膠原N端前肽(N-terminal propeptide of type 1 precollagen,P1NP)、Ⅰ型膠原交聯竣基端肽區(type Ⅰ collagen cross linked C-telopeptide,CTX)、甲狀旁腺激素(parathyroid hormone,PTH)、25-羥維生素D(25-OH vitamin D,25OHD)。
1.3 統計學處理
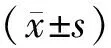
2 結 果
2.1 2組間臨床及生化指標比較
2組間年齡、BMI、SCr、Ca、P、ALP比較,差異無統計學意義(P>0.05)。DOP組FPG、HbA1c顯著高于OP組(P<0.01;表1)。
2.2 2組間骨密度比較
2組間L1-4、股骨頸和全髖部骨密度比較, 差異均無統計學意義(P>0.05;表2)。
2.3 2組間BTMs和骨代謝調控激素比較
2組間PTH比較,差異無統計學意義(P>0.05)。DOP組OC、P1NP、25OHD均低于OP組(P值分別為0.045、0.037、0.017);CTX高于OP組(P=0.013;表3)。
2.4 DOP組BTMs與各指標之間的相關性分析
分別以OC、P1NP、CTX為因變量,以病程、上述臨床及生化指標、L1-4、股骨頸和全髖部骨密度為自變量;Pearson相關分析結果顯示,OC、P1NP均與病程、HbA1c呈負相關;CTX與病程、HbA1c呈正相關,與全髖部骨密度呈負相關(表4)。多元逐步回歸分析結果顯示,HbA1c是OC、P1NP的獨立相關因素;CTX除受HbA1c的影響外,還受全髖部骨密度的影響(表5)。
表12組間臨床及生化指標比較
Table 1 Comparison of the clinical and biochemical data


ItemOP groupDOP groupAge(years)63.50±8.9161.25±7.03Course(years)-7.66±4.04BMI(kg/m2)26.79±3.9727.24±3.07FPG(mmol/L)4.86±0.669.85±3.19??HbA1c(%)5.06±0.499.28±2.02??SCr(μmol/L)72.93±16.0274.19±18.69Ca(mmol/L)2.22±0.122.21±0.11P(mmol/L)1.19±0.201.20±0.15ALP(U/L)65.31±21.8063.36±15.68
OP: osteoporosis; DOP: diabetic osteoporosis; BMI: body mass index; FPG: fasting plasma glucose; HbA1c: glycosylated hemoglobin A1c; SCr: serum creatinine; ALP: alkaline phosphatase. Compared with OP group,**P<0.01
表2兩組間骨密度比較
Table 2 Comparison of bone mineral density between

GroupL1-4Femoral neckTotal hipOP0.960±0.2810.895±0.1620.784±0.143DOP0.970±0.1260.895±0.1190.748±0.112
OP: osteoporosis; DOP: diabetic osteoporosis
3 討 論
DOP的概念最早于1948年由Albright和Reifenstein首次提出[4],是糖尿病在骨骼系統出現的嚴重并發癥。DOP是指在糖尿病病理生理過程中出現的骨量減少及骨骼微結構破壞、脆性增加。盡管BMD是反映骨質改變的金標準,但其敏感性較低,不能早期反應骨代謝的異常變化,并且目前很多證據都表明T2DM患者的骨折風險并不由BMD決定,這可能會使骨密度儀在評估T2DM患者的骨強度中成為一種次要的工具[5]。BTMs能反映短期內骨轉換、骨重建的水平,臨床上通過檢測血清中BTMs的水平可間接推斷全身骨骼的各種代謝狀態,為早期診斷OP、預測骨折風險、選擇抗骨質疏松藥物及評估療效提供依據。
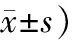
表3 2組間骨轉換標志物和骨代謝調控激素比較
BTMs: bone turnover markers; OP: osteoporosis; DOP: diabetic osteoporosis; OC: osteocalcin; P1NP: N-terminal propeptide of type 1 precollagen; CTX: type I collagen cross linked C-telopeptide; PTH: parathyroid hormone; 25OHD: 25-OH vitamin D. Compared with OP group,*P<0. 05

表4 BTMs與各指標間的Pearson相關分析
BTMs: bone turnover markers; HbA1c: glycosylated hemoglobin A1c; OC: osteocalcin; P1NP: N-terminal propeptide of type 1 precollagen; CTX: type I collagen cross linked C-telopeptide

表5 BTMs相關因素的多元逐步回歸分析
BTMs: bone turnover markers; HbA1c: glycosylated hemoglobin A1c; BMD: bone mineral density; OC: osteocalcin; P1NP: N-terminal propeptide of type 1 precollagen; CTX: type I collagen cross linked C-telopeptide
OC和P1NP是目前常用的骨形成標志物, CTX是目前常用的骨吸收標志物。OC是一種由成骨細胞分泌的非膠原蛋白,但破骨細胞骨吸收時OC也會增高,因此OC不僅能反映骨形成狀態,更代表了骨轉化水平的綜合狀態[3]。研究發現,血清OC水平與機體血糖和脂肪含量呈負相關,與胰島素敏感性以及分泌呈正相關,可能是2型糖尿病的獨立保護因素[6]。P1NP 和CTX 均與1型膠原的代謝有關[7],P1NP是成骨細胞合成分泌1型膠原的過程中被蛋白酶裂解的代謝產物,受晝夜節律及飲食的影響小,并且不受激素的影響,是反映骨形成較特異及靈敏的指標。CTX是1型膠原在破骨細胞降解過程中產生的特異性產物,能直觀地反映骨吸收情況。目前有關P1NP 和 CTX與糖代謝關系的研究尚未形成統一觀點。有研究發現,與健康人群相比,T2DM 患者P1NP 水平明顯下降,與FPG和HbA1c呈負相關;CTX水平明顯升高,與FPG和HbA1c呈正相關[8]。但一項大樣本人群研究顯示,P1NP和CTX每增加一個標準差,糖尿病的風險分別降低36%和40%[9]。
本研究發現,與OP組相比,DOP組OC和P1NP水平降低,CTX水平升高,差異均有統計學意義。提示與原發性骨質疏松比較,2型糖尿病合并骨質疏松患者的骨形成進一步減少,骨吸收增加更顯著。具體機制可能為:2型糖尿病患者長期血糖控制不佳,會導致晚期糖基化終末產物(advanced glycation end products,AGEs)在循環及骨組織中堆積,AGEs 可通過與細胞表面受體作用而導致骨形成減少,骨吸收增加[10,11]。本研究中相關分析顯示OC、P1NP均與HbA1c成正相關,CTX與HbA1c呈負相關,回歸分析顯示,OC、P1NP、CTX均受HbA1c的影響,HbA1c水平越高,OC、P1NP水平越低,CTX水平越高,提示T2DM患者血糖控制越差,骨形成能力越弱,骨吸收越嚴重,發生骨質疏松甚至骨折的風險越高。另外,2型糖尿病患者長期高血糖導致滲透性利尿,促使鈣磷大量排出體外,血鈣濃度降低,刺激PTH分泌增加,引起繼發性甲狀旁腺功能亢進,從而將骨鈣動員至血液中,骨吸收作用增強。
Kwon等[12]研究指出非胰島素依賴型糖尿病患者病程每增加15年, BMD將減少10%。史蕾等[13]研究發現,在老年女性T2DM患者中,隨著病程的進展,成骨細胞活性下降,破骨細胞活性增強,且與病程呈現獨立相關性,T2DM本身對 OP 存在影響。本研究結果也觀察到,中老年男性DOP組OC、P1NP與病程呈負相關,CTX與病程呈正相關,提示隨著糖尿病病程的延長,骨質流失的量及速度逐漸增加,骨質疏松甚至骨折的風險也隨之加大。分析其原因可能為:T2DM患者隨著病程的延長,胰島功能逐漸衰退,胰島素分泌減少。(1)胰島素分泌缺乏可引起成骨細胞的分化和增殖減弱,數目減少、活性降低,合成OC減少[14]。(2)胰島素相對不足,可引起腺苷酸環化酶活性增高,骨吸收增加[15]。(3)體內胰島素水平下降,可引起1,25(OH)2D3減少,導致腸道對鈣磷的吸收減少,從而引起繼發性甲狀旁腺機能亢進,破骨細胞活性增加[16]。
維生素D對骨代謝具有重要作用,一方面可促進成骨細胞的合成和礦化,另一方面可在一定程度上抑制破骨細胞的活性。維生素D缺乏會導致骨質疏松,增加骨折的風險[17]。25OHD是維生素D在體內的主要儲存形式,半衰期約21 d,其檢測不受進食和生理節律的影響,臨床上推薦用25OHD檢測反映個體的維生素D營養狀態。國際骨質疏松基金會(International Osteoporosis Foundation,IOF)建議,25OHD低于20 ng/ml判為維生素D缺乏[3],本研究中,兩組25OHD均明顯低于此水平,與OP組相比,DOP組水平更低,差異有統計學意義,提示DOP患者體內維生素D缺乏更嚴重。
總之,DOP已經成為我們必須關注的健康問題,對于高危人群聯合進行骨轉換標志物與骨密度的監測,能更全面、更合理地評估骨強度,有助于DOP的早發現、早診斷、早治療,使患者早受益,減少骨折的發生率和其帶來的經濟負擔。對于2型糖尿病患者,控制血糖可能減緩骨量的丟失,另外積極補充維生素D也是十分必要的。

