小鼠髓樣細胞觸發受體-2基因小發卡狀RNA慢病毒載體構建
冉江霞,石勝良,王成志
(1 廣西醫科大學第二附屬醫院,南寧 530007;2 廣西醫科大學第三附屬醫院)
阿爾茨海默病(AD)是最常見的老年變性疾病,遲發型阿爾茨海默病(LOAD)是其重要分型。LOAD的發病核心與基礎是細胞外β-淀粉樣蛋白(Aβ)異常集聚以及由其引發的神經細胞毒性作用。針對Aβ的免疫性治療清除中樞神經系統的Aβ一直被認為是治療AD的關鍵,但嚴重的不良反應導致治療效果不佳[1]。髓樣細胞觸發受體(TREM2)是免疫球蛋白超家族中的一個受體家族。研究[2,3]認為,髓樣細胞觸發受體-2(TREM2)在介導小膠質細胞Aβ吞噬和調節中樞神經炎癥中有重要作用,與LOAD的發生發展有關。但其具體作用機制尚不明確。AD患者腦組織TREM2基因高表達[4],尤其是Aβ斑塊周圍的小膠質細胞[2,5,6],并與腦組織Aβ含量呈正相關[7,8]。因此,闡明TREM2的具體作用機制可能為AD的預防和治療提供新靶點。2017年12月~2018年5月,我們構建了TREM2基因小發卡狀RNA(shRNA)慢病毒表達載體(TREM2-shRNA),并檢測其對小鼠BV2小膠質細胞TREM2基因的沉默效果,旨在為后續細胞水平研究TREM2在LOAD發生發展中的作用機制機制奠定基礎。
1 材料與方法
1.1 細胞、試劑及儀器 小鼠BV2小膠質細胞由首都醫科大學宣武醫院饋贈。大腸埃希菌菌株DH5α、293T細胞、慢病毒載體GV248、pHelper 1.0載體、pHelper 2.0載體、Age I及dsDNA oligo購于上海吉凱基因化學技術有限公司;Primer購于捷瑞生物公司;胎牛血清、DMEM高糖培養基和Opti-MEM購于Gibco公司;Plasmid抽提試劑盒購于天根生化公司;EcoR Ⅰ和T4 DNA連接酶購于Thermo Scientific公司;Taq聚合酶購于Vazyme公司;RNA抽提試劑TRIzol購于Invitrogen公司;cDNA逆轉錄試劑盒和PCR試劑盒購于TAKARA公司。
1.2 TREM2-shRNA的構建、鑒定
1.2.1 TREM2-shRNA的構建 針對GenBank中小鼠TREM2基因的mRNA序列(NM_031254)設計3個RNA干擾( RNAi)靶點序列,分別為①5′-TTGCTGGAACCGTCACCAT-3′;②5′-AGAGGCTGAGGTCCTGCAGAA-3′;③5′-AGCGGAATGGGAGCACAGTCA-3′。同時設計陰性對照插入序列:5′-TTCTCCGAACGTGTCACGT-3′。根據靶點序列設計相應的編碼shRNA發夾結構的DNA模板鏈及其互補序列(表1),由上海吉凱基因化學技術有限公司合成。將以上互補鏈經退火形成雙鏈DNA,與經Age Ⅰ和EcoR Ⅰ雙酶切后的線性化GV248載體連接。反應體系如下:100 ng/μL線性化載體1 μL,100 ng/μL雙鏈DNA 1 μL,T4 DNA連接酶1 μL,10×T4 DNA連接酶緩沖液2 μL,加ddH2O至20 μL,16 ℃連接過夜。將連接產物轉化感受態大腸埃希菌DH5α,取適量菌液接種至LB固體培養基平板上,孵育過夜。挑取陽性重組克隆TREM2-shRNA-1、TREM2-shRNA-2、TREM2-shRNA-3送上海美季生物技術有限公司進行DNA測序。測序結果顯示,合成的TREM2 shRNA1、shRNA2、shRNA3寡核苷酸序列均已成功插入載體中,無突變且位置正確,與預先設計完全一致。

表1 TREM2-shRNA-1、TREM2-shRNA-2、TREM2-shRNA-3的引物序列
1.2.2 TREM2-shRNA的包裝及滴度測定 分別將TREM2-shRNA-1、TREM2-shRNA-2、TREM2-shRNA-320 μg、包裝質粒pHelper 1.0載體15 μg、pHelper 2.0載體10 μg與相應體積的吉凱轉染試劑混勻使其總體積為1 mL,共轉染密度為70%~80%的293T細胞。培養6 h換成完全培養基,培養24 h熒光顯微鏡下觀察綠色熒光(GFP)情況,培養48 h收獲細胞上清,對其進行超速離心沉淀得到高滴度的慢病毒濃縮液,-80 ℃保存備用。滴度測定前1天,將處于對數生長期的293T細胞以約4×104/孔接種于96孔板中;用培養基以10倍梯度逐孔稀釋病毒原液為6個濃度(100~10-5),用不同濃度的病毒液感染293T細胞,培養24 h更換為完全培養基。繼續培養4 d,熒光顯微鏡下觀察GFP情況,測算病毒滴度。病毒滴度(TU/mL)=熒光細胞數/病毒原液量。
1.3 TREM2-shRNA對BV2小膠質細胞TREM2表達的影響觀察
1.3.1 BV2小膠質細胞分組及 TREM2-shRNA感染 取對數生長期BV2小膠質細胞,5×104/孔接種于24孔板中培養。培養24 h待細胞密度約70%時,將細胞分為TREM2-shRNA-1感染組、TREM2-shRNA-2感染組、TREM2-shRNA-3感染組、陰性對照組及空白對照組5組,每組6個復孔,TREM2-shRNA-1感染組、TREM2-shRNA-2感染組、TREM2-shRNA-3感染組、陰性對照組分別感染TREM2-shRNA-1、TREM2-shRNA-2、TREM2-shRNA-3、shRNA空質粒,以感染復數=80感染細胞,培養6 h后更換為完全培養基,空白組不做任何處理。TREM2-shRNA-1感染組、TREM2-shRNA-2感染組、TREM2-shRNA-3感染組感染120 h在熒光顯微鏡下均觀察到GFP,且感染效率均達95%以上,提示慢病毒感染成功。
1.3.2 各組細胞TREM2 mRNA檢測 感染120 h取各組細胞,裂解提取總RNA,合成cDNA,Q-PCR法檢測各組TREM2 mRNA。TREM2上游引物:5′-AGCCTACCACCTTCCTCCTCT-3′,下游引物:5′-TCACGTACCTCCGGGTCCAGT-3′。β-actin上游引物為:5′-GAGACCTTCAACACCCCAGC-3′,下游引物:5′-ATGTCACGCACGATTTCCC-3′。反應體系,上游引物(0.7 μmol/L)0.7 μL,下游引物(0.7 μmol/L)0.7 μL,cDNA 1.0 μL,2x SYBR Green Mix 5 μL,ROX 0.5 μL,加RNase-free water至10 μL。反應條件95 ℃ 預變性2 min,95 ℃ 5 s,60 ℃ 30 s,共40個循環。采以2-△△Ct代表TREM2 mRNA的相對表達量。計算細胞沉默效率,沉默效率=(1-重組慢病毒載體組TREM2 mRNA相對表達量/空白對照組TREM2 mRNA相對表達量)×100%。每組設3個復孔,實驗重復3次,取平均值。
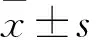
2 結果
TREM2-shRNA-1、TREM2-shRNA-2、TREM2-shRNA-3轉染293T細胞24 h熒光顯微鏡下均可觀察GFP,證實病毒包裝成功。經計算,TREM2-shRNA-1、TREM2-shRNA-2和TREM2-shRNA-3的滴度分別為(4×108)、(4×108)、(5×108)TU/mL。TREM2-shRNA-1感染組、TREM2-shRNA-2感染組、TREM2-shRNA-3感染組、陰性對照組及空白對照組TREM2 mRNA相對表達量分別為49.4%±3.98%、79.7%±2.01、65.3%±2.41%和39.2%±6.98%,與空白對照組和陰性對照組比較,TREM2-shRNA-1感染組、TREM2-shRNA-2感染組、TREM2-shRNA-3感染組TRME2 mRNA相對表達量均降低(P均<0.05);與REM2-shRNA-1感染組、T、TREM2-shRNA-3感染組比較,REM2-shRNA-2感染組TRME2 mRNA相對表達量降低(P均<0.05)。TREM2-shRNA-1感染組、TREM2-shRNA-2感染組、TREM2-shRNA-3感染組、陰性對照組的沉默效率分別為49.4%±3.98%、79.7%±2.01、65.3%±2.41%和39.2%±6.98%,TREM2-shRNA-2感染組沉默效率最高。
3 討論
TREM2基因位于小鼠染色體17C3上,包括5個外顯子結構,編碼一個跨膜糖蛋白受體,屬于免疫球蛋白-凝集素樣超家族受體的成員。它由胞外免疫球蛋白樣結構域、跨膜結構域和胞質尾部組成。酪氨酸激酶結合蛋白常與TREM2的跨膜區域相互作用并且通過其胞質免疫受體酪氨酸激活基序來招募蛋白酪氨酸激酶(Syk)。Syk啟動比如Ca2+動員、蛋白質酪氨酸磷酸化和細胞外信號調節激酶激活等一系列信號事件[9],這些信號促進細胞存活、增殖、吞噬和炎癥調節。TREM2廣泛分布于腦內,以白質、海馬和新皮質最多,并主要表達于髓樣細胞如小膠質細胞、巨噬細胞和樹突狀細胞[10]。在中樞神經系統中,TREM2僅存在于小膠質細胞上[11]。因此,通過沉默TREM2在小膠質細胞中的表達,來研究TREM2是通過何種通路調控小膠質細胞對Aβ的吞噬并抑制中樞炎癥反應是非常有必要的,對于探索TREM2基因在LOAD中的作用機制十分重要。
研究目的基因在相關疾病發生發展中是否發揮重要作用及其相關分子機制通常需要觀察細胞中目的基因沉默后其下游基因蛋白表達變化和細胞生物學行為變化,RNAi正扮演著這樣一個重要角色。RNAi是利用雙鏈RNA與靶基因mRNA特異性結合,引起同源基因特異性降解的一種轉錄后基因沉默現象。常被用于RNA干擾的是shRNA,它是一段具有緊密發卡環的RNA序列。RNAi技術作為新興的基因阻斷技術在基因功能和相關方面的研究具有許多傳統反義技術無法比擬的優勢:高度特異性、高效性、高穩定性、快速性、可遺傳性和可傳播性等[12]。目前,RNAi已成為研究功能基因組學、基因治療、信號傳導通路分析和藥物靶點篩選等熱門領域的強有力工具。
RNAi的有效性主要由基因轉移的效率決定。目前,基因轉移技術有多種,常用的有質粒和病毒載體。質粒作為載體介導RNAi轉染時,存在轉染效率低、對基因的抑制表達作用弱、作用持續時間短、無法轉染非分裂相細胞等缺點,因而,在實際應用中受到限制。病毒載體中,慢病毒載體近幾年來受到了科研工作者們的青睞。慢病毒載體是一種復制缺陷型逆轉錄病毒載體,是在HIV-Ⅰ基礎上改造成的病毒載體系統。慢病毒載體充分發揮了自身所具備的優勢,比如病毒效價高、生物安全性高、感染譜廣、感染效率高、容納目的基因片段大、目的基因表達持久穩定和免疫反應小等[13~15]。這些優勢使慢病毒載體成為RNAi的首選載體[16]。因此,本實驗采取GV248慢病毒載體,該載體中含有U6啟動子,在宿主細胞中能持續表達有干擾作用的shRNA;該載體還含有IRES和Ubiquitin啟動子,且它們后面分別緊接puromycin和EGFP,這使得該載體感染目的細胞后,puromycin和EGFP能更高效地表達,有利于后續使用嘌呤霉素對細胞進行篩選和對感染效率進行觀察。本研究構建了TREM2-shRNA-1、TREM2-shRNA-2、TREM2-shRNA-3等3種小鼠TREM2基因shRNA慢病毒表達載體,并均通過測序鑒定,經包裝產生慢病毒的滴度達到后續實驗要求。由于病毒對小鼠BV2小膠質細胞的感染效率顯著高于siRNA和質粒的轉染效率,因此,本研究使用包裝后的慢病毒感染小鼠BV2小膠質細胞進行有效靶點的篩選。3種小鼠TREM2基因shRNA慢病毒表達載體感染小鼠BV2小膠質細胞后,熒光顯微鏡下觀察,感染效率可達95%以上;TREM2 mRNA相對表達量均下降,篩選出沉默效果最佳的TREM2-shRNA-2,對TREM2基因mRNA表達的沉默效率可達79.7%。
綜上所述,成功構建TREM2-shRNA-1、TREM2-shRNA-2、TREM2-shRNA-3。TREM2-shRNA-1、TREM2-shRNA-2、TREM2-shRNA-3均可沉默小鼠BV2小膠質細胞中TREM2基因表達,以TREM2-shRNA-2沉默效果最好。

