miR-26b對不同分化狀態(tài)神經(jīng)干細胞系C17.2向肝細胞生長因子趨化遷移的影響觀察
熊英,汪顯耀,秦臻,田羽,王嵐,潘際剛,許鍵煒,
(1 貴州醫(yī)科大學(xué)基礎(chǔ)醫(yī)學(xué)院,貴陽550025;2 貴州醫(yī)科大學(xué)組織工程與干細胞實驗中心;3貴陽市婦幼保健院;4貴州醫(yī)科大學(xué)醫(yī)學(xué)科學(xué)研究所)
神經(jīng)干細胞(NSCs)是一種具有自我更新、自我復(fù)制和多向分化潛能的細胞,可被誘導(dǎo)分化為神經(jīng)元、星形膠質(zhì)細胞和少突膠質(zhì)細胞。胚胎發(fā)育過程中NSCs可不斷遷移至特定區(qū)域分化為特定細胞,這種定向遷移能力在神經(jīng)系統(tǒng)的發(fā)育和神經(jīng)損傷修復(fù)過程中發(fā)揮重要作用[1,2]。研究[3,4]發(fā)現(xiàn),在神經(jīng)膠質(zhì)瘤和腦損傷等病理條件下,內(nèi)源或外源移植的NSCs可定向遷移至神經(jīng)及腦損傷區(qū)域,通過替代受損神經(jīng)元細胞或分泌神經(jīng)營養(yǎng)因子改造損傷區(qū)域的微環(huán)境,促進受損神經(jīng)元自我修復(fù),這為中樞神經(jīng)系統(tǒng)疾病的治療帶來了新思路。但NSCs定向遷移的具體機制至今尚未明確。Kim等[1,5]研究發(fā)現(xiàn),肝細胞生長因子(HGF)可誘導(dǎo)NSCs的定向遷移、分化。微小RNA (miRNA)是基因表達調(diào)控在轉(zhuǎn)錄后水平的抑制子,參與細胞的增殖、分化和凋亡等[6]。進一步研究[7]認為,miRNA可調(diào)控干細胞調(diào)節(jié)因子的表達,在干細胞增殖、分化及遷移中起重要作用。miR-26b與miR-26a、miR-1297、miR-4465同屬于miR-26家族,是調(diào)控神經(jīng)干細胞分化的重要基因。目前關(guān)于miR-26b對NSCs向HGF趨化、遷移的影響相關(guān)報道較少。2017年12月~2018年5月,我們觀察了不同分化狀態(tài)NSCs中miR-26b的表達變化,并分析miR-26b在NSCs向HGF趨化、遷移過程中的作用,旨在為進一步闡明NSCs的定向遷移相關(guān)機制提供理論依據(jù)。
1 材料與方法
1.1 細胞、試劑及儀器 神經(jīng)干細胞系C17.2由美國Evan Y.Snyder教授饋贈。 H-DMEM、F12 DMEM培養(yǎng)基、胎牛血清(FBS)、馬血清(HS)均購自美國Gibco公司;胰蛋白酶、N2、L-谷氨酰胺、溴酚藍、HGF均購自美國Sigma公司;TRIzol、轉(zhuǎn)染試劑購自美國Ambion 公司;Lipofectamine2000 購自美國Invitrogen公司;miR-26b mimic(促進miR-26b表達)、miR-26b inhibitor(抑制miR-26b表達)、miR-26b NC(對照)、miR-26b亂序?qū)φ?Con Ⅰ)及miR-26b引物均購自廣州銳博生物科技公司;SYBR Green RT-qPCR 試劑盒、紫外分光光度計(NanoDrop2000)及細胞培養(yǎng)箱(Model311)購自美國Therom公司;超凈工作臺購自蘇凈集團,臺式高速冷凍離心機(Allegra 64R)購自美國貝克曼公司,實時熒光定量PCR儀(StepOne)購自美國ABI公司,倒置相差顯微鏡(CKX31)購自日本Olympus公司。
1.2 HGF刺激下不同分化狀態(tài)的C17.2細胞miR-26b檢測
1.2.1 細胞培養(yǎng)、誘導(dǎo)分化及分組 復(fù)蘇C17.2細胞,于含10% FCS、5% HS的H-DMEM中培養(yǎng),當細胞匯合度90%左右時傳代,用0.05%胰蛋白酶消化,終止消化后,1 000 r/min離心5 min,棄上清,按1∶3比例傳代,置于37 ℃、5% CO2培養(yǎng)箱中培養(yǎng)。培養(yǎng)48 h,待細胞匯合度達50% 左右時,將完全生長培養(yǎng)基更換為含N2和F12的誘導(dǎo)分化培養(yǎng)基,誘導(dǎo)C17.2分化。將細胞分為A、B、C、D組,A、B、C組分別于誘導(dǎo)分化12、24、72 h三個時間點終止誘導(dǎo)分化,獲得不同分化狀態(tài)的NSCs。D組為誘導(dǎo)分化前的細胞。
1.2.2 各組細胞miR-26b檢測方法 采用實時熒光定量PCR法。取A、B、C、D組細胞,TRIzol 法提取總RNA, RQ1 RNase-Free DNase 去除基因組DNA,NanoDrop 2000檢測RNA濃度。根據(jù)Revert AidTm First Strand cDNA Synthesis kit建立20 μL 反應(yīng)體系,逆轉(zhuǎn)錄總RNA為cDNA。嚴格按照SYBR Green PCR 試劑盒說明書進行操作,以U6為內(nèi)參。miR-26b上游引物:5′-AAGTAATTCAGGATAGGTGTCGT-3′;下游引物:5′- CCAGTGCGTGTCGTGGAT- 3′。U6上游引物5′-CTCGCTTCGGCAGCACA- 3′;下游引物5′-AACGCTTCACGAATTTGCGT- 3′。按照RT-qPCR kit建立20 μL PCR反應(yīng)體系:SYB Green super mix 10 μL,F(xiàn)P 1 μL,RP 1 μL,cDNA 2 μL,dH2O 6 μL。反應(yīng)條件:95 ℃預(yù)變性 10 min;變性95 ℃ 10 s,60 ℃退火1 min,40個循環(huán)。以小RNA分子U6為miR-26b內(nèi)參,以2-ΔΔCt代表miR-26b的相對表達量。實驗重復(fù)3次,取平均值。
1.2.3 HGF刺激下各組細胞miR-26b檢測 取“1.2.1”中各組細胞,將誘導(dǎo)分化培養(yǎng)基更換為含25 ng/mL的HGF完全培養(yǎng)基,孵育5 h,每組均設(shè)相應(yīng)對照,予以無HGF的完全培養(yǎng)基孵育5 h。檢測各組細胞miR-26b,所有操作均同“1.2.2”,實驗重復(fù)3次,取平均值。
1.3 抑制、過表達miR-26b對C17.2細胞向HGF趨化遷移的影響
1.3.1 促進miR-26b表達對C17.2細胞向HGF趨化遷移的影響觀察 取對數(shù)生長期C17.2細胞,分為兩組,1×105/孔接種于24孔板,每組6個復(fù)孔,生長80%~90%時用lipofectamine2000分別轉(zhuǎn)染miR-26b mimic、miR-26b NC,轉(zhuǎn)染48 h時RT-qPCR法檢測檢測miR-26b mimic、NC細胞miR-26b分別為75.44±7.17、1.00±0.10(P<0.05),說明轉(zhuǎn)染成功。將完全生長培養(yǎng)基更換為含N2和F12的誘導(dǎo)分化培養(yǎng)基,誘導(dǎo)分化,分別于誘導(dǎo)分化0、12、24、72 h終止誘導(dǎo)分化,獲得不同分化狀態(tài)的NSCs。采用Transwell實驗檢測各分化時間細胞的趨化遷移能力:將細胞稀釋成2×105/mL的細胞懸液,將孔徑為8.0 μm的Transwell小室置于24孔培養(yǎng)板中,在Transwell上室中加入細胞懸液,每孔200 μL,下室加入500 μL 含25 ng/mL HGF和10% FBS的H-DMEM,37 ℃、5% CO2條件下孵育24 h,棄上室培養(yǎng)基,用無菌棉簽擦拭上室,對下室細胞采用4%多聚甲醛進行固定,0.1% 結(jié)晶紫染色30 min,PBS漂洗后于倒置相差顯微鏡下拍照并測算遷移至室膜下方的細胞數(shù),計算細胞遷移率(遷移細胞數(shù)/總細胞數(shù)×100%)。將對照組的遷移細胞數(shù)標準化定義為1。重復(fù)3次,取平均值。
1.3.2 抑制miR-26b表達對C17.2細胞向HGF趨化遷移的影響觀察 取對數(shù)生長期C17.2細胞,分為兩組,1×105/孔接種于24孔板,每組6個復(fù)孔,生長80%~90%時用 lipofectamine 2000分別轉(zhuǎn)染miR-26b inhibitor、Con ,轉(zhuǎn)染48 h時miR-26b inhibitor、Con Ⅰ細胞miR-26b相對表達量分別為0.32±0.04、1.00±0.12(P<0.05),說明轉(zhuǎn)染成功。將完全生長培養(yǎng)基更換為含N2和F12的誘導(dǎo)分化培養(yǎng)基,誘導(dǎo)分化,分別于誘導(dǎo)分化0、12、24、72 h終止誘導(dǎo)分化,采用Transwell實驗檢測各分化時間細胞的趨化遷移能力,計算細胞遷移率。所有操作同“1.3.1”,重復(fù)3次,取平均值。
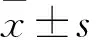
2 結(jié)果
2.1 不同分化狀態(tài)C17.2細胞miR-26b相對表達量比較 A、B、C、D組細胞miR-26b相對表達量分別為1.16±0.07、1.39±0.11、2.30±0.11、1.00±0.03,與D組比較,B、C組胞miR-26b相對表達量升高,P均<0.05。
2.2 HGF處理后各組細胞miR-26b相對表達量比較 A、B、C、D組HGF處理5 h時細胞miR-26b相對表達量分別為2.02±0.43、2.28±0.35、2.50±0.41、2.21±0.23,A、B、C、D組未經(jīng)處理細胞miR-26b相對表達量分別為1.21±0.12、1.47±0.21、2.30±0.20、1.00±0.04,與未經(jīng)處理者比較,HGF處理5 h時A、B、D組細胞miR-26b相對表達量均升高,P均<0.05。
2.3 促進miR-26b表達后不同分化狀態(tài)C17.2細胞向HGF的趨化遷移率比較 促進miR-26b表達后不同分化狀態(tài)C17.2細胞向HGF的趨化遷移率比較見表1、圖1。

表1 促進miR-26b表達后不同分化狀態(tài)C17.2細胞向HGF趨化遷移率比較
注:與轉(zhuǎn)染NC者比較,*P<0.05。

圖1 轉(zhuǎn)染miR-26b mimic、NC的不同分化狀態(tài)>C17.2細胞遷移情況
2.4 抑制miR-26b表達后不同分化狀態(tài)C17.2細胞向HGF的趨化遷移率比較 抑制miR-26b表達后不同分化狀態(tài)的C17.2細胞向HGF的趨化遷移率比較見表2、圖2。

表2 抑制miR-26b表達后不同分化狀態(tài)C17.2細胞向HGF趨化遷移率比較
注:與轉(zhuǎn)染Con Ⅰ者比較,*P<0.05。

圖2 轉(zhuǎn)染miR-26b inhibitor、Con Ⅰ的不同分化狀態(tài)C17.2細胞遷移情況
3 討論
NSCs具有自我更新和多向分化潛能,在一定條件下可以誘導(dǎo)分化成為神經(jīng)元、星形膠質(zhì)細胞和少突膠質(zhì)細胞,這為替代性治療腦損傷及神經(jīng)系統(tǒng)退行性疾病提供了可靠的細胞移植物。人體成年NSCs主要局限在嗅球、側(cè)腦室外側(cè)壁的腦室下區(qū)和海馬齒狀回的顆粒下層,在腦損傷或出現(xiàn)神經(jīng)退行性病變時,NSCs能夠特異性地向病變區(qū)域有序遷移,通過替代受損的神經(jīng)元細胞或者分泌神經(jīng)營養(yǎng)因子改造損傷區(qū)域的微環(huán)境,促進受損神經(jīng)元的自我修復(fù)。NSCs的定向遷移是其發(fā)揮修復(fù)作用的前提,無論是內(nèi)源還是外源移植的NSCs都需要經(jīng)過一定距離的遷移到達腦損傷的特定區(qū)域,然后再發(fā)揮其修復(fù)功能[8]。然而,在神經(jīng)干細胞移植治療腦損傷的研究中發(fā)現(xiàn),移植在腦損傷區(qū)域周圍的NSCs只有少部分能夠遷移到損傷區(qū)域[9],這是制約干細胞移植療效的重要原因,成為目前NSCs移植治療中亟待解決的問題。NSCs的定向遷移和分化是個復(fù)雜而精準的過程,具體機制尚未闡明,因此深入了解其相關(guān)分子機制,尋找提高移植細胞遷移效率的方法,是改善療效的關(guān)鍵。
研究[10,11]表明NSCs的定向遷移和分化受到趨化因子以及miRNA等多因素的調(diào)控。隨著研究的深入,多種炎癥因子包括HGF、基質(zhì)細胞衍生因子、干細胞因子、白介素等對NSCs趨化遷移的影響逐漸被認識。其中,HGF是一種旁分泌的多能性細胞因子,Takano等[5]研究表明,HGF是促進NSCs的增殖和成神經(jīng)分化的關(guān)鍵因子,脊髓損傷區(qū)域的HGF分泌增加,能有效的促進NSCs移植后神經(jīng)功能的恢復(fù)。魏友華等[12]研究表明,HGF參與調(diào)控了NSCs的趨化遷移,并且NSCs趨向HGF遷移的能力與其分化狀態(tài)密切相關(guān),適當?shù)恼T導(dǎo)分化狀態(tài)下,NSCs具備更強的趨化遷移能力。因此本研究以HGF為趨化誘導(dǎo)因子,并將NSCs進行了不同時間的誘導(dǎo)分化,進一步研究影響其趨化遷移的可能相關(guān)機制。
miRNA在細胞的增殖、分化、凋亡以及遷移過程中發(fā)揮重要作用。miR-26家族在胎兒腦發(fā)育、肌肉分化以及人間充質(zhì)干細胞增殖中起重要作用[13~15]。此外,miRNA的失調(diào)與部分神經(jīng)退行性疾病密切相關(guān),Absalon等[16]研究證實,阿爾茨海默病患者腦內(nèi)病灶區(qū)的miR-26b表達在疾病早期就開始增加,miR-26b靶向與該疾病密切相關(guān)的幾種蛋白,參與了疾病的病理過程。正常生理狀態(tài)下NSCs維持相對靜止的狀態(tài),當神經(jīng)系統(tǒng)發(fā)生損傷后病變區(qū)域微環(huán)境的改變,是促使NSCs的定向遷移的重要因素,為了研究miR-26b是否參與調(diào)控NSCs的定向遷移,本研究檢測了不同分化狀態(tài)NSCs的miR-26b表達水平,并比較了HGF對不同分化狀態(tài)NSCs中miR-26b表達水平的影響,提示miR-26b的表達在NSCs分化過程中呈逐漸上調(diào)的趨勢,HGF的刺激能夠上調(diào)NSCs中 miR-26b的表達。此外,通過Transwell實驗從細胞群體水平,觀察了NSCs轉(zhuǎn)染miR-26b mimic后向HGF的趨化遷移情況,結(jié)果表明過表達miR-26b能夠顯著提高NSCs的趨化遷移能力,尤其是誘導(dǎo)分化12 h和1 d的NSCs。為了驗證上述結(jié)果,進一步通過轉(zhuǎn)染miR-26b inhibit下調(diào)NSCs中miR-26b的表達后行Transwell實驗,發(fā)現(xiàn)各分化狀態(tài)NSCs的遷移效率顯著降低,反向論證了miR-26b參與NSCs定向遷移的調(diào)控,且其調(diào)控作用與細胞的分化狀態(tài)有關(guān)。
綜上所述,不同分化狀態(tài)C17.2細胞miR-26b表達均上調(diào)。在HGF刺激下,促進miR-26b表達的C17.2細胞定向遷移能力更強。miR-26b可促進不同分化狀態(tài)的C17.2細胞向HGF的趨化遷移。但由于miR-26b有多個靶標基因,廣泛地參與了神經(jīng)元分化,細胞增殖、凋亡等細胞生物學(xué)過程,其調(diào)控NSCs定向遷移的具體靶基因及相關(guān)信號通路更有待進一步研究闡明。

