側臥位前入路與后外側入路全髖關節置換術治療強直性脊柱炎合并髖關節強直療效比較
干子陽 尚希福 陳 敏 吳科榮 張賢祚
強直性脊柱炎(ankylosing spondylitis,AS)是一種侵犯脊柱,并累及骶髂關節和周圍關節的慢性進行性炎性疾病,其中髖關節受累后表現為髖關節局部疼痛及關節活動受限,晚期可出現屈曲攣縮、畸形或關節強直[1]。髖關節強直畸形嚴重影響患者的髖關節功能和生活質量,全髖關節置換術(total hip arthroplasty,THA)是緩解髖關節疼痛、恢復關節功能的有效手段[2]。目前臨床對于強直性脊柱炎合并髖關節強直進行全髖關節置換的手術入路常為后外側入路(posterolateral approach,PLA),術中需要切斷肌性結構,手術創傷大且術后髖關節功能恢復時間長[3]。側臥位直接前方入路(lateral position direct anterior approach,LDAA)從肌肉、神經間隙顯露髖關節,能夠避免損傷髖關節周圍肌肉,具有出血少、疼痛輕、低脫位率等優點,有利于術后早期髖關節的快速康復,近年來得到越來越多醫生的認可[4]。AS患者因術前關節屈曲攣縮或強直較一般患者更為嚴重,活動受限明顯,其手術難度更大,術后髖關節功能恢復更為困難[3]。本研究通過比較兩種手術入路下行全髖關節置換術的臨床治療及隨訪結果,評價LDAA在AS患者髖關節疾病的治療療效,現報道如下。
1 資料與方法
1.1 一般資料 選擇2014年6月至2017年6月中國科技大學第一附屬醫院收治的AS累及髖關節強直的患者64例為研究對象,其中髖關節僵直12例,纖維強直24例,骨性強直28例。采用隨機數表法將研究對象按病情輕重平均分入LDAA組和PLA組,每組32例。LDAA組采用側臥位直接前方入路全髖關節置換術,其中男性29例,女性3例,平均年齡(42.5±9.7)歲;PLA組采用傳統后外側入路全髖關節置換術,其中男性31例,女性1例,平均年齡(44.6±8.5)歲。LDAA組和PLA組術前平均髖關節Harris評分[5]分別為(39.42±8.63)分,(43.25±7.57)分。兩組患者年齡(P=0.409)、性別(P=0.606)以及術前平均髖關節Harris評分(P=0.157)差異均無統計學意義(P<0.05)。本研究得到本醫院倫理委員會批準,患者知情并簽署同意書。所有患者均行單側手術,病變累及雙側患者均先選擇病變嚴重側行手術治療,對側肢體待術后康復完成(>6個月)后再行二期手術治療[6]。
1.2 納入與排除標準 納入標準:所有患者均為明確診斷的AS患者,合并髖關節疼痛、功能障礙需要全髖關節置換術。排除標準:①髖關節屈曲畸形>40°;②髖關節內收、內旋畸形;股骨近端嚴重骨質疏松;③患有嚴重心腦血管等基礎疾病難以耐受手術者;④C反應蛋白、血沉高于正常值2倍;⑤有關節感染病史及其他關節置換禁忌證者;⑥術前停用免疫抑制劑<3周者。
1.3 方法
1.3.1 LDAA組手術方法 患者采用全身麻醉,從髂前上棘下2 cm,髂前上棘外側2 cm處開始向遠端作長約8 cm切口,逐層切開皮膚、皮下、闊筋膜張肌表面切開闊筋膜,注意保護股外側皮神經,結扎旋股外側血管升支。切除關節囊上方脂肪墊,充分顯露關節囊,切除前方髖關節囊,顯露股骨頸。“兩刀法”原位截斷股骨頸,內收外旋髖關節,進一步切除內側髖關節囊,對于髖關節強直股骨頭去除困難,辨別髖臼周緣后可直接小銼打磨股骨頭至馬蹄窩底部,然后逐級增大髖臼銼直徑打磨髖臼。適當減小前傾角安裝臼杯,根據髖臼杯穩定性決定是否使用螺釘固定,安裝內襯。外旋、后伸髖關節,松解后上方關節囊,抬高股骨近端進行擴髓,股骨柄假體插入髓腔并壓配緊實,安裝股骨頭假體。復位髖關節,檢查髖關節穩定性,關閉關節腔后經引流管向關節腔內注射10%氨甲環酸10 mL并夾閉引流管6 h。
1.3.2 PLA組手術方法 患者行全身麻醉,采取常規后外側入路顯露髖關節完成全髖關節置換,髖臼及股骨假體安裝同LDAA組。
術后兩組患者均使用二代頭孢菌素(頭孢呋辛鈉 1.5g,2次/天,靜脈滴注)預防感染治療,低分子肝素(4 000 UI 1次/天,皮下注射)預防術后雙下肢深靜脈血栓形成[7]。術后6 h兩組患者均開始進行功能鍛煉。
1.4 觀察指標
1.4.1 術中指標 記錄兩組患者手術時間、切口長度、術中出血量[術中出血量=(術后紗布重量-術前干紗布重量)+ (術后沖洗液重量-術后沖洗液重量)]。
1.4.2 術后指標 記錄兩組患者術后引流量、術后首次下床時間,術后第1天、第3天、第5天、第7天髖關節視覺模擬疼痛評分(visual analogue score,VAS)[8]。
由1名未參與手術治療的康復醫師測量患者術后第1個月、3個月及6個月髖關節Harris功能評分[5]評定關節功能恢復情況。Harris評分是從疼痛、功能、畸形和活動度方面評價髖關節功能,滿分100分。≥90分為優良,80~89分為較好,70~79分為尚可,<70分為差。同時統計患者截止術后6個月并發癥發生情況,包括術中股骨骨折,術后髖關節脫位、感染、假體松動以及異位骨化等。

2 結果
2.1 兩組患者圍手術期指標比較 LDAA組手術時間、切口長度、術中失血量、術后引流量、術后初次下床行走時間均優于PLA組,差異有統計學意義(P<0.05)。詳見表1。
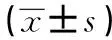
表1 兩組患者圍手術期指標比較
2.2 兩組患者VAS評分比較 兩組患者不同時間點VAS評分比較,差異有統計學意義(P<0.05)。LDDA組術后第1、3、5及第7天VAS評分優于PLA組,差異有統計學意義(P<0.05)。詳見表2。
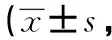
表2 兩組患者術后VAS評分分)
2.3 兩組患者術后髖關節Harris評分比較 LDAA組術后隨訪髖關節Harris評分優于PLA組,差異有統計學意義(P<0.05)。詳見表3。
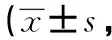
表3 兩組患者術后隨訪HHS評分分)
2.4 兩組患者并發癥比較 隨訪6個月,PLA組共出現髖關節脫位2例,Brooker 1型異位骨化8例;LDAA組出現術中股骨大轉子骨折1例,Brooker 1型異位骨化2例。兩組間術后異位骨化并發癥發生率比較,差異有統計學意義(χ2=4.267,P=0.041)。
3 討論
AS累及髖關節病變進行全髖關節置換術的手術入路選擇由術前髖關節處于何種畸形決定。后外側入路適用于絕大多數AS合并髖關節強直患者。但是,對于術前髖關節屈曲、外展及外旋患者,股骨大轉子常遮擋后方股骨頸,影響股骨頸截骨操作,時而需要附加股骨大轉子截骨改善術野顯露。股骨大轉子截骨存在骨不連和股骨大轉子滑囊炎的潛在風險[9]。因此,有學者[10]提出,對于術前髖關節屈曲、外展及外旋患者可選擇髖關節前外側入路。前外側入路術中需將臀中肌前1/3自股骨大轉子前部剝離,手術入路的缺陷導致患者術后難以早期功能康復,同時,降低髖部外展肌力。本研究顯示,術中失血量、術后引流量、術后初次下床行走時間均優于PLA組(P<0.05)。術后VAS評分、術后隨訪髖關節Harris評分存在統計學差異P<0.05),直接前方入路優于后外側入路,符合快速康復外科理念。然而,前入路治療髖關節強直的病例選擇相對謹慎,因髖關節活動度過差的患者,術中股骨近端應力集中,容易導致術中股骨醫源性骨折發生[11]。本次研究在納入研究對象時即排除了屈曲畸形超過40°、內收和內旋患者,有效預防了股骨近端骨折的發生。
前入路術中股骨骨折的發生率約為2%[12],高于髖關節其他手術入路。股骨大轉子骨折、股骨距劈裂、股骨穿孔是較為常見的術中股骨骨折類型。術中股骨骨折的發生與術前髖關節活動度、股骨擴髓方向、骨質疏松程度、前入路學習曲線有關。本研究中前入路組出現1例股骨大轉子骨折,因股骨大轉子骨塊大,影響生物型股骨柄穩定性,術中予以多股鋼絲環扎。筆者認為,髖關節活動度差非前入路的手術禁忌證,股骨頸截骨后髖關節獲得度基本可以滿足髖臼側操作,但對于股骨側擴髓操作必須進行有序的、徹底的軟組織松解,松解的目的除了在于改善股骨近端的顯露和避免闊筋膜張肌損傷,更重要的是有利于降低術中股骨醫源性骨折的發出,同時,便于復位重建后的髖關節。
全髖關節置換術后異位骨化可減少髖關節活動度、降低髖關節功能。文獻[13]報道,強直性脊柱炎患者全髖關節置換術后具有11%~76%異位骨化發生率[14]。然而,異位骨化的發生機制尚未明確[12]。需要指出的是,強直性脊柱炎患者較高的異位骨化發生率與髖關節手術入路有一定的關系。本研究中,LDAA組患者術后出現2例Brooker 1型異位骨化,低于PLA組的發生率(P<0.05)。兩組患者術后均未常規使用非甾體抗炎藥預防異位骨化,筆者認為前入路術后較低的異位骨化發生率得益于前入路自身優勢,不損傷髖關節周圍肌肉、術中出血少,術后切口內血腫少等。
綜上所述,LDAA全髖關節置在AS合并髖關節強直的臨床治療中,具有出血少、疼痛輕、髖關節功能恢復快等優點,具有良好的近期療效,但由于前入路學習曲線較長,AS患者合并強直髖的病例的選擇較其他病因所致的終末期髖關節炎更為嚴格。

