電視胸腔鏡下肺葉切除治療非小細胞肺癌的臨床療效及安全性分析
王德昌 水 清 陳 方
肺癌是臨床常見的惡性腫瘤,包括非小細胞肺癌和小細胞肺癌。其發病率在我國占惡性腫瘤首位,其中非小細胞肺癌約占80%[1]。目前,臨床治療非小細胞肺癌的主要方法為外科手術,包括傳統開胸手術、胸腔鏡手術及介入手術治療。既往報道[2]認為,開胸手術創傷較大,并發癥多,患者耐受度低,術后恢復緩慢,故臨床應用有一定局限性。胸腔鏡手術引入一種新型微創胸外科技術,因其具有手術切口小、創傷少、術后疼痛輕微的優勢而迅速得到廣泛應用[3]。但目前由于電視胸腔鏡下肺葉切除術開展時間不長,且與傳統術式相比,該術式是否具有相同的療效或改善手術并發癥等方面缺少明確的依據[4]。因此,本文納入我院收治的126例非小細胞肺癌患者,探析電視胸腔鏡下肺葉切除治療該病的臨床療效,現報道如下。
1 資料與方法
1.1 一般資料 采用便利抽樣法選取2016年1月至2018年1月于南陽市第一人民醫院收治的126例非小細胞肺癌患者。納入標準:①符合《非小細胞肺癌免疫組化標志物專家共識(2014)》[5]中相關診斷標準,術前胸部X線片、胸部CT等輔助檢查支持診斷,且經術后病理檢查確診,未出現遠處轉移,TNM分期為Ⅰa~Ⅱb期;②年齡≥25歲;③術前未行放化療及其他抗腫瘤治療;④患者均知情同意。排除標準:①伴有惡性腫瘤病史或合并其它惡性腫瘤;②CT或X線片示胸膜增厚或鈣化明顯,胸膜呈廣泛致密性粘連;縱隔或肺門淋巴結腫大明顯,與周圍組織呈粘連緊密狀態;③合并肺葉切除禁忌證及嚴重臟器功能障礙;④腫瘤直徑≥5 cm;⑤妊娠期或哺乳期婦女。根據患者入院時間順序進行編號,按照隨機數字表法分為對照組和觀察組,每組各63例,其中對照組予以傳統開胸肺葉切除術,觀察組予以電視胸腔鏡下肺葉切除術。兩組一般資料比較差異無統計學意義(P>0.05),詳見表1。本研究獲我院醫學倫理主管部門批準。

表1 兩組患者一般資料比較
1.2 治療方法
1.2.1觀察組 予以電視胸腔鏡下肺葉切除術。術前行常規化驗檢查(如血常規、尿常規、凝血常規等),所有患者行靜脈吸入復合全身麻醉,留取單肺健側臥位,將患者上肢上懸,并固定于頭架上,予以雙腔氣管插管,確保單肺通氣。常規消毒鋪巾,以腋前線第7或第8肋間間隙,作一長約1.2 cm的切口,以此為觀察孔切口。通過切口置入胸腔鏡,腫物位置明確后于腋前線第4(或3)肋間間隙,作一長約2 cm操作孔。術者以器械經操作孔直至胸內,探查胸腔內情況,可經操作孔將手指伸入,對肺部病變予以觸診,完善病變信息。若術前已明確為肺惡性腫瘤者,則予以肺葉切除術及淋巴結清掃術;若病灶處于肺實質較深位置而難以確診時,予以肺葉切除術,一旦術中冰凍切片示惡性腫瘤,則同步予以淋巴結清掃。術前未明確診斷者,按照探查情況,楔形切除肺部周圍型結節,術中予以冰凍切片處理,一旦結果示良性病變,則術畢;若提示惡性病變,則予以肺葉切除術,并行系統性肺門與縱隔淋巴結清掃術。若予以全腔鏡下手術,原操作孔切口適當延長,直至3~5 cm,以此為主操作孔。同時,于肩胛下線間第7 (或8)肋間間隙作一切口,長約1.5 cm,以此為牽引孔。器械放入后對胸腔內粘連及不全葉裂進行分離,探查腫瘤,遵循先靜脈后動脈的腫瘤切除原則,游離肺靜、動脈各分支,采用切割縫合器或絲線縫扎血管,以支氣管閉合器對支氣管斷端行閉合處理。使用標本袋包好切除的腫瘤,經主操作孔或小切口移走。采用胸腔鏡器械依照次序對縱隔與肺門淋巴結及周圍脂肪組織予以常規清掃。清掃完畢后胸內試水,無誤后置管關胸。若取輔助小切口,則基于原操作孔前提下切口延長,直至6~10 cm,采用撐開器將肋間撐開,在胸腔鏡直視下結合胸腔鏡器械與傳統器械進行操作,肺葉切除原則同上述一致。術后,行鎮痛泵鎮痛,采用抗菌藥物預防感染。
1.2.2 對照組 予以傳統開胸肺葉切除術。麻醉方法與體位選擇同觀察組一致。于后外側第5、6肋間入路,作一切口(15~20 cm)進胸,對粘連及不全葉裂行常規分離。肺血管分支游離后采用絲線縫扎或結扎,使用閉合器閉合支氣管后予以淋巴結清掃,術后留置胸管。術后處理同觀察組一致。
1.3 觀察指標 ①圍手術期相關指標:對比兩組患者切口長度、術中出血量、淋巴結清掃數、手術時間、術后引流量、拔管時間、住院時間、下床活動時間;②肺功能指標:采用德國Jaeger Masterscreen系列肺功能儀(德國Jaeger公司),于術前及術后6個月檢測用力肺活量占預計值百分比(forced vital capacity total predicted value,FVC%)、第1秒用力呼氣容積占預計值百分比(forced expiratory volume in one second total predicted value,FEV1%)、一氧化碳彌散量占預計值百分比(the percent predicted diffusing capacity of the lung for carbon monoxide,DLCO%)。采用美國GEM Premier 3000全自動血氣分析儀(美國實驗儀器有限公司),在術前及術后6個月時于患者安靜狀態下抽取橈動脈血3 mL,待肝素抗凝后即可送檢,記錄動脈血氧分壓(partial pressure of arterial oxygen,PaO2)、動脈血二氧化碳分壓(partial pressure of arterial carbon dioxide,PaCO2);(3)術后并發癥:住院期間,采用心電圖檢查診斷心律失常,采用胸部X線片、CT等檢查肺不張、肺部感染、復張性肺水腫;當引流管引流出乳糜液體診斷為乳糜胸,以肺動脈造影診斷肺動脈栓塞,疑似喉返神經損傷、心力衰竭者均邀請相關科室會診,以專科診斷結果為準。統計兩組患者術后單項并發癥發生率,并對比兩組患者術后并發癥總發生率。
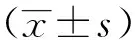
2 結果
2.1 兩組患者圍手術期相關指標比較 兩組患者淋巴結清掃數、拔管時間比較,差異無統計學意義(P>0.05),觀察組切口長度、住院時間、下床活動時間短于對照組差異有統計學意義(P<0.05),術中出血量、術后引流量低于對照組,差異有統計學意義(P<0.05),手術時間長于對照組差異有統計學意義(P<0.05),詳見表2。
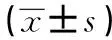
表2 兩組患者圍手術期相關指標比較
2.2 兩組患者手術前后肺功能及血氣指標比較 兩組患者術前肺功能及血氣指標差異均無統計學意義(P>0.05)。兩組患者術后FVC%、FEV1%、DLCO%、PaCO2均低于術前,差異有統計學意義(P<0.05),PaO2高于術前(P<0.05),且觀察組上述指標均高于對照組,差異有統計學意義(P<0.05)。觀察組術前、術后的FVC%、FEV1%、DLCO%、PaCO2差值低于對照組,PaO2差值高于對照組,差異均有統計學意義(P<0.05),詳見表3。
2.3 兩組患者術后并發癥發生情況比較 觀察組患者術后有5例(7.94%)發生并發癥,其中有1例患者合并2種并發癥,另1例合并3種并發癥;對照組患者術后有13例(20.63%)發生并發癥,其中有4例患者合并2種并發癥。觀察組患者術后并發癥發生率低于對照組,差異有統計學意義(χ2=4.148,P=0.042)。但兩組患者心血管系統并發癥、肺不張、肺部感染、喉返神經損傷、肺動脈栓塞、乳糜胸、復張性肺水腫單項并發癥發生率比較,差異均無統計學意義(P>0.05),詳見表4。
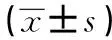
表3 兩組患者手術前后肺功能及血氣指標比較
注:與術前比較,*P<0.05;FVC為用力肺活量占預計值百分比,FEV1為第1秒用力呼氣容積占預計值百分比,DLCO為一氧化碳彌散量占預計值百分比,PaO2為血氧分壓,PaCO2為血二氧化碳分壓

表4 兩組患者術后并發癥發生情況比較[例(%)]
注:*采用校正χ2檢驗;#采用Fisher精確概率檢驗。
3 討論
電視胸腔鏡下肺葉切除作為一種先進微創手術,主要是指采用現代電視攝像技術及高科技器械裝備,完全經胸壁操作孔操作器械,直接觀察屏幕實現肺葉切除,并完成淋巴結清掃,因其具有微創性、可準確定位腫瘤病灶、切口美觀、痛苦少等優點,已逐步在各種胸部疾病治療中得到廣泛應用。目前研究[6]顯示,電視胸腔鏡肺葉切除術治療效果與傳統開胸術式相似,但手術時間及術后并發癥等方面尚存爭議,且有關安全性方面的報道相對較少。
本研究結果顯示,觀察組淋巴結清掃數、拔管時間較對照組差異無統計學意義,但切口長度、住院時間、下床活動時間顯著短于對照組(P<0.05),術中出血量、術后引流量顯著低于對照組(P<0.05),手術時間顯著長于對照組(P<0.05),證實電視胸腔鏡肺葉切除術治療非小細胞肺癌微創優勢優于傳統開胸肺葉切除術。既往研究[7]表示,電視胸腔鏡肺葉切除術術中可獲取與傳統開胸肺葉切除術相同的淋巴清掃清除數量與范圍,這與本研究結論吻合。但Ma等[8]認為,電視胸腔鏡關開胸時間縮短明顯,會造成術中淋巴清掃難度增加,一定程度上延長手術操作時間。但是,術中淋巴結清掃枚數、病灶粘連情況、術者內鏡操作技術也是導致兩者手術時間差異的主要原因。此外,電視胸腔鏡肺葉切除術切口小,切割、分離肌肉組織等操作較少,術中出血少,術中近距離觀察能使手術視野更清晰,操作精細度更高,淋巴結清掃更為徹底,故患者手術創傷更小,術后置管引流時間及下床時間更短,術后恢復較快[9-10]。
本研究結果還顯示,兩組術后FVC%、FEV1%、DLCO%、PaCO2均顯著低于術前(P<0.05),PaO2顯著高于術前,且觀察組術后上述指標及其差值均顯著優于對照組(P<0.05),提示兩種手術對患者肺功能均會產生一定的影響,大多表現為肺活量下降及低氧血癥等方面,其中電視胸腔鏡肺葉切除術改善肺功能效果更好。李滿緒等[11]經研究發現,電視胸腔鏡肺葉切除術與傳統開胸肺葉切除術對Ⅰ~Ⅱ期非小細胞肺癌患者肺功能的影響無明顯差異,與本研究存在一定偏差,可能與其樣本量偏小有關。部分非小細胞肺癌患者可能伴有功能性肺氣腫,肺組織彈性較差,而殘氣量較多,行電視胸腔鏡肺葉切除術將部分肺組織切除,能有效消除肺內殘腔,改善CO2潴留,增加PaO2,促使PaCO2下降[12]。楊欣等[13]也認為,傳統開胸手術會對胸廓完整性造成破壞,而電視胸腔鏡手術對胸腔壁的破壞較為輕微,一定程度上保留了胸廓完整性,避免或減輕呼吸肌、肋間神經過多損傷,這對患者肺功能的恢復具有改善意義。
此外,本研究發現,觀察組術后并發癥總發生率顯著低于對照組(P<0.05),說明電視胸腔鏡下肺葉切除術治療非小細胞肺癌安全性優于傳統開胸肺葉切除術。電視胸腔鏡下肺葉切除術置入胸腔鏡造成的胸壁出血量較小,術后疼痛程度輕微,胸壁創傷小,有利于患者早期實施咳痰,提高呼吸道清潔度,減少術后并發癥的發生,以上均證實其安全性更佳[14]。另有報道[15]稱傳統開胸肺葉切除術由于術中創傷較大,患者術后疼痛明顯,對主動咳嗽存在一定恐懼心理,且術后下床時間延長,因而肺不張、肺部感染等風險顯著增加。兩組術中均有少數患者出現肺不張及復張性肺水腫,肺不張多因胸腔鏡手術所致肺無氣或氣體量減少,引起肺泡萎縮或關閉所致;復張性肺水腫,可能與肺萎陷過度、時間較長及胸腔引流與肺復張速度過快等因素有關,故需盡快完成手術,減少術中膨肺次數,避免術后行高負壓吸引引流;此外,觀察組住院期間出現1例乳糜胸,可能與術中淋巴結清掃時引起胸導管損傷有關。本研究雖證實電視胸腔鏡下肺葉切除治療非小細胞肺癌臨床療效顯著,但選取樣本量受限,可能存在抽樣誤差;觀察時間較短,未對遠期療效進行系統研究,故今后需進一步深入驗證。
綜上,電視胸腔鏡下肺葉切除治療非小細胞肺癌臨床療效顯著,有利于減少并發癥發生的風險,值得臨床積極推廣。

