4種淋巴結分期方法對進展期胃癌根治術后患者預后的評估價值比較
金 榮 何新陽 陳志強 劉成業
胃癌是全球最常見的消化系統惡性腫瘤之一。目前,以胃癌根治術為中心的多學科綜合治療是唯一可能根治的治療方法[1],但進展期胃癌患者術后仍舊存在較高的復發轉移風險,淋巴結轉移是這其中最主要的途徑,因此術后病理中淋巴結轉移情況成為了臨床上評估患者預后的重要依據。在最新版國際抗癌聯盟(UICC)TNM胃癌分期系統和日本胃癌協會(JGCA)的淋巴結分期方法中都以淋巴結轉移數目(pN)作為N分期標準[2-3]。然而,以pN為標準的N分期容易受淋巴結清掃總數的影響,出現分期偏差,為了避免這一影響,近些年來,眾多研究機構紛紛提出了眾多新的N分期方法,如淋巴結轉移率(metastastic lymph nodes ratio,MLR)、陰性淋巴結數(negative lymph node count,NLNC)、陽性淋巴結對數比(log odds of positive lymph nodes,LODDS)等。部分學者認為,上述幾種N分期方法在某些方面要優于pN分期方法,但目前對于孰是最佳的N分期方法仍無定論[4-5]。本文通過回顧分析241例進展期胃癌根治術患者的臨床資料,比較pN、MLR、LODDS、NLNC 4種N分期方法對進展期胃癌根治術后患者預后的評估價值。
1 資料與方法
1.1 一般資料 收集2010年6月至2013年5月在安徽省立醫院接受胃癌根治術治療的241例進展期胃癌患者臨床資料。其中男性183例(75.93%),女性58例(24.07%);年齡22~87歲,平均(61.26±10.51)歲;術后病理顯示:淋巴結清掃數目≤15枚的143例(59.34%),淋巴結清掃數目>15枚的98例(40.66%),平均淋巴結清掃總數(14.52±6.55)枚;陽性淋巴結數為(3.37±4.65)枚。
納入標準:①經術后病理證實為進展期胃癌,同時具有完整的病理資料;②行胃癌根治性R0切除加淋巴結清掃術;③術前胸部X線片、腹部超聲及上腹部CT等檢查無肝、肺、腹盆腔等遠處轉移;④術前無放療或化療。排除標準:①術中見腫瘤腹盆腔或是遠處轉移;②圍手術期內死亡的患者或術后生存時間少于3個月;③病理學診斷治療不全者;④合并其他部位原發腫瘤或死于其他疾病;⑤胃癌復發或殘胃癌。
1.2 方法 將患者按pN分期、MLR分期、NLNC分期及LODDS分期方法分別進行分組,分別比較4種不同淋巴結分期方法組內5年總生存率。使用Kaplan-Merier生存分析進行單因素分析影響患者預后的可能影響因素(性別、年齡、手術方式、腫瘤部位、腫瘤大小、腫瘤浸潤深度、大體分型、分化類型、淋巴結清掃總數),Log-rank比較組間差異。采用Cox比例風險模型分析4種N分期方法與胃癌預后的關系:①構建基礎模型:納入單因素分析中有統計學意義的變量構建多因素Cox模型并得到基礎模型似然比χ2值。②構建特定N分期模型:將4種N分期變量逐一納入基礎模型中構建特定的N分期模型,比較各特定N分期模型似然比變化值△χ2(△χ2=基礎模型χ2-特定N分期模型χ2),△χ2越大則評估胃癌患者預后效果越優。
1.3 淋巴結分期方法 ①pN分期:根據最新版最新版國際抗癌聯盟(UICC)TNM分期[6]將pN分期劃分為:pN0(0)、pN1(1~2枚)、pN2(3~6枚)、pN3a(7~15枚)、pN3b(>15枚)。②MLR分期:MLR=陽性淋巴結數/淋巴結檢查數目,根據馮潤華等制定的標準[7]將MLR分期劃分為MLR0(MLR=0)、MLR1(0
1.4 隨訪 術后通過門診復查、電話隨訪、網絡隨訪等形式對患者開展定期隨訪,術后第1年每3個月1次,術后第2年每半年1次,以后每年1次,并及時記錄患者的生存信息。患者的隨訪終點即記錄的生存時間,是自手術時間至患者死亡時間或隨訪截止時間(術后5年或失訪時間)。
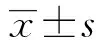
2 結果
2.1 4種N分期方式分組的患者術后5年生存率比較 比較pN分期、MLR分期、NLNC分期及LODDS分期患者術后5年生存率的差異,結果顯示,每種分期方式的組內患者術后5年生存率比較,差異均有統計學意義(P<0.05)。詳見表1,圖1、2。

表1 4種N分期患者術后5年總生存率比較

圖1 2種N分期患者術后5年生存曲線
注:A為pN分期;B為MLR分期

注:C為NLNC分期;D為LODDS分期
2.2 影響患者預后的單因素分析 經Kaplan-Meier單因素分析影響患者預后的可能因素(性別、年齡、手術方式、腫瘤部位、腫瘤大小、腫瘤浸潤深度、大體分型、分化類型、淋巴結清掃總數),結果表明,年齡、手術方式、腫瘤部位、腫瘤大小、腫瘤浸潤深度、大體分型、分化類型、淋巴結清掃總數等是影響胃癌患者預后的關鍵因素。詳見表2。

表2 影響241例進展期胃癌患者預后的單因素分析
2.3 4種N分期方法與胃癌預后的關系及對比 納入年齡、手術方式、腫瘤部位、腫瘤大小、腫瘤浸潤深度、大體分型、分化類型、淋巴結清掃總數等單因素分析中有統計學意義的變量,并且校正性別因素所帶來的影響后構建多因素Cox基礎模型,得到基礎模型的似然比χ2為683.661;將4種N分期方法逐一納入基礎模型分析顯示,對于PN、MLR、LODDS分期,分期越高,患者的死亡風險均逐步增加,差異有統計學意義(P<0.05),而NLNC分期越高,患者的死亡風險逐步減少,pN、MLR、NLNC、LODDS 4種分期的似然比χ2分別為680.122、675.849、668.881、 677.520,對應的似然比△χ2值分別為3.539、7.812、14.780、6.161,可見NLNC分期的△χ2值最大,即NLNC分期方案對于進展期胃癌患者預后的評估價值最優。詳見表3。

表3 4種N分期方法在多因素COX模型中似然比變化值的比較
3 討論
淋巴結轉移是胃癌轉移方式中最常見的一種,有高達70%的進展期胃癌患者存在淋巴結轉移[10],所以胃癌根治術并不僅要做到對腫瘤的R0切除,更要求在切除腫瘤的同時實施淋巴結清掃術。標準的淋巴結清掃術是改善胃癌患者預后的重要手段。目前形成的以腫瘤R0切除和規范化淋巴結清掃術為主要內容的胃癌根治術顯著地提高了患者的5年生存率。規范的淋巴結清掃術固然重要,而準確有效的術后淋巴結分期對于判斷胃癌患者預后及制定進一步的治療方案更是起到關鍵作用。
淋巴結轉移數目(pN)受淋巴結清掃總數的影響,在淋巴結清掃范圍不充分的情況下容易造成“分期偏差”。日本學者更為認可D2根治術或更大范圍的淋巴結清掃,認為這樣可以獲得比D1或D0根治術更好的預后效果[11]。但在有些情況下,受限于外科醫生手術水平和醫療衛生條件,在行胃癌根治術時難以達到標準的D2根治術,這也造成了以pN為依據的淋巴結分期的偏倚現象。為此有學者提出了MLR的概念,在淋巴結清掃范圍不夠的情況下,可以更準確地對患者預后進行評估。
在術后檢測得到的病理資料中,淋巴結檢出數目不僅與外科醫生的清掃范圍有關,也與病理科醫生對標本的檢測水平密不可分,有些不明顯的陽性淋巴結或存在微轉移灶的淋巴結會被遺漏。Cai等[12]的研究證實了清掃淋巴結微轉移灶有助于提高患者的5年生存率。但目前缺少行之有效的方法能夠在術前、術中檢測出微轉移灶,預示就有學者提出通過增加清掃陰性淋巴結的數目來增加對微轉移灶的清掃,從而改善患者預后。Kattan等[13]的研究結果表明:增加陰性淋巴結的清掃數目可以明顯提高患者的5年生存率。此外,相關研究[14-15]結果也表明,NLNC是胃癌預后的重要評價指標。
LODDS分期與其他分期相比,它是陽性淋巴結數(positive lymph node,PLN)與NLNC相互作用所得到的一項評價患者預后的指標。在淋巴結轉移陰性的患者中,pN分期和MLR分期均屬于0組,而LODDS分期會因NLN的不同屬于不同的分組。同樣對于NLNC同組的患者會因清掃PLN的不同而屬于不同分組。
在目前的臨床應用中,由于pN分期的簡便性,并且符合UICC的TNM分期系統和JGCA的胃癌分期法,pN分期在臨床應用中還是首選。本研究對于影響胃癌患者預后的單因素分析結果表明:淋巴結清掃總數>15枚者的預后要優于≤15枚的患者,MLR分期方法則可以在淋巴結清掃總數不足時,能夠很好的彌補pN分期的“分期偏差”。NLNC分期則是在淋巴結檢出數目不足和判斷淋巴結微轉移方面對N分期進行補充。LODDS分期是在pN分期、MLR分期和NLNC分期無法區別其差別時,為臨床提供一個全新的N分期方法,但因其計算較為復雜,目前在臨床上還無法進行大范圍的推廣應用。
綜上所述,與傳統的pN分期相比,MLR、NLNC、LODDS 3種分期方法分別具有其獨特的優勢,在一定程度上彌補了pN分期的不足,而本研究結果表明,以上4種N分期方案對于胃癌根治術后患者的預后評估都是有其自身價值的,pN分期對預后的評判效果要低于其他3種方法,這其中NLNC方案效果最優,可為我們臨床的淋巴結病理分期提供參考。

