頑固性咯血患者肺葉切除術前行動脈栓塞介入治療的價值
朱建坤 劉大偉 金鋒 趙彬 王成 張運曾 喬高鋒 楊秀珍
咯血為臨床常見的急癥,原因以肺結核、支氣管擴張、肺癌及曲菌感染等多見[1]。雖然選擇性支氣管動脈栓塞術(bronchial artery embolization,BAE)在咯血治療上廣泛應用并取得很好療效,但仍有約10%~20%的患者咯血不能控制[2-4]。手術可以通過清除感染病灶、切除腫瘤及毀損肺葉等方式,達到徹底止血的目的;但同時存在操作困難、術中出血多、并發癥發生率高等風險。我院自2013年始,對頑固性咯血患者在肺葉切除術術前先采用數字減影血管造影(DSA)引導下超選擇性經導管動脈栓塞介入治療(簡稱“介入栓塞治療”),2~3 d后行肺葉切除的方式治療20例患者,獲得滿意療效,總結報告如下。
資料和方法
一、臨床資料
搜集我院自 2013年1月至2018年1月收住的因頑固性咯血入院而施行肺葉切除的患者共45例,其中男32例,女13例;平均年齡(45.0±6.7)歲;病史9個月至15年,平均7.8±1.9年;曾行BAE治療42例。原發疾病:肺結核性毀損15例,支氣管擴張17例,肺空洞并曲菌球8例,肺結核并發膿胸5例。少量咯血30例,中量咯血11例,大量咯血4例。
二、方法

結 果
觀察組20例患者均有病理性非支氣管性體動脈(NBSA)側支循環形成。DSA 檢查發現出血責任血管共 57支,其中支氣管動脈(BA)12支,NBSA側支循環 42支,肺動脈(PA) 3支。結核性毀損肺7例,肺空洞并發曲菌球4例,NBSA側支循環以肋間動脈(11支)、鎖骨下動脈(11支)及腋下動脈(7支)為主;支氣管擴張9例,NBSA側支循環以食管固有動脈(9支)、膈下動脈(4支)為主。栓塞后即刻止血13例,咯血減少7例(表1)。
研究組中行肺葉切除9例,行肺葉切除加胸膜剝脫6例,全肺葉切除5例;對照組行肺葉切除13例,行肺葉切除加胸膜剝脫5例,全肺葉切除7例,均恢復良好。研究組術中出血量平均為(600±155) ml,對照組術中出血量平均為(850±210) ml;研究組手術時間平均為(150±35) min,對照組手術時間平均為(180±40) min;兩組間術中出血量與手術時間比較,差異均有統計學意義(表2)。
討 論
頑固性咯血是指咯血反復發作1年以上,大咯血發生1次以上并經過積極治療再次反復發生者[2]。BAE為治療急性大咯血的有效手段,但由于支氣管擴張,以及肺結核及肺腫瘤等基礎病變的進展、NBSA參與供血及側支循環形成等原因,咯血復發率高達10.9%~41.8%[5-6]。有研究報道,當胸膜厚度達3 mm或胸膜下病灶長期炎癥刺激,NBSA側支循環血管成為咯血的責任血管[7]。本研究觀察組患者術前DSA檢查發現,20例全部有病理性NBSA側支循環形成,為咯血的主要責任血管或共同責任血管。其中,結核性毀損肺及肺空洞并發曲菌球11例患者以肋間動脈、鎖骨下動脈及腋下動脈為主,與其上述病灶位于鄰近后上胸膜的上葉尖后段和下葉背段、并有相鄰胸膜肥厚有關;支氣管擴張9例,病理性NBSA側支循環以食管固有動脈、膈下動脈為主,與病灶位于鄰近縱隔、膈胸膜的中葉、舌段及下葉基底段有關。本組患者入院前均有行BAE止血的手術史,此次肺葉切除術術前行介入栓塞治療,即刻止血率為65.0%(13/20),另外7例咯血減輕;低于文獻報道采用BAE后的77%~98%的即刻止血率[5]。原因與肺毀損使得責任血管代償、增生形成復雜血管網,行姑息性近端栓塞療效不佳,以及由腫瘤、感染引起的彌散性出血,對血管的末梢栓塞效果差等因素有關。由于原發病灶的存在,咯血復發在所難免,故經導管動脈栓塞介入治療僅能減輕患者咯血癥狀,為患者贏得進一步治療時機,但不能完全代替外科手術。

表1 觀察組20例介入栓塞治療患者責任血管分布及栓塞效果
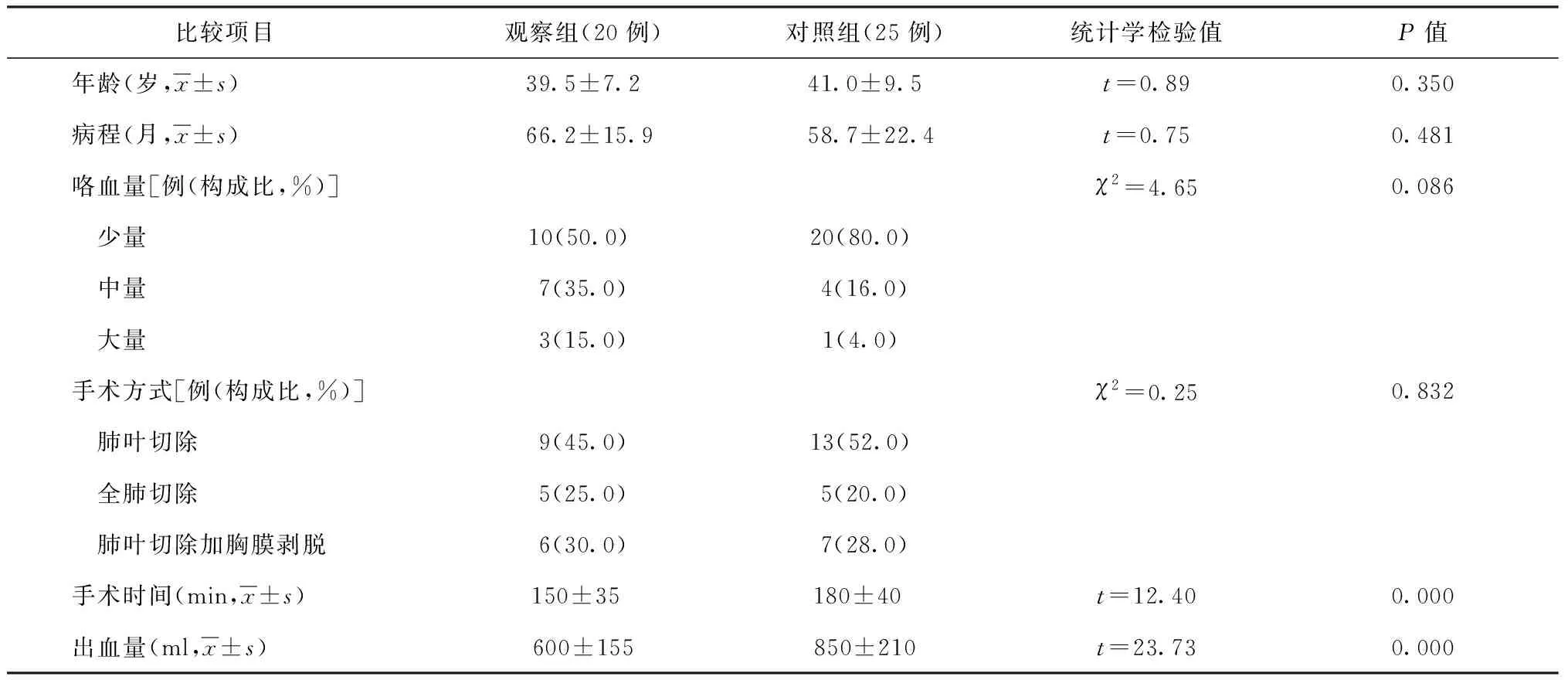
表2 不同比較項目在觀察組與對照組患者中的統計與分析對比
纖維支氣管鏡檢查被認為是確定出血部位的金標準[8],可在直視下看到出血肺葉、肺段開口或出血點;但對于毀損肺及長期慢性感染的支氣管擴張患者,肺組織硬化、固縮等,或肺段、肺裂發育不全、支氣管的變形等因素將影響手術部位的確定,尤其是支氣管擴張病變可累及多個肺葉,切除不全易再發咯血。于大平和段勇[9]報道53例因大咯血行急診肺切除的肺結核并發支氣管擴張的患者,有7例不能完全切除擴張部位,其中1例再發大咯血而死亡,另6例出現少量咯血而再次行BAE治療后好轉。術前行DSA檢查可顯示出血責任血管,聯合纖維支氣管鏡檢查將更有助于病變部位的確定及手術方式的選擇。另外,隱源性咯血在臨床發生率約為7%~25%[10],即雖將病變肺組織切除仍有咯血癥狀、甚至有加重的情況,要求臨床醫師必須在術前行DSA檢查,以排除隱源性咯血的存在。
咯血患者行急診手術因其危險性高、并發癥多[11],使得眾多外科醫生心存顧忌。毀損肺則往往與上縱隔增厚的壁層胸膜粘連緊密,使得鎖骨下血管、無名靜脈與肺組織的解剖關系不清,強行分離會導致難以控制的出血及組織損傷。尤其是長期的慢性炎癥刺激導致粘連處產生廣泛的血管增生、側支循環形成,分離粘連時會導致出血增加及術后滲血增多。術前行DSA檢查可全面了解出血責任血管,通過顯示血管走行及出血部位,對出血及高危血管予以栓塞,可為后期手術創造良好的手術條件。賀繼剛等[12]曾提出,對病變與胸壁嚴重粘連,并已經形成側支循環者,應用阻斷肋間動脈以按需控制胸廓區域的血流,再切除胸內嚴重粘連病變獲得成功;但由于術前未做DSA檢查,不能提供客觀的影像學依據。目前,胸部CT血管造影(CTA)被廣泛應用,有助于發現肺外體循環供血支對肺內病變的供血。徐旭東等[13]報道,對結核性毀損肺患者行胸膜全肺切除術前應用DSA引導下經導管動脈栓塞術,然后行胸膜全肺切除術的術中、術后出血量為(810±125) ml,平均輸血400 ml,明顯少于對照組。同時手術時間由平均(143±62) min降至(105±45) min,認為術前栓塞可明顯減少術中出血,操作相對便捷。本研究觀察組患者的手術出血量平均為(600±155) ml,對照組術中出血量平均為(850±210) ml;觀察組手術時間平均為(150±35) min,對照組手術時間平均為 (180±40) min;平均手術出血量、手術時間兩組間比較,差異均有統計學意義,與文獻報道相似;進一步證實了肺葉切除術前行介入栓塞治療在控制術中出血及縮短手術時間方面的有效性。筆者認為,介入栓塞治療后行肺葉切除的時機以2~3 d 為宜,此時病灶側支循環尚未建立、患者臨床癥狀改善,故可較好地耐受手術。
肺葉切除術術前行介入栓塞治療相對增加了患者費用,并具有脊髓缺血、腹腔器官血管梗塞等風險[14]。但是,由于其一方面能控制咯血為患者贏得進一步治療的寶貴時間;另一方面有助于明確手術部位、確定手術方式,并能控制術中出血、降低手術風險等;綜合考慮,總體上利大于弊。本研究由于樣本量較少,所以尚需進行大樣本、多中心研究,以進一步證實上述觀點。

