QuEChERS-HPLC-MS/MS法分析丙硫菌唑及其代謝物在小麥和土壤中的殘留
孫 星,閆小龍,楊邦保,丁 悅,余向陽*
(農業農村部農產品質量安全控制技術與標準重點實驗室,農業農村部農產品質量安全風險評估實驗室(南京),江蘇 南京 210014)
丙硫菌唑是一種新型廣譜三唑硫酮類殺菌劑,由拜耳公司開發[1],主要用于防治由子囊菌、擔子菌以及半知菌引起的病害[2],其作用機理是抑制真菌中甾醇的前體——羊毛甾醇或2,4-亞甲基二氫羊毛甾醇14位上的脫甲基化作用,即脫甲基化抑制劑[3]。丙硫菌唑具有毒性低、無致畸、致突變性、對胚胎無毒性、對人和環境安全等特點,具有很好的內吸活性,可以優異的保護、治療和根除活性,并且持效期長,具有廣譜的殺菌活性[4-5]。2004年上市以來,丙硫菌唑在谷類、麥類、豆類農產品中廣泛應用,幾乎對麥類所有病害,均有很好的防效[6-7]。丙硫菌唑在作物和土壤中的主要代謝物為其脫硫產物硫酮菌唑[8]。目前關于丙硫菌唑的研究主要集中在毒力測定[9-10]、合成工藝[4-5,11-13]、田間防治效果[7,14]及含量檢測分析[15-18]、土壤中的殘留消解及轉化研究以及對其在土壤中的降解規律進行闡述[8]。鮮見丙硫菌唑在小麥中殘留以及降解動態的報道。本實驗采用QuEChERS樣品前處理方法結合高效液相色譜-串聯質譜(high performance liquid chromatography-tandem mass spectrometry,HPLCMS/MS)檢測技術,研究丙硫菌唑及其代謝物在小麥和土壤中的殘留降解動態和最終殘留量,為丙硫菌唑在小麥上的施用劑量和安全間隔期提供科學依據。
1 材料與方法
1.1 材料與試劑
98.5 %丙硫菌唑標準品、99%硫酮菌唑標準品 德國Dr. Ehrenstorfer公司;乙腈(分析純) 天津科密歐化學試劑有限公司;甲醇(色譜級) 德國默克化工技術有限公司;十八烷基鍵合硅膠吸附劑(C18) 上海安譜實驗科技股份有限公司;40%丙硫·戊唑醇懸浮劑(其中丙硫菌唑含量為20%) 溧陽中南化工有限公司。
1.2 儀器與設備
1290-6470A液相色譜-串聯質譜儀 美國Agilent公司;R10.v.v食品切碎攪拌機 法國Robot Coupe公司;QL-901渦流混合器 江蘇海門市麒麟醫用儀器廠;Talboys數顯型多管式旋渦混合器 上海安譜實驗科技股份有限公司;AL204十萬分之一電子天平 梅特勒-托利多儀器(上海)有限公司;JJ-200百分之一電子天平常州雙杰電子有限公司。
1.3 方法
1.3.1 田間試驗設計
40%丙硫·戊唑醇懸浮劑在小麥植株和土壤中降解動態和最終殘留試驗按NY/T 788—2004《農藥殘留試驗準則》執行[19],設有空白對照區、低劑量處理區、高劑量處理區和消解動態處理區。降解動態試驗:分別與小麥試驗地及空白土壤地均勻施藥。施藥劑量為制劑量75 g/667 m2(450 g a.i./hm2),施藥后2 h,1、3、7、10、14、21、30 d采樣。植株樣本的采集:隨機在試驗小區內剪取地表以上的全株(去根)1 kg,切碎、混勻后采用四分法留樣500 g,裝入樣本容器中,黏好標簽,備用。土壤樣本的采集:隨機取點5~10 個,用土鉆采集0~10 cm的土壤2 kg,除去土壤中的碎石、雜草和植物根莖等雜物,在盆中混合均勻后采用四分法留樣500 g,裝入樣本容器中,黏好標簽,備用。最終殘留試驗:分別設50 g/667 m2(300 g a.i./hm2)與75 g/667 m2(450 g a.i./hm2)低高2 個施藥劑量,施藥2~3 次,施藥間隔期7 d。距離最后1 次施藥的間隔時間28、35、42 d采樣。植株樣本采集:用隨機方式在試驗小區中剪取土表以上的全株1 kg,切碎、混勻后采用四分法留樣500 g,裝入樣本容器中包扎妥當,黏好標簽,備用。小麥籽粒樣本采集:用隨機方式在小區中剪取稻穗2 kg,裝入樣本袋中包扎妥當,黏好標簽,備用。土壤樣本采集:隨機取點5~10 個,采用土鉆采集0~15 cm的土壤1~2 kg,除去土壤中的碎石、雜草和植物根莖等雜物,裝入樣本容器中包扎妥當,黏好標簽,備用。
1.3.2 樣品提取凈化
稱取5.0 g樣品于50 mL離心管中,加20 mL乙腈,數顯型多管式旋渦混合器振蕩20 min,經5 000 r/min離心,取1 mL上清液轉移至5 mL離心管中,氮吹至干,2 mL色譜甲醇定容,加入100 mg無水硫酸鎂和50 mg C18填料,旋渦振蕩,5 000 r/min離心,取上清液于進樣瓶中待測。
1.3.3 HPLC-MS/MS檢測條件
色譜條件:Agilent ZORBAX Eclipse Plus C18色譜柱(2.1 mm×50 mm,1.8 μm);柱溫35 ℃;進樣體積2.0 μL;流動相及洗脫程序見表1。

表1 流動相梯度洗脫條件Table 1 Eluent gradient conditions
質譜條件:電噴霧離子源;多反應監測正負離子掃描;毛細管電壓3 500 V;干燥氣溫度300 ℃;干燥氣流速6 L/min;噴霧器壓力25 psi;鞘流氣溫度250 ℃;鞘流氣流速5 L/min;采集參數見表2。

表2 丙硫菌唑及脫硫代謝物硫酮菌唑的質譜參數Table 2 MS parameters for determination of prothioconazole and prothioconazole-desthio
HPLC-MS/MS測定采用標準曲線法定量,組分含量按公式(1)計算:

式中:Xi為試樣中北側組分含量/(mg/kg);Ci為從標準工作曲線得到的試樣溶液中被測組分的質量濃度/(mg/L);M為被測樣品質量/g;Vm為試樣提取液的總體積/mL;V1為試樣移取提取液的體積/mL;V2為試樣定容體積/mL。
1.3.4 降解半衰期的計算
丙硫菌唑及硫酮菌唑消解反應動力學方程按公式(2)計算,降解半衰期按公式(3)計算[20]:

式中:Ct為t時刻丙硫菌唑及硫酮菌唑的殘留含量/(mg/kg);C0為丙硫菌唑及硫酮菌唑的初始質量濃度/(mg/L);k為降解速率常數/d-1;t1/2為降解半衰期/d。
2 結果與分析
2.1 HPLC-MS/MS條件優化
采用甲醇與水的梯度洗脫為HPLC-MS/MS的流動相,正負離子掃描反應離子監測模式檢測丙硫菌唑與硫酮菌唑,保證丙硫菌唑與硫酮菌唑有較高的靈敏度和準確度。進入一級質譜后,在正離子檢測方式下,硫酮菌唑產生穩定的[M+H]+分子離子峰,即m/z 312.1;在負離子檢測方式下,丙硫菌唑產生穩定的[M-H]-準分子離子峰,即m/z 342.0。進行二級質譜掃描,得到硫酮菌唑的特征碎片離子為m/z 70.1和m/z 124.9;丙硫菌唑的特征碎片離子為m/z 99.9和m/z 125.0。分別選取m/z 70.1和m/z 99.9為硫酮菌唑和丙硫菌唑的定量離子,m/z 124.9和m/z 125.0為硫酮菌唑和丙硫菌唑的定性離子。
2.2 前處理方法優化

圖1 4 種凈化方式下丙硫菌唑(A)及硫酮菌唑(B)在小麥籽粒、小麥植株及土壤中的回收率情況Fig. 1 Recoveries of prothioconazole (A) and prothioconazole-desthio (B)in wheat grains, wheat straw and soil with four purification methods
乙腈是農藥殘留檢測方面常用提取溶劑,難以提取農作物中糖、蛋白質類化合物,對絕大多數農藥有較高的回收率[21],因此選擇乙腈作為本實驗提取試劑,以確保目標化合物的有效提取并使提取液中的干擾物較少,本實驗借鑒QuEChERS凈化方法[22-29],比較了PSA、NH2、C18及GCB 4 種填料在凈化上的效果,如圖1所示,PSA、NH2及GCB填料雖然除雜效果好,但對丙硫菌唑吸附明顯,影響回收率,C18除雜效果稍弱,但不影響回收率。為保持良好的添加回收率,綜合考慮本實驗使用100 mg無水硫酸鎂和50 mg C18作為QuEChERS處理的吸附劑。
2.3 方法驗證
2.3.1 線性范圍及檢出限結果
使用空白溶劑,配制標準工作溶液1、2、5、10、20、50、100 μg/L和200 μg/L,在1.3.3節液相色譜-質譜條件下測定,以丙硫菌唑和硫酮菌唑標準溶液的質量濃度為橫坐標,峰面積為縱坐標,繪制標準工作曲線。其中,丙硫菌唑線性回歸方程為y=83 815x-17.443,r2=0.996 8;硫酮菌唑線性回歸方程為y=94 182x-6.143 3,r2=0.999 8。峰面積與溶液質量濃度呈良好的線性關系。以3 倍信噪比為儀器檢出限,丙硫菌唑及其代謝物的檢出限均為2×10-3ng。
2.3.2 方法準確度、精密度和靈敏度測定結果
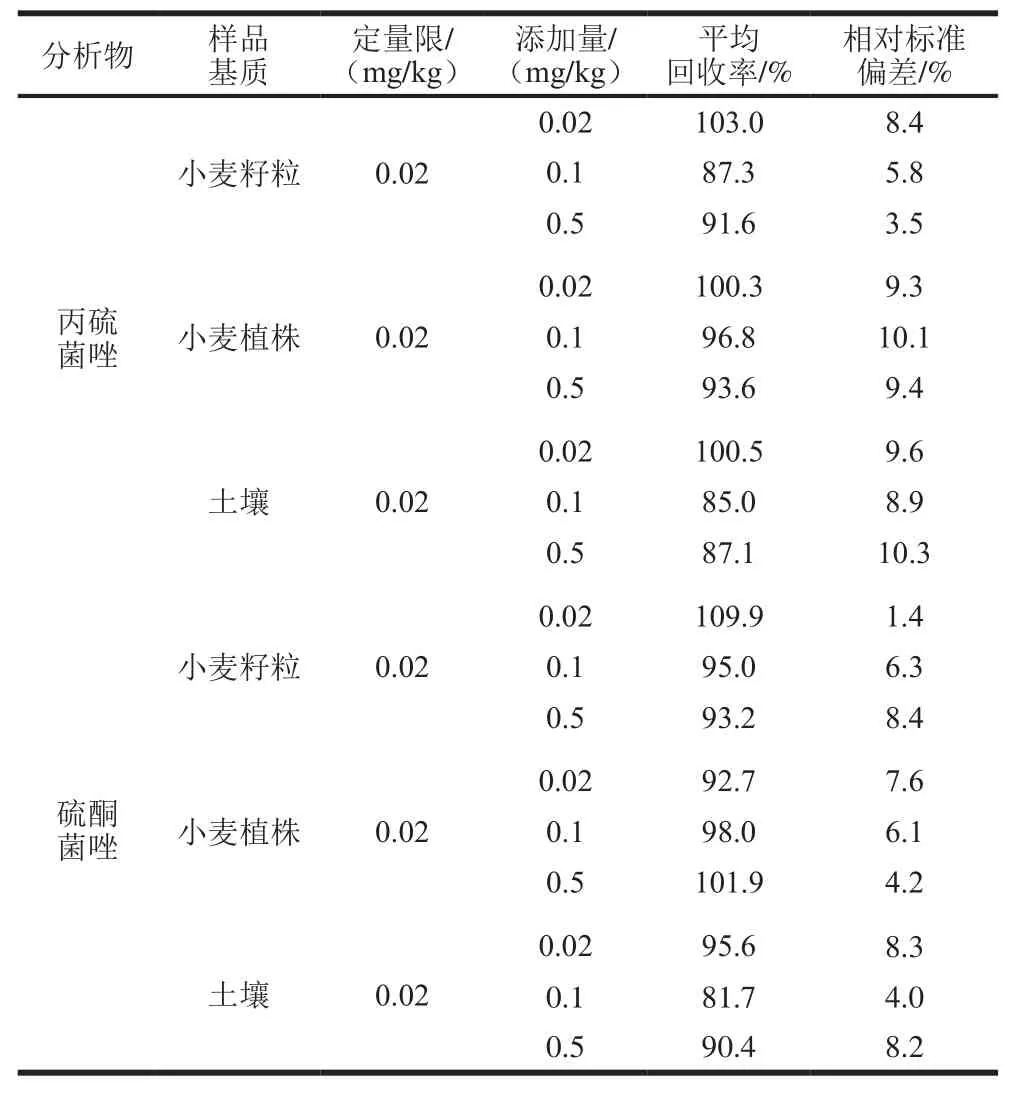
表3 丙硫菌唑及硫酮菌唑在小麥籽粒、小麥植株及土壤中的添加回收率和相對標準偏差(n=5)Table 3 Recoveries and relative standard deviations (RSDs) for prothioconazole and prothioconazole-desthio in wheat grains, wheat straw and soil (n= 5)
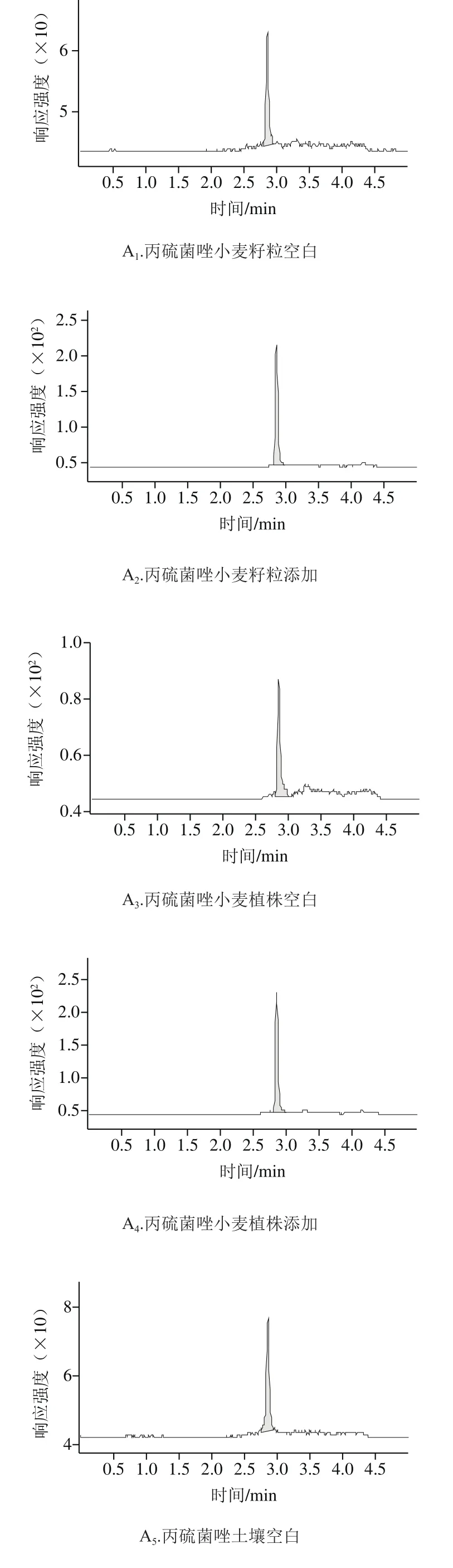
如表3所示,在0.02、0.1 mg/kg和0.5 mg/kg 3 個添加水平下,丙硫菌唑在小麥籽粒、小麥植株和土壤中回收率分別為87.3%~103.0%、93.6%~100.3%和85.0%~100.5%,相對標準偏差分別為3.5%~8.4%、9.3%~10.1%和8.9%~10.3%;硫酮菌唑在小麥籽粒、小麥植株和土壤中回收率分別為93.2%~109.9%、92.7%~101.9%和81.7%~95.6%,相對標準偏差分別為1.4%~8.4%、4.2%~7.6%和4.0%~8.3%。各樣本的添加回收率和變異系數在允許范圍內,符合NY/T 788—2004的要求。空白添加典型圖譜見圖2。


圖2 丙硫菌唑及硫酮菌唑在小麥籽粒、小麥植株及土壤中的空白與添加回收樣品HPLC-MS/MS圖Fig. 2 HPLC-MS/MS pro fi les of prothioconazole and prothioconazoledesthio in wheat grains, wheat straw and soil
2.4 丙硫菌唑及其代謝物硫酮菌唑消解動態結果


圖3 丙硫菌唑及硫酮菌唑在小麥植株(A)及土壤(B)的消解動態曲線Fig. 3 Dynamic curves of prothioconazole and prothioconazole-desthio residue in wheat straw (A) and soil (B)
江蘇、河南和北京三地中丙硫菌唑在植株的原始沉積量分別為0.182、0.148 mg/kg和0.142 mg/kg,在土壤中的原始沉積量分別為0.086、0.025 mg/kg和0.044 mg/kg,其殘留量與施藥后間隔時間呈指數關系,降解動態符合一級動力學方程回歸曲線。如圖3所示,植株消解動力學方程:江蘇試驗點為Ct=0.184 7e-0.159t,R2=0.999 0,半衰期t1/2=4.4 d;河南試驗點為Ct=0.123 7e-0.395t,R2=0.824 2,半衰期t1/2=1.8 d;北京試驗點為Ct=0.202 6e-0.211t,R2=0.872 6,半衰期t1/2=3.3 d。河南土壤中殘留量的檢出值少于3 個,未作回歸曲線;江蘇和北京土壤中消解動力學方程:江蘇試驗點為Ct=0.044 7e-0.037t,R2=0.555 1,半衰期t1/2=18.7 d;北京試驗點為Ct=0.079 8e-0.050t,R2=0.740 1,半衰期t1/2=13.9 d。
江蘇、河南和北京三地中硫酮菌唑在植株的原始沉積量分別為0.599、0.361 mg/kg和0.566 mg/kg,在土壤中的原始沉積量分別為0.041、0.014 mg/kg和0.013 mg/kg,植株中殘留量與施藥后間隔時間呈指數關系,降解動態符合一級動力學方程回歸曲線。如圖3B2所示,土壤中殘留量與施藥后間隔時間不呈指數關系,這可能與土壤環境更復雜有關,未作回歸曲線。植株消解動力學方程:江蘇試驗點為Ct=0.438 6e-0.111t,R2=0.709 2,半衰期t1/2=6.2 d;河南試驗點為Ct=0.484 4e-0.236t,R2=0.934 2,半衰期t1/2=2.9 d;北京試驗點為Ct=0.365 1e-0.115t,R2=0.738 1,半衰期t1/2=6.0 d。
2.5 丙硫菌唑及其代謝物硫酮菌唑最終殘留測定結果
如表4所示,小麥收獲時采收,在一年三地小麥籽粒樣品中均未檢出丙硫菌唑和硫酮菌唑的殘留,丙硫菌唑在小麥植株中殘留量為<0.02~0.225 mg/kg,在土壤中殘留量為<0.02~0.033 mg/kg;硫酮菌唑在小麥植株中殘留量為<0.02~0.282 mg/kg,在土壤中殘留量為<0.02~0.049 mg/kg。
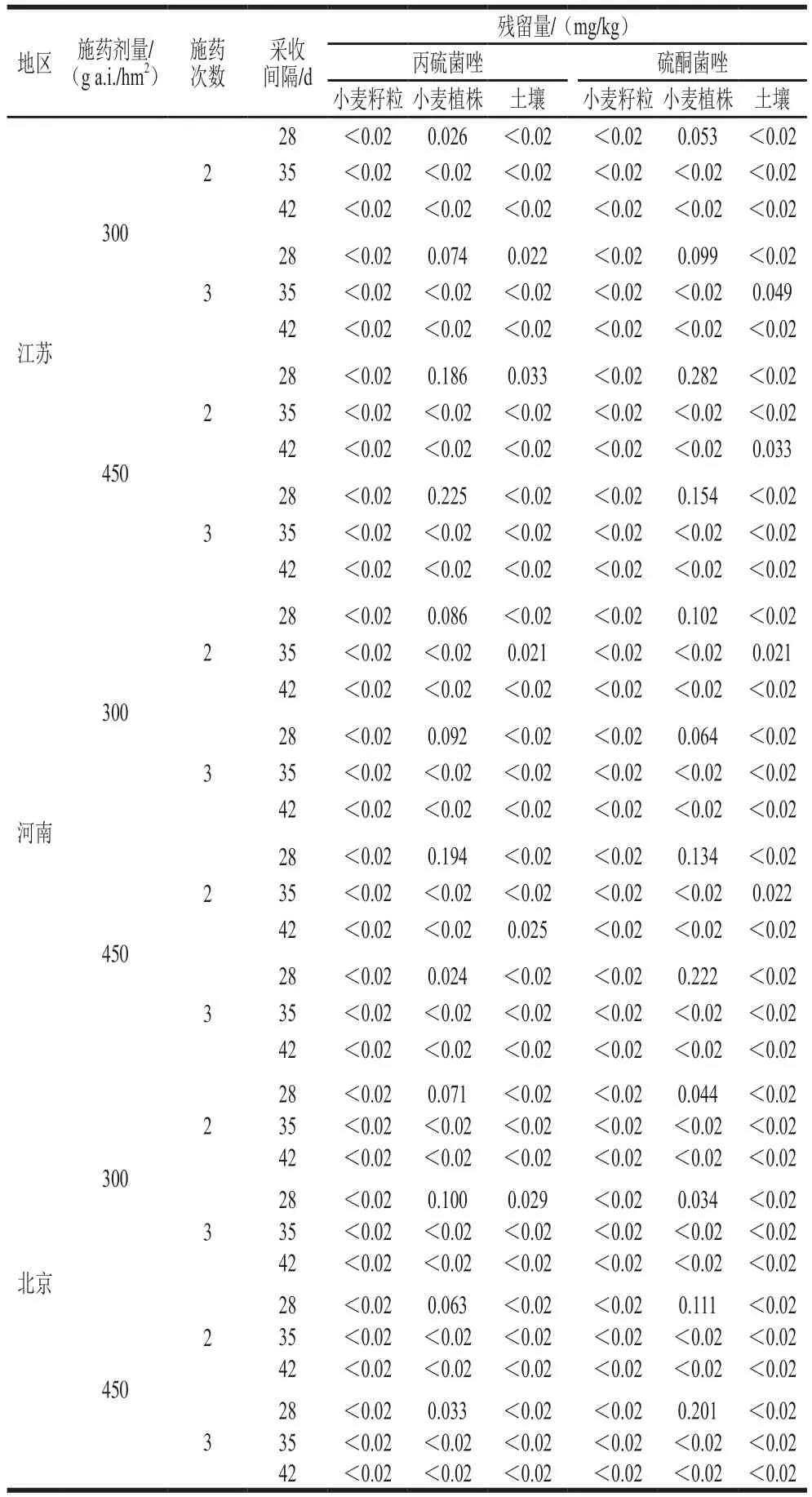
表4 丙硫菌唑及硫酮菌唑在小麥籽粒、小麥植株及土壤中的殘留量Table 4 Residues of prothioconazole and prothioconazole-desthio in wheat grains, wheat straw and soil
3 討 論
本研究采用QuEChERS前處理方法結合HPLC-MS/MS檢測技術,定性、定量研究丙硫菌唑及其代謝物硫酮菌唑在小麥籽粒、小麥植株和土壤中的殘留降解動態和最終殘留量。研究結果發現河南地區丙硫菌唑與硫酮菌唑的半衰期低于江蘇和北京兩地,江蘇和北京這兩地在2016年平均日照時間約為250 h,而河南地區2016年的平均日照時間在350 h以上,這可能是隨著日照時間的延長從而加速了丙硫菌唑與硫酮菌唑的降解。植株動態樣品中丙硫菌唑的原始沉積量均小于硫酮菌唑的原始沉積量,丙硫菌唑的半衰期比硫酮菌唑半衰期短。相同間隔期的終殘樣品中丙硫菌唑檢出值均小于硫酮菌唑的檢出值,說明在自然環境中丙硫菌唑很快轉化為硫酮菌唑。GB 2763—2016《食品中農藥最大殘留限量》[30]中丙硫菌唑的殘留定義為丙硫菌唑脫硫代謝物(硫酮菌唑),以丙硫菌唑計,小麥中的臨時限量標準為0.1 mg/kg;食品法典委員會中丙硫菌唑的殘留定義為硫酮菌唑。現有定義中均未涉及丙硫菌唑的殘留,本實驗同時研究丙硫菌唑和硫酮菌唑的消解趨勢,結果表明,丙硫菌唑很快轉化為硫酮菌唑,硫酮菌唑殘效期長于丙硫菌唑殘效期。在三地的小麥籽粒中丙硫菌唑及其代謝物硫酮菌唑均未檢出,但植株中硫酮菌唑檢出值均高于丙硫菌唑,因此,與丙硫菌唑相比,硫酮菌唑在小麥中的殘留量更需引起人們的關注。
4 結 論
丙硫菌唑在小麥植株和土壤中降解動態符合一級動力學指數模型,硫酮菌唑在小麥植株中降解動態符合一級動力學指數模型,土壤中降解動態不符合一級動力學指數模型。丙硫菌唑在小麥植株中半衰期為1.8~4.4 d,土壤中的半衰期分別為13.9~18.7 d;硫酮菌唑在小麥植株中半衰期為2.9~6.2 d。40%丙硫·戊唑醇懸浮劑以300 g a.i./hm2推薦劑量及450 g a.i./hm2劑量施藥時,丙硫菌唑及其代謝物硫酮菌唑在小麥籽粒中均未檢出。表明在推薦使用劑量條件下,在小麥上施用丙硫菌唑是安全的。

