貽貝鹽溶蛋白特性分析及其ACE抑制肽的酶法制備
喬美玲,劉漢雄,樊鳳嬌,涂茂林,于翠平,杜 明,*
(1.大連工業大學食品學院,國家海洋食品工程技術研究中心,遼寧 大連 116034;2.哈爾濱工業大學化工與化學學院,黑龍江 哈爾濱 150001)
貽貝(Mytilus)屬軟體動物門,瓣鰓綱,異柱目,貽貝族,貽貝科,俗稱“海紅”(北方)、“淡菜”(干品)等,其肉質鮮美,營養豐富,素有“海中雞蛋”的美稱,是人們喜愛的海產貝類,也是我國沿海常見的一種海鮮產品,在我國山東、浙江、遼寧和福建等沿海省份養殖海域廣闊,主要品種為紫貽貝(M. edulis)和厚殼貽貝(M. crassitesta Lischke)。養殖貽貝生長快,純天然,無污染,品質好,產量大[1]。根據2016年和2017年檢數據表明,貽貝的產量在2015年和2016年分別為84.5萬 t和87.9萬 t。目前,貽貝加工除了少量加工成凍品、罐頭和干品外,大都以活鮮品銷售,產品較為單一,嚴重影響了貽貝資源的高效利用。近年來,研究人員對海洋生物尤其是貝類活性成分的研究已取得一定成果,加工企業也利用這些研究成果成功開發出相應的海洋功能食品,如牛磺酸[2]、蛋白功能食品[3]、海洋多糖[4]和多不飽和脂肪酸[5]等產品,并獲得了相當好的經濟效益。我國現有的相關研究主要集中在貽貝的形態、分類、初級加工和捕撈養殖等方面,國外則主要集中在貽貝的毒素[6]等方面,鮮有報道關于貽貝鹽溶性蛋白酶酶解產物的血管緊張素轉化酶(angiotensin converting enzyme,ACE)抑制活性的研究[7]。因此,本研究以貽貝為原料,提取貽貝的鹽溶性蛋白,并對其分子質量分布、粒度分布和熱變溫度進行分析,通過3 種蛋白酶酶解蛋白,評價酶解產物的ACE抑制活性。用質譜鑒定多肽的氨基酸序列,結合分子對接技術中打分分數、關鍵氨基酸作用位點和氫鍵等相互作用篩選抑制活性最高的多肽,探討其發揮活性的機理,從而為充分利用貽貝資源,開發具有ACE抑制活性的貽貝多肽提供理論依據。
1 材料與方法
1.1 材料與試劑
貽貝采購于遼寧省大連市新長興市場,活體運輸至實驗室。
ACE、胰酶、三氟乙酸(均為色譜純) 西格瑪奧德里奇貿易有限公司;胰蛋白酶 美國Ameresco生物試劑公司;中性蛋白酶 北京索萊寶科技有限公司;乙腈、甲醇 美國Spectrum化學試劑公司;甲酸 阿拉丁試劑有限公司;其他試劑均為分析純。
1.2 儀器與設備
T25勻漿機 艾卡儀器設備有限公司;CF16RXII離心機 日立有限公司;5KDN-103F自動定氮儀、二十孔消化爐 上海纖檢儀器有限公司;DF-101S集熱式恒溫加熱磁力攪拌器 鞏義市予華儀器有限公司;BSA1245萬分之一天平 賽多利斯科學儀器有限公司;μ-DSC微量熱儀 法國塞塔拉姆儀器公司;1260高效液相色譜儀安捷倫科技有限公司;HSE-12B固相萃取儀 天津市恒奧科技發展有限公司;TTL-DC型多功能氮吹儀 北京同泰聯科技發展有限公司;IMPCT反向高效液相超高解析度四極桿-飛行時間串聯質譜儀 布魯克科技有限公司;Zetasizer 3000HSA激光粒度儀 英國Malvern儀器公司。
1.3 方法
1.3.1 貽貝鹽溶性蛋白的制備
將新鮮的貽貝洗凈,剝殼,去足絲。瀝干多余水分,剪碎,8 000 r/min勻漿。按照料液比1∶3(g/mL)加入0.05 mol/L pH 7的磷酸緩沖溶液,于4 ℃磁力攪拌30 min,8 000 r/min離心去除上清液,重復2 次,沉淀物按照料液比1∶3加入0.1 mol/L pH 7的含有2 mol/L NaCl的磷酸鹽緩沖溶液,8 000 r/min離心得到的上清液即為貽貝鹽溶性蛋白[8-10]。
1.3.2 貽貝鹽溶性蛋白的特性分析
參考GB 5009.5—2010《食品中蛋白質的測定》第1法測定粗蛋白含量;十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electropheresis,SDS-PAGE)測定蛋白分子質量分布;激光粒度儀測定蛋白粒度分布;μ-DSC微量熱儀測定蛋白熱變性溫度。
1.3.3 貽貝鹽溶性蛋白酶解液的制備
分別采用胰蛋白酶、中性蛋白酶和胰酶對貽貝鹽溶性蛋白進行酶解。參考文獻[11-13]并適當修改,確定條件分別為:溫度45 ℃,pH 8.5,時間3 h,2 g/100 mL蛋白溶液;溫度50 ℃,pH 7.0,時間4 h,2 g/100 mL蛋白溶液;溫度40 ℃,pH 8.0,時間4 h,2 g/100 mL蛋白溶液;待pH值、溫度條件到達后,按照5 000 U/g加入相應的酶,分別進行酶解。沸水浴15 min滅酶,冷卻至室溫后,8 000 r/min離心取上清液,真空冷凍干燥制備得到酶解多肽粉。酶解液的分子質量分布測定采用孫娜等[14]的方法。
1.3.4 貽貝鹽溶性蛋白酶解液ACE抑制活性測定
貽貝多肽ACE抑制率的測定參考賈夢蛟等[15]的方法,并作適當修改。取50 μL 5 mmol/L馬尿酰-組氨酰-亮氨酸(HHL)與20 μL的樣品混合,于37 ℃恒溫水浴5 min,加入20 μL 0.1 U/mL ACE溶液,充分混合,37 ℃恒溫水浴60 min后,反應分解產生馬尿酸,加入20 μL 2 mol/L HCl溶液中止反應,離心取上清液,加入進樣瓶中,波長228 nm處進行檢測。樣品用pH 8.3、含0.3 mol/L NaCl的硼酸鹽緩沖溶液配制成6 種不同的質量濃度,測定活性半抑制濃度(IC50),空白為硼酸緩沖溶液。繪制濃度-抑制率曲線,得到回歸方程,通過曲線方程計算抑制率為50%時所對應的濃度值,即IC50值[16]。ACE抑制率計算如下所示:

1.3.5 酶解液多肽的前處理及質譜鑒定
酶解液通過C18小柱除去大蛋白和鹽分。首先把小柱安裝在固相萃取儀中,用真空泵保證其真空狀態,用1 mL甲醇沖洗3 次,0.1%甲酸溶液沖洗3 次,每次1 mL,完成柱子的活化。然后加入1 mL樣品,多肽附著在柱子上,用0.1%甲酸溶液沖洗3 次,達到除去大蛋白和除鹽的目的。最后用80%甲醇溶液分3 次,每次500 μL收集多肽溶液。用氮氣吹干溶液,得到固體多肽備用[17]。
樣品上質譜前用0.1%的甲酸溶液復溶,并用1%的甲酸溶液調節pH 2~3。色譜條件為:色譜柱C18(150 mm×3 mm,3 μm,100 ?);上樣量:10 μL;流動相:水相為0.1%甲酸溶液,有機相為0.1%甲酸-乙腈溶液。梯度洗脫條件:流速0.4 mL/min,0~10 min為10%有機相和90%水相,10~15 min為35%有機相和65%水相,15~30 min為50%有機相和50%水相,30~32 min為80%有機相和10%水相,32~40 min為10%有機相和90%水相[17-18]。串聯質譜數據MASCOT搜庫,選擇雙殼綱庫與貽貝庫(2017年3月下載于NCBI:https://www.ncbi.nlm.nih.gov/pubmed/)檢測參數設置為:前體離子誤差10-6,子離子誤差1 u,允許2 個位點誤切,假陽性率≤1%,胰蛋白酶酶解產物設置固定的酶切位點,其他參數為默認參數,在上述檢索條件下所得分值有顯著性意義(P<0.05)被認定為有效的鑒定結果[19]。
1.3.6 多肽分子對接及機理分析
ACE廣泛分布于哺乳動物組織中并對血壓起著關鍵的調節作用。ACE抑制肽通過抑制ACE來達到降血壓的作用[20],所以多肽與ACE的相互作用效果可以表征降血壓活性的強弱。本研究采用分子對接技術,模擬多肽與ACE相互作用,具體操作如下:用DS中的Build and edit protein工具輸入鑒定出的多肽序列,并在Minimize Ligands中優化多肽結構,多肽命名為對接配體。另一方面連接網絡從PDB數據庫中找到并打開所需要的蛋白1O86(圖1),在Prepare protein中優化蛋白結構,主要包括去水加氫、補全丟失的氨基酸等,并將蛋白定義為對接受體。選擇CDDOCK程序將配體對接到受體中去,根據所得結果中-CDOCKER Energy值,完成ACE抑制活性多肽的初步篩選[16,20],之后結合多肽氨基酸的組成特點及相互作用力進一步篩選出較優的多肽構像,即進一步完成活性較高多肽的篩選。

圖1 分子對接蛋白受體1O86Fig. 1 Molecular docking protein receptor 1O86
2 結果與分析
2.1 貽貝鹽溶性蛋白基本性質

圖2 貽貝鹽溶性蛋白的SDS-PAGE分析Fig. 2 SDS-PAGE of salt-soluble protein from Mytilus edulis
由圖2可知,貽貝鹽溶性蛋白主要分布在200~250、97.2~116 kDa和小于43 kDa三部分,其所對應的蛋白種類主要為肌球蛋白重鏈、副肌球蛋白、肌動蛋白。鹽溶性蛋白中副肌球蛋白,即泳道中顏色較深、分布在100 kDa附近的條帶,所占比例較大,結果與某些魚類和文蛤鹽溶性蛋白的電泳條帶分布情況基本相似[21]。

圖3 貽貝鹽溶性蛋白粒度分析Fig. 3 Particle size analysis of salt-soluble protein from Mytilus edulis
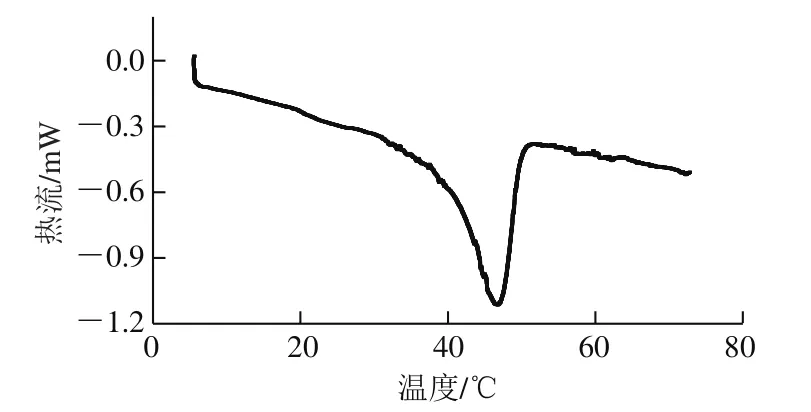
圖4 貽貝鹽溶性蛋白熱變性溫度的測定Fig. 4 Thermal denaturation temperature of salt-soluble protein
由圖3可知,蛋白的粒徑主要分布在兩大部分,一部分為350~700 nm,另一部分為1 400~2 800 nm左右,平均粒徑為572.3 nm,比魚類蛋白平均粒徑大100~250 nm[22-23],這可能與鹽溶性蛋白中不同種蛋白的比例有一定的關系。鹽溶性蛋白中的肌球蛋白的變性溫度在40~60 ℃之間,是熱穩定性較差的蛋白質[24],而同樣身為鹽溶性蛋白的肌動蛋白是熱穩定性最強的蛋白質,其開始變性的溫度為71 ℃[25],由圖4可知,貽貝鹽溶性蛋白的熱變性溫度是46.5 ℃,比文獻報道[26]的41.7 ℃略高,原因可能是貽貝肌動蛋白與肌球蛋白比例比魚的較高,所以導致蛋白整體的變性溫度變高。
2.2 貽貝鹽溶性蛋白酶解液中多肽分子質量分布
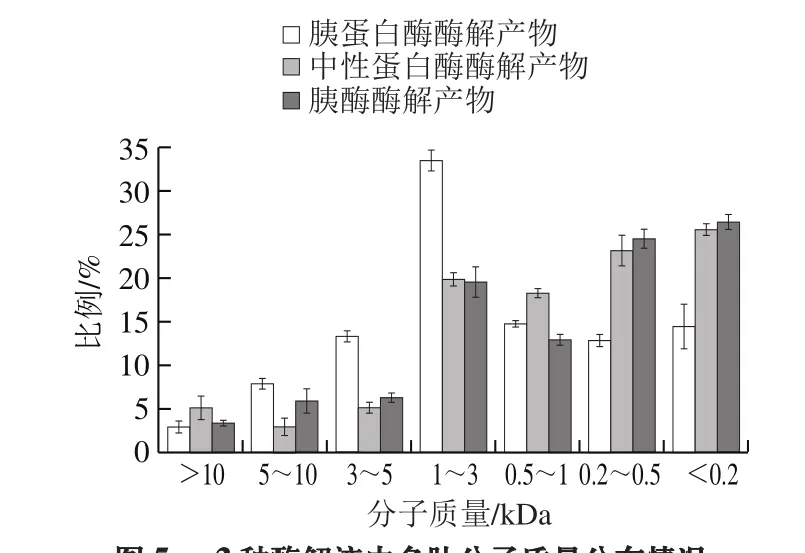
圖5 3 種酶解液中多肽分子質量分布情況Fig. 5 Molecular mass distribution patterns of three hydrolysates
如圖5所示,整體來說,分子質量大于5 kDa的比例較小,結合SDS-PAGE數據可知,肌原纖維蛋白大都在40 kDa以上,所以3 種酶的酶解條件的選擇都較為合適,最終的酶解效果較為理想。其中分子質量在0.5~3 kDa的區間,胰蛋白酶酶解產物多肽所占比例較大,大概為47%,顯著高于其他兩種酶解產物,可能原因是胰蛋白酶具有特定的酶切位點,使得蛋白酶解產物較為單一,使得分布在該區域的多肽較多,比例較高。另一方面,在各自酶的最適條件下的3 種水解度分別為:11.75%、9.93%和22.16%。胰酶酶解產物的水解度顯著高于其他兩種,原因可能是因為胰酶是一種混合酶,多種酶一起發揮作用,使得水解度較高。
2.3 酶解物ACE抑制活性測定結果

圖6 3 種酶解液的ACE抑制活性Fig. 6 ACE inhibitory activities of the three hydrolysates
從圖6可以看出,隨著樣品質量濃度的增加,抑制率都呈現上升的趨勢,當到達某一質量濃度時,趨于平緩,符合一般活性趨勢。但是,當質量濃度低于0.75 mg/mL時,胰蛋白酶酶解產物的抑制率始終大于其他兩個樣品,當大于0.75 mg/mL之后,胰蛋白酶酶解產物與中性蛋白酶酶解產物的抑制率基本相同,并且趨于平緩。胰酶酶解產物在0.5~1.0 mg/mL時,抑制率趨于平緩,為48%左右。3 種酶解產物的擬合方程為:y=16.26+177.32x-97.61x2;y=4.47+167.05x-79.37x2;y=1.73+104.27x-44.79x2。IC50值分別為215.96、321.75、637.67 μg/mL,比付金霞[27]、郝記明[28]等的1.74、1.32 mg/mL結果顯著較低,故具有一定的優勢。
2.4 多肽序列的鑒定及活性機理

表1 胰蛋白酶酶解多肽能量值及與ACE作用的氨基酸Table 1 -CDOCHER energy of peptides from tryptic hydrolysate and amino acid residues bound to ACE
通過質譜分析,并結合數據庫比對,得到了1 600多條多肽序列。Lim等[29]報道小分子質量的多肽因為適應ACE的結合位點,所以其具有較高的活性,所以本研究挑選出不大于10 個氨基酸的多肽進行分子對接模擬,最終根據-CDOCKER Energy值的大小,初步篩選出180 分以上的多肽序列(11 條)進行下一步的分析。這些多肽序列為:GQLEISNVR、ELEDSLDSER、WIAEEADK、ADFESQIK、LEEAEAQALK、IFDAIEK、VEFLDDSNR、LYDIDVAK、SLLEHAER、AAVDDLTR、ISMLEEDIMK(表1),根據它們的分值及與多肽作用的ACE上的氨基酸,同時根據文獻[30]的查閱可初步確定的活性部位氨基酸殘基為His353-Ala354-Ser355-Ala356-Val380-His38-Glu384-His387-Glu411-Lys511-Phe512-His513-Val518-Tyr520-Arg522-Tyr523,11 個多肽結合的氨基酸個數分別為18、19、19、16、16、16、21、22、18、16、20,其中關鍵的氨基酸數目分別為11、8、10、8、6、8、10、10、8、9、10,GQLEISNVR是11 個多肽中結合關鍵氨基酸數目最多的,這可能就是它分值最高的部分原因。同時氫鍵個數的分布與-CDOCKER Energy的分數沒有明顯的線性關系,推測可能與其他的相互作用有一定的關系。
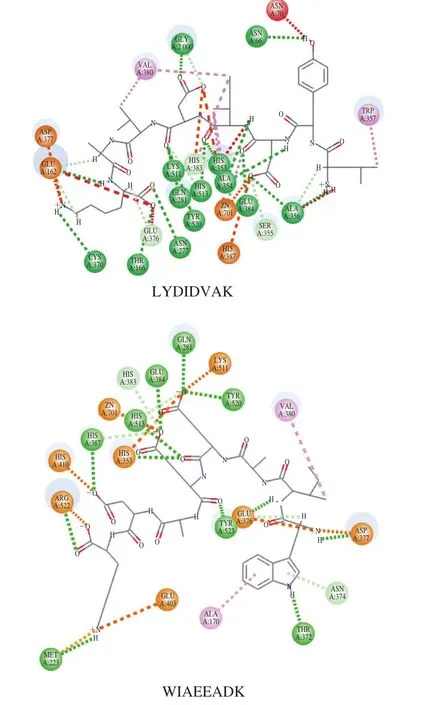
圖7 多肽與ACE的相互作用Fig. 7 Interaction between peptides and ACE
由于ACE的C端結構域是疏水環境,所以抑制活性肽中疏水性氨基酸的含量,決定其是否具有較高的ACE抑制活性。疏水性氨基酸的數量及其在肽鏈上的位置則直接影響了多肽的空間結構的形成[31]。研究表明,N端為疏水性氨基酸或堿性氨基酸(除脯氨酸外),與ACE親和力較強,抑制活性較高。WIAEEADK、ADFESQIK、LEEAEAQALK、IFDAIEK、VEFLDDSNR、LYDIDVAK、AAVDDLTR和ISMLEEDIMK這8 個多肽的N端氨基酸為疏水性氨基酸,WIAEEADK、IFDAIEK和LYDIDVAK含有4 個疏水性氨基酸;LEEAEAQALK和ISMLEEDIMK含有5 個疏水性氨基酸,含量較高,故推測其活性可能較高[32]。另一方面,氫鍵作用是分子間較強的作用力,對兩分子間的相互作用有著極其重要的作用,已有研究[33-35]表明,多肽與ACE的相互作用模式以氫鍵作用為主,故本研究也對初篩的11 個多肽進行氫鍵數量及其位置的統計,結果分別為10、13、12、7、11、12、13、16、10、15、10,氫鍵位置為表1中加粗字體標識(圖7綠線),有的氨基酸比如Ala354等可能具有2 個或者多個氫鍵,所以加粗氨基酸個數可能小于氫鍵個數,其中各多肽的關鍵氨基酸結合的氫鍵數目分別為5、2、7、4、3、9、6、9、5、6和5。同時由圖7也可證明:綠色標識的氫鍵在多肽與ACE相互作用中占主導地位,其次還有碳氫鍵作用和親疏水作用等,這些作用共同維持了多肽與ACE間的結合,保證多肽發揮活性作用。故綜上所述,LYDIDVAK和WIAEEADK確定為ACE抑制活性較強的多肽。
3 結 論
貽貝鹽溶性蛋白分子質量主要分布在40~250 kDa之間,蛋白平均粒徑為572.3 nm,熱變性溫度為46.5 ℃。3 種蛋白酶酶解液中,胰蛋白酶酶解物IC50值最低,為215.96 μg/mL,ACE抑制活性較高。通過質譜鑒定得到胰蛋白酶酶解多肽序列,同時利用分子對接技術,推測多肽與ACE蛋白的結合情況。通過分析關鍵氨基酸、疏水性氨基酸和氫鍵結合等情況,最終推斷出多肽LYDIDVAK和WIAEEADK活性較高,有望成為血管緊張素酶抑制肽。同時建立了一種快速,準確篩選貽貝鹽溶性蛋白酶解物中活性多肽的方法,為貽貝產品的開發和利用提供理論基礎。

