紫玉米、篤斯越桔花色苷與蛋白結(jié)合作用比較
于情情,王丹,馬越,王宇濱,張敏,趙煜煒,趙曉燕,*
(1.沈陽(yáng)農(nóng)業(yè)大學(xué)食品學(xué)院,遼寧沈陽(yáng)110161;2.北京市農(nóng)林科學(xué)院蔬菜研究中心,北京市果蔬農(nóng)產(chǎn)品保鮮與加工重點(diǎn)實(shí)驗(yàn)室,農(nóng)業(yè)部蔬菜產(chǎn)后處理重點(diǎn)實(shí)驗(yàn)室,北京100097;3.龍大食品集團(tuán)有限公司,山東萊陽(yáng)265231)
花色苷(anthocyanins,ACN)是一類(lèi)羥基和甲基化的2-苯基苯并吡喃陽(yáng)離子與一個(gè)或多個(gè)糖分子通過(guò)糖苷鍵結(jié)合而成的化合物[1]。具有黃酮類(lèi)特有的C6-C3-C6碳骨架結(jié)構(gòu),賦予果蔬顏色[2-3]。花色苷作為優(yōu)良的天然色素,有良好的應(yīng)用前景。不同作物花色苷的含量和種類(lèi)不同,紫玉米及篤斯越桔中均含有很高的天然花色苷。研究表明紫玉米及篤斯越桔花色苷加工貯藏過(guò)程中易降解,嚴(yán)重限制了其應(yīng)用。此外,花色苷具有很好的清除自由基、抗炎、抗腫瘤等活性[4],胃腸吸收穩(wěn)定性是其功能發(fā)揮的前提。血清蛋白是血漿中含量最豐富的蛋白質(zhì),它能與許多內(nèi)源及外源化合物結(jié)合,并能結(jié)合生物體內(nèi)存在的多種微量元素,起到存儲(chǔ)與轉(zhuǎn)運(yùn)的作用[5]。牛血清白蛋白(bovine serum albumin,BSA)的結(jié)構(gòu)與人血清白蛋白高度近似,其三維結(jié)構(gòu),由3個(gè)結(jié)構(gòu)域組成,每個(gè)結(jié)構(gòu)域包含兩個(gè)亞結(jié)構(gòu)域,亞結(jié)構(gòu)域以槽口相對(duì)的方式構(gòu)成疏水腔,可與小分子化合物相互作用,提高其穩(wěn)定性,因此常用作研究蛋白質(zhì)與小分子相互作用的模型蛋白[6]。BSA可以與槲皮素[7]、橘皮苷[8]、藍(lán)莓花色苷[9]相互作用,從而抑制其降解。近來(lái),朱莉等報(bào)道紫玉米苞葉花色苷也可與BSA相互作用[10],然而不同來(lái)源花色苷與BSA結(jié)合作用是否相同,結(jié)合后能否提高花色苷穩(wěn)定性及提高程度如何未有報(bào)道。本文采用熒光光譜、Zeta電位、粒徑分析等方法比較紫玉米花色苷、篤斯越桔花色苷與BSA的結(jié)合效果,并分析不同來(lái)源花色苷與牛血清白蛋白相互作用后提高胃腸吸收穩(wěn)定性的效果,為花色苷的產(chǎn)業(yè)化應(yīng)用提供理論基礎(chǔ)。
1 材料與方法
1.1 材料與試劑
紫玉米苞葉(涿紫一號(hào)):由北京市農(nóng)林科學(xué)院蔬菜研究中心農(nóng)產(chǎn)品加工實(shí)驗(yàn)室提供。
篤斯越桔提取物:北京綠色金可生物技術(shù)股份有限公司,花色苷含量20%。
甲醇(色譜純):Dima技術(shù)公司;甲酸、乙酸乙酯、乙醇、二甲基亞砜(dimethyl sulfoxide,DMSO)、鹽酸(分析純):北京化工廠;三羥甲基氨基甲烷(trismetyl aminomethane,Tris):北京銀豐科技發(fā)展有限公司;牛血清白蛋白(BSA):上海羅氏制藥有限公司。
1.2 儀器與設(shè)備
固相微萃取儀(Visiprep DL SPE):美國(guó)Supelco公司;旋轉(zhuǎn)蒸發(fā)儀(BüCHI-R-215):瑞士布奇公司;CHRIST真空冷凍干燥機(jī)(ALPHR Z-4 LD PLUS):北京博勵(lì)行儀器有限公司;紫外分光光度儀(UV-1800):日本島津公司;酶標(biāo)儀(SpectraMaxi3):美國(guó)丹納公司;納米粒度儀(Nanotrac Wave):美國(guó)麥奇克有限公司。
1.3 方法
1.3.1 紫玉米花色苷的提取條件
取原料10 g,置于攪拌機(jī)中粉碎1 min,成粉末狀。使用的提取溶劑為體積分?jǐn)?shù)60%的乙醇水溶液,并用1 mol/L的鹽酸將提取溶劑的pH值調(diào)至3;料液比為1 ∶50(g/mL);提取溫度 50 ℃;提取時(shí)間 1 h;提取次數(shù)1次。提取結(jié)束后,將提取物進(jìn)行過(guò)濾,其中上清液再放入旋轉(zhuǎn)蒸發(fā)儀中旋蒸以得到花色苷的粗提取物,溫度設(shè)為60℃。
1.3.2 紫玉米花色苷大孔樹(shù)脂純化條件
Amberlite XAD-8大孔樹(shù)脂預(yù)處理后,填裝在1.6 cm/60 cm的填裝柱中,將上述粗提物上樣,流速為7 mL/min,0.5%三氟已酸的水沖洗后,采用0.5%三氟已酸的乙醇洗脫,收集液體,45℃條件下旋轉(zhuǎn)蒸發(fā)得到濃縮液。
1.3.3 紫玉米花色苷濃縮液與篤斯越桔花色苷C18固相微萃取純化方法
C18柱用甲醇溶劑預(yù)處理后,采用甲醇、水溶劑將干擾組分洗脫下來(lái),濃縮液上樣后以一定的流速通過(guò)柱子。采用水、乙酸乙酯溶劑將干擾組分洗脫下來(lái),同時(shí)保持分析物仍留在柱上,洗脫劑甲醇將分析物洗脫在收集管中,45℃條件下旋轉(zhuǎn)蒸發(fā)得到濃縮液,冷凍干燥成干粉備用。
1.3.4 牛血清白蛋白與花色苷結(jié)合后熒光光譜測(cè)定
取一定量BSA固體溶于0.1 mol/L,pH 7.4的磷酸鹽緩沖液,并用緩沖液稀釋至5.0×10-7g/mL,備用,取一定量的花色苷用DMSO溶解,得到1.0×10-4g/mL花色苷備用,取BSA儲(chǔ)備液400 μL于2 mL離心管中,向其中加入依次加入 1.0×10-4g/mL花色苷 0、40、80、120、160、200 μL,并用磷酸鹽緩沖液定容至 2 mL 使其濃度為(0、2×10-6、4×10-6、6×10-6、8×10-6、10×10-6g/mL)于25℃放置1 h,取混合溶液200 μL,于非透明96孔板中,利用酶標(biāo)儀分析加入花色苷前后熒光光譜的變化,測(cè)定參數(shù)為激發(fā)波長(zhǎng)260 nm,發(fā)射波長(zhǎng)范圍290 nm~450 nm。
1.3.5 牛血清白蛋白與花色苷結(jié)合后結(jié)合量測(cè)定
BSA與紫玉米和篤斯越桔花色苷的結(jié)合量采用鹽析法[11],使結(jié)合的紫玉米和篤斯越桔花色苷從未結(jié)合的紫玉米和篤斯越桔花色苷中分離開(kāi)。在15 mL離心管中,加入1 mL BSA儲(chǔ)備溶液,再加入不同量的花色苷儲(chǔ)備溶液,配制花色苷與BSA的摩爾濃度比分別為 0、4、8、12、16、20、24、28、32 的溶液,加 0.1 mol/L 的磷酸鹽緩沖液(pH 7.4)定容至10 mL,用渦流振蕩器混勻。BSA的濃度為1.5×10-5mol/L,花色苷的濃度分別為 0、6×10-5、9×10-5、15×10-5、18×10-5、24×10-5、30×10-5、36×10-5、42×10-5、48×10-5mol/L。取制備好的納米顆粒溶液10 mL,緩慢加入過(guò)量硫酸銨粉末,均勻攪拌,直至體系中有未溶解的硫酸銨,再攪拌10 min,仍有未溶解的硫酸銨,靜置20 min后,取出上清液,放入離心管中,4℃條件下離心30 min,轉(zhuǎn)速為10 000 r/min。取上清,用UV-Vis分光光度計(jì)檢測(cè)上清液中的花青素的含量,即游離花青素的含量([Lf]),花色苷總量為[L],而結(jié)合的花青素的量([Lb])即:
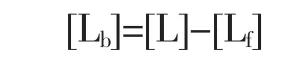
1.3.6 牛血清白蛋白與花色苷結(jié)合后Zeta電位與粒徑測(cè)定
取一定量BSA固體溶于0.1 mol/L,pH7.4的磷酸鹽緩沖液,并用緩沖液稀釋至1.5×10-4mol/L,備用,取一定量的花色苷用DMSO溶解,得到1.5×10-3mol/L花色苷備用,配制花色苷與BSA的摩爾濃度比分別為0、2、4、6、8、10的溶液,取 BSA 儲(chǔ)備液 1 mL 于 10 mL 離心管中,向其中依次加入1.5×10-3mol/L花色苷0、200、400、600、800、1000μL,并用磷酸鹽緩沖液定容至10mL,用渦流振蕩器混勻。使BSA濃度為1.5×10-4mol/L,花色苷濃度分別為 0、3×10-5、6×10-5、9×10-5、12×10-5、15×10-5mol/L于25℃放置1 h,取混合溶液1 mL于Nanotrac Wave儀器中測(cè)量粒徑及電勢(shì)。
1.3.7 牛血清白蛋白與花色苷結(jié)合后胃腸消化吸收穩(wěn)定性測(cè)定
取一定量BSA固體溶于0.1 mol/L,pH7.4的磷酸鹽緩沖液,并用緩沖液稀釋至1.5×10-4mol/L,備用,取一定量的花色苷用DMSO溶解,得到濃度分別為10.5×10-5、6×10-5mol/L,備用。取花色苷儲(chǔ)備液 5 mL于45 mL離心管中,向其中加入5 mL BSA,對(duì)照加入相應(yīng)量的磷酸鹽緩沖液,依次向離心管中添加2.5 mL抗壞血酸溶液(0.9%NaCl、1%抗壞血酸水溶液)、2.5 mL 胃液(0.3%NaCl、0.11%KCl、0.15%CaCl2·2H2O、0.05%KH2PO4、0.07%MgCl2·6H2O),用 1 mol/L NaHCO3調(diào)節(jié)pH值至4.0后,加入2.5 mL胃蛋白酶(0.52%豬胃蛋白酶)。氮吹5 min后在37℃下振搖30min,轉(zhuǎn)速為100 r/min。調(diào)節(jié)pH值至2.0,氮吹5 min,再振搖30 min。然后調(diào)節(jié)pH值至6.9,加入1.5 mL腸胰蛋白酶(0.4%豬胰蛋白酶、2.5%膽酸鹽、0.5%連苯三酚、1%生育酚),氮吹5 min,在37℃下保溫2 h,在5 000 r/min條件下離心20 min得上清液,模擬胃腸消化系統(tǒng)揭示消化吸收過(guò)程中花色苷與牛血清白蛋白自組納米顆粒后花色苷變化情況。
1.4 數(shù)據(jù)統(tǒng)計(jì)
采用DPS數(shù)據(jù)分析軟件Duncan新復(fù)極差法(P<0.05),Origin 7.5軟件作圖;試驗(yàn)重復(fù)3次。
2 結(jié)果與分析
2.1 紫玉米和篤斯越桔花色苷與BSA結(jié)合作用研究
BSA分子中主要含有色氨酸、酪氨酸、苯丙氨酸3種氨基酸殘基發(fā)射內(nèi)源熒光,在本試驗(yàn)中激發(fā)光為260 nm,可認(rèn)為蛋白質(zhì)所呈現(xiàn)的熒光源來(lái)自分子中的酪氨酸殘基[12-13]。通過(guò)熒光光譜可檢測(cè)花色苷與牛血清白蛋白結(jié)合后的熒光光譜變化,分析結(jié)合情況。
圖1反應(yīng)了BSA與不同濃度花色苷在25℃條件下相互作用后熒光光譜的變化。
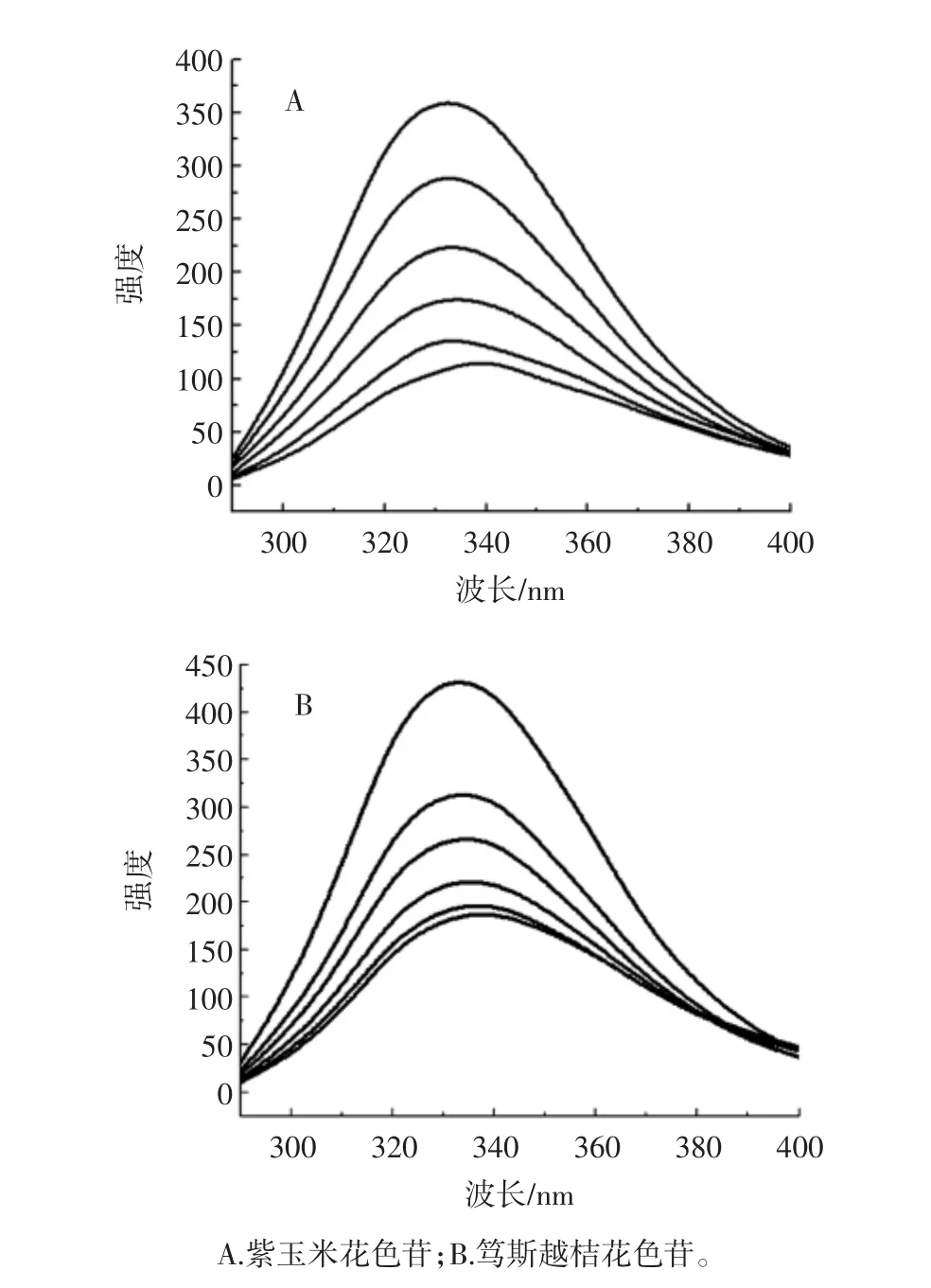
圖1 花色苷對(duì)BSA熒光光譜的影響Fig.1 Effects of anthocyanin on fluorescence spectra of BSA
由圖1可知,隨著紫玉米苞葉花色苷濃度的增加,BSA的熒光強(qiáng)度逐漸下降,這與Tang L等[14]對(duì)矢車(chē)菊-3-O-葡萄糖苷和BSA之間的熒光猝滅光譜結(jié)果一致。BSA熒光光譜的最大發(fā)射峰通常在330 nm處,由圖1可見(jiàn),隨著紫玉米與篤斯越桔花色苷濃度的增加,BSA最大發(fā)射波長(zhǎng)均(λmax)從330 nm到340 nm,光譜有紅移現(xiàn)象,進(jìn)一步證明紫玉米與篤斯越桔花色苷與BSA之間存在一定的相互作用,疏水性下降且微環(huán)境中極性增加[15]。
2.2 紫玉米和篤斯越桔花色苷與BSA結(jié)合量比較
圖2為紫玉米和篤斯越桔花色苷與BSA結(jié)合量分析。
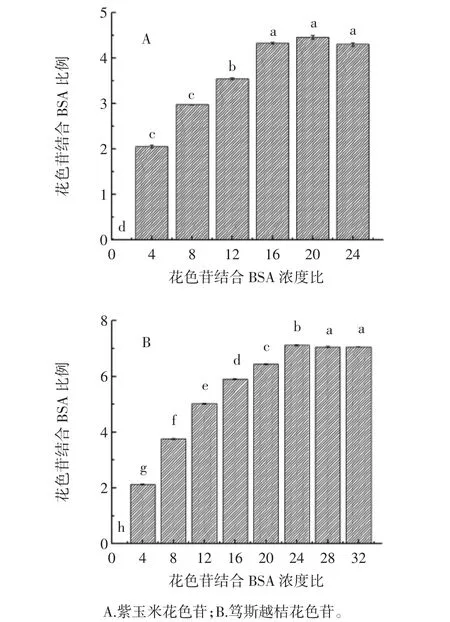
圖2 花色苷與BSA的結(jié)合量分析Fig.2 Binding capacity of BSA with anthocyanins
隨著紫玉米花色苷與BSA的濃度比由0增加到16,與BSA結(jié)合的紫玉米花色苷的量也逐漸增加;當(dāng)紫玉米色苷與BSA的濃度比達(dá)到16時(shí),即體系中紫玉米花色苷的濃度達(dá)到18×10-5moL/L時(shí),BSA對(duì)紫玉米花色苷的結(jié)合達(dá)到了飽和。1 moL/L BSA最多可結(jié)合4 mol/L紫玉米花色苷。與紫玉米花色苷相似,隨著篤斯越桔花色苷與BSA的濃度比由0增加到24,與BSA結(jié)合的篤斯越桔花色苷也逐漸增加;當(dāng)篤斯越桔花色苷與BSA的濃度比達(dá)到24時(shí),即體系中篤斯越桔花色苷的濃度達(dá)到36×10-5moL/L時(shí),BSA對(duì)篤斯越桔花色苷的結(jié)合達(dá)到了飽和。1 moL/L BSA可結(jié)合7 moL/L篤斯越桔花色苷(圖2)。BSA與篤斯越桔花色苷的結(jié)合量高于與紫玉米花色苷的結(jié)合量。劉建壘等[7]研究表明,1 moL/L BSA可結(jié)合10篤斯越桔花色苷,本研究表明1 moL/L BSA與紫玉米花色苷和篤斯越桔花色苷可結(jié)合的量分別為4 mol和7 mol,可見(jiàn)不同來(lái)源,不同結(jié)構(gòu)的花色苷與BSA的結(jié)合量不同。
2.3 紫玉米和篤斯越桔花色苷與BSA結(jié)合后粒徑及Zeta電位比較
圖3為花色苷與BSA結(jié)合后粒徑分析情況。
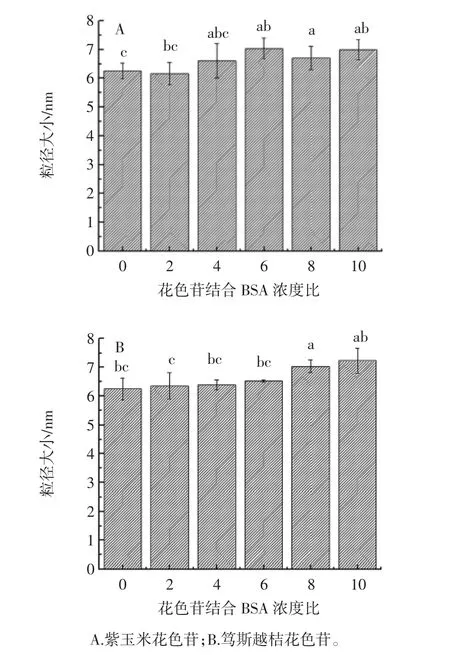
圖3 花色苷與BSA結(jié)合后的粒徑分析Fig.3 Partical sizes of BSA with anthocyanins
如圖3,紫玉米及篤斯越桔花色苷與BSA結(jié)合后粒徑小于10 nm,可見(jiàn)兩種花色苷均能與BSA結(jié)合形成納米顆粒。花色苷與BSA結(jié)合時(shí)在達(dá)到飽和結(jié)合量前隨著花色苷濃度比例的增加即隨著結(jié)合量的增加,粒徑越來(lái)越大。進(jìn)一步以摩爾濃度比10的條件下進(jìn)行兩種花色苷粒徑的比較。紫玉米花色苷與BSA結(jié)合后平均粒徑為6.99 nm,篤斯越桔花色苷與BSA結(jié)合后平均粒徑為7.23 nm,紫玉米花色苷與BSA形成的納米顆粒較篤斯越桔花色苷粒徑小。
通過(guò)Zeta電位,對(duì)顆粒之間相互排斥的強(qiáng)度,表征膠體分散系的穩(wěn)定性[16]。Zeta電位的絕對(duì)值越高,體系越穩(wěn)定,反之,Zeta電位越低,越傾向于凝結(jié)或凝聚。Zeta電位與體系穩(wěn)定性之間的大致關(guān)系如下:0~±5 mV 快速凝結(jié)或凝聚、±10 mV~±30 mV 開(kāi)始變得不穩(wěn)定、±30 mV~±40 mV 穩(wěn)定性一般、±40 mV~±60 mV較好的穩(wěn)定性、超過(guò)±61 mV穩(wěn)定性極好。花色苷與BSA的電勢(shì)分析見(jiàn)圖4。
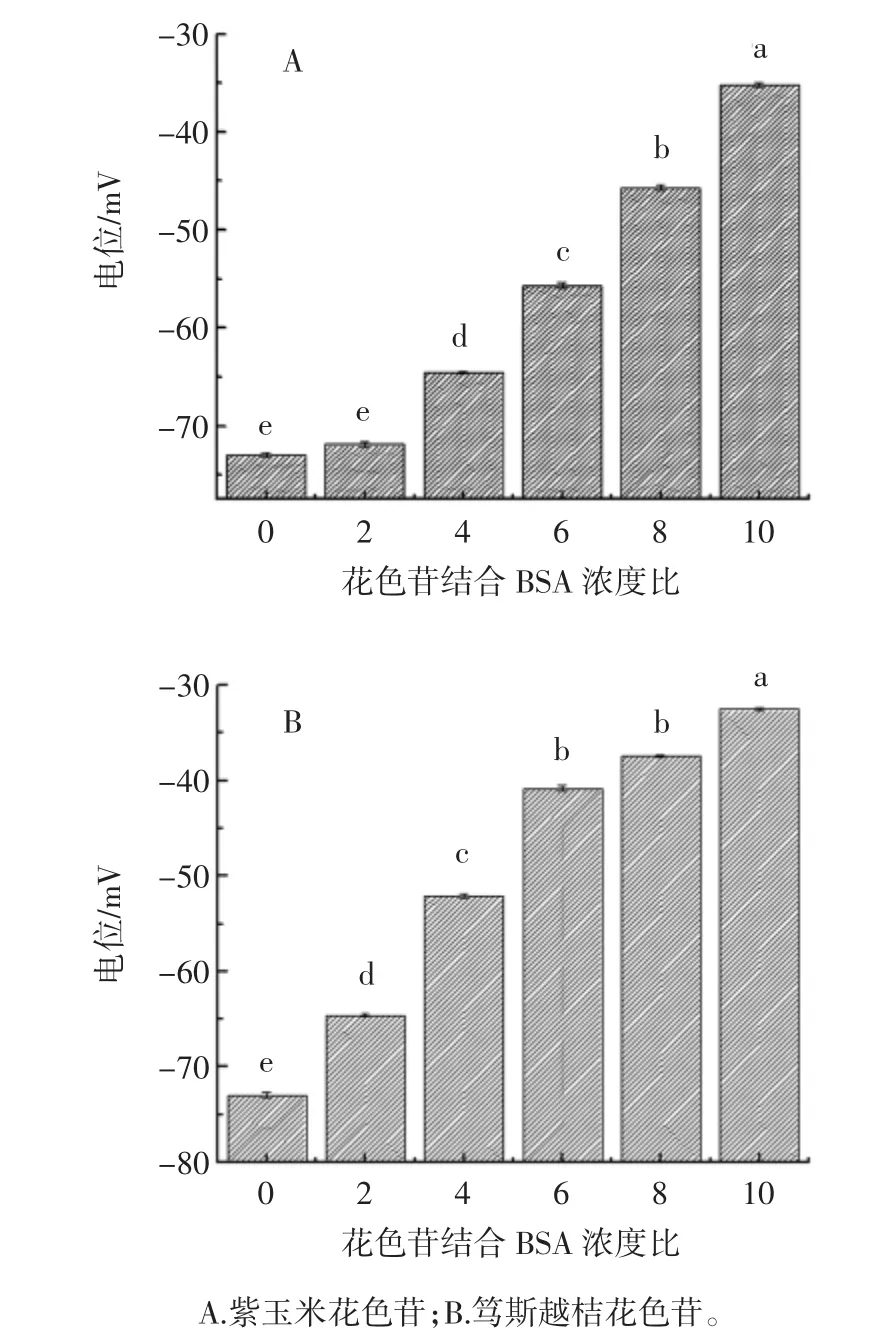
圖4 花色苷與BSA的電勢(shì)分析Fig.4 ζ-potential of BSA with anthocyanins
如圖4,BSA 平均電勢(shì)為-73 mV[17],超過(guò)±60 mV,其穩(wěn)定性極好,且?guī)ж?fù)電。當(dāng)加入花色苷后電勢(shì)絕對(duì)值明顯下降,紫玉米花色苷與BSA結(jié)合后Zeta電位絕對(duì)值下降至-71.9 mV,篤斯越桔花色苷與BSA結(jié)合后下降至-64.6 mV,可見(jiàn)紫玉米及篤斯越桔花色的加入對(duì)BSA的穩(wěn)定性影響較大。隨著紫玉米和篤斯越桔花色苷濃度的增加,與BSA結(jié)合后的平均電勢(shì)分別下降至-35.2 mV及-32.5 mV。盡管加入花色苷后電位下降,然而兩種花色苷結(jié)合BSA后Zeta電位絕對(duì)值均大于30 mV,可見(jiàn)形成的納米顆粒仍具有一定的穩(wěn)定性。
2.4 紫玉米和篤斯越桔花色苷與BSA結(jié)合后胃腸消化吸收穩(wěn)定性比較
花色苷食入后,被胃及小腸等消化器官吸收才能參與代謝過(guò)程,胃腸消化吸收穩(wěn)定性是花色苷食用功能發(fā)揮的重要前提。圖5為添加BSA后花色苷含量的變化。
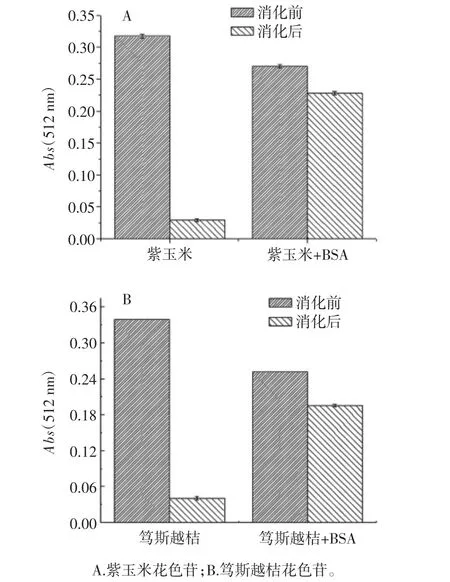
圖5 花色苷與BSA在消化前后的花色苷吸光度Fig.5 Staility of anthocyanins with or without BSA in simulated gastricintestinal model
由圖5可知,加入BSA紫玉米花色苷及篤斯越桔花色苷含量都下降。進(jìn)一步比較消化前后,可觀察到紫玉米花色苷及篤斯越桔花色苷含量均急劇下降,而添加BSA的花色苷含量下降則相對(duì)緩慢。
表1為花色苷結(jié)合BSA后消化吸收降解率的變化情況。

表1 紫玉米花色苷與篤斯越桔花色苷與BSA結(jié)合后消化吸收的降解率Table 1 The degradation rate of BSA with purple corn anthocyanins and Vaccinium uliginosum linn anthocyanins
根據(jù)表1所示,剛加入BSA時(shí),紫玉米花色苷發(fā)生降解,降解率為14.92%,篤斯越桔花色苷的降解率為25.86%,BSA與花色苷的結(jié)合后篤斯越桔花色苷的含量降低程度較紫玉米花色苷大。通過(guò)模擬胃腸道吸收,測(cè)量花色苷的生物利用率,未加BSA的紫玉米花色苷及篤斯越桔花色苷的降解率分別為90.86%和88.05%。加入BSA后紫玉米花色苷降解率為15.56%,篤斯越桔花色苷的降解率為22.41%,明顯提高了花色苷的生物利用率,且對(duì)紫玉米花色苷的穩(wěn)定性提高效率高于篤斯越桔花色苷。
3 結(jié)論
紫玉米花色苷和篤斯越桔花色苷均與BSA發(fā)生相互作用形成較穩(wěn)定的10 nm左右粒徑的納米顆粒;紫玉米花色苷和篤斯越桔花色苷可結(jié)合的量分別為4 mol和7 mol,紫玉米花色苷與BSA的結(jié)合量小于篤斯越桔花色苷,且結(jié)合后形成的納米顆粒較篤斯越桔花色苷小;BSA提高了紫玉米花色苷及篤斯越桔花色苷的胃腸吸收穩(wěn)定性,紫玉米花色苷的穩(wěn)定性提高效率高于篤斯越桔花色苷。

