紫球藻多糖免疫調節作用初步探究
雷金麗,黃永梅,謝文熙,詹靜婷,張海濤,4,*,羅輝,3,*
(1.廣東醫科大學化學教研室,廣東湛江524023;2.廣東醫科大學湛江市環北部灣海洋微生物研究開發重點實驗室,廣東湛江524023;3.廣東醫科大學海洋醫藥研究院,廣東湛江524023;4.廣東醫科大學生物化學與分子生物學研究所,廣東湛江524023)
多糖是一類由多個單糖結合形成的結構復雜且龐大的糖類物質。多糖在自然界中分布廣泛,對生物體具有重要作用,是生物體維持生命活動的基本物質之一。多糖具有廣泛的藥理作用,如抗腫瘤[1],抗菌[2],抗氧化[3]和免疫調節[4]等。一些多糖衍生物如瓊膠,蘆薈膠,透明質酸,卡拉膠等已經被應用到生產中。
紫球藻(porphyridium creuntum)是一類重要的海洋微藻,是紅藻門中唯一的單細胞類群。其生長進入穩定期后,會向胞外分泌大量的多糖,多糖的含量可達生物量的50%。該糖主要由半乳糖,葡萄糖,木糖等單糖構成。紫球藻多糖具有獨特的膠體性能,水溶液黏度大,與卡拉膠類似,在pH 1~12,溫度20℃~90℃范圍內穩定。紫球藻多糖的活性已經取得多方面的研究進展,例如抗氧化作用[5];抗菌與抗病毒作用[6];抗腫瘤[7]等。有關紫球藻多糖對體外免疫細胞免疫功能的研究較少,本文主要從細胞水平初步研究紫球藻多糖對免疫細胞的免疫調節作用,以期為今后紫球藻多糖開發為免疫調節劑提供理論與實踐基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 藻種與細胞株
紫球藻:廣東恒興南方科技有限公司;小鼠巨噬細胞樣細胞株RAW264.7(ATCC TIB-71):上海細胞研究所。
1.1.2 試劑
脂多糖(lipopolysaccharide,LPS)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽(商品名:噻唑藍)(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,thiazolyl blue tetrazolium bromide,MTT)粉末:美國sigma公司;DMEM培養基、胎牛血清、Penicilin Streptomycin雙抗:美國Gibco公司;小鼠腫瘤壞死因子-α試劑盒、小鼠白細胞介素-6試劑盒:杭州聯科生物技術有限公司;一氧化氮檢測試劑盒:上海碧云天生物技術有限公司;無水乙醇:天津市富宇精細化工有限公司;丙酮:天津化學試劑有限公司;二甲基亞砜(dimethyl sulfoxide,DMSO)、冰醋酸:天津市富宇精細化工有限公司。
1.2 儀器與設備
240i CO2培養箱、1300series A2 超凈臺、30011031酶標儀:美國Thermo公司;596489熒光倒置顯微鏡:日本Nikon公司。
1.3 方法
1.3.1 紫球藻多糖的制備
將收集的藻液離心,藻泥經單蒸水洗滌后冷凍干燥成藻粉,取適量藻粉放入索氏提取器中脫脂,將脫油脂的藻粉按照1∶50(g/mL)放入單蒸水中,加復合蛋白酶75 mg,于50℃的恒溫磁力攪拌器中酶解4 h,沸水浴滅酶10 min,4 000 r/min離心20 min后,棄沉淀,上清液調pH值至7.0,透析,再經旋轉蒸發濃縮大約至原體積的1/3,向其中加入3倍體積的95%乙醇4℃冰箱過夜沉淀,沉淀后的溶液經離心棄上清,沉淀用無水乙醇和丙酮依次洗滌2次后冷凍干燥,得干燥粗多糖。試驗前將稱取8 mg的粗多糖,溶于10 mL的滅菌水中得到濃度為800 μg/mL的多糖溶液,用0.22 μm濾膜過濾備用,使用時再依次稀釋得到400、200、100、50、25、12.5 μg/mL 的溶液。
1.3.2 RAW264.7細胞活力的測定
收集細胞,調整細胞濃度為5×105個/mL,接種于96 孔板中,100 μL/孔,置 37 ℃,5%CO2培養箱培養。設計空白組,紫球藻多糖組,LPS陽性對照組,每孔加入已經稀釋好的不同濃度紫球藻多糖溶液100 μL,繼續培養24 h;將板取出,每孔加入終濃度為0.5 mg/mL MTT 20 μL,繼續培養 4 h,棄上清,每孔加入 150 μL DMSO,低速震蕩10 min使結晶紫完全溶解,490 nm處的吸光值。
1.3.3 細胞上清液中NO含量測定
制備細胞濃度為1(106個/mL的巨噬細胞懸液,接種于 96 孔板中,100 μL/孔,置 37 ℃,5%CO2培養箱培養。如1.3.2分組與加藥,繼續培養24 h后,從每孔上清液吸取50 μL到新的96孔板中,用Griess法測定NO的含量。
1.3.4 巨噬細胞吞噬中性紅能力的檢測
制備細胞濃度為1(106個/mL的巨噬細胞懸液,接種于 96孔板中,100 μL/孔,置 37 ℃,5%CO2培養箱培養。如1.3.2分組與加藥,培養24 h后,加入0.05%的中性紅100 μL/孔,繼續培養5 min,傾掉中性紅,用溫PBS洗3次,每孔加入細胞裂解液(無水乙醇:冰醋酸=1∶1(體積比)200 μL。4℃冰箱靜置 2 h~3 h,待細胞裂解后,540 nm處測定吸光值,并計算吞噬指數。
1.3.5 酶聯免疫吸附法(enzyme-linked immunosorbent,ELISA)試劑盒檢測細胞因子釋放情況
制備細胞濃度為1(106個/mL的巨噬細胞懸液,接種于 96 孔板中,200 μL/孔,置 37 ℃,5%CO2培養箱培養。如1.3.2分組與加藥,培養24小時后,收集細胞上清液,3 000 r/min離心10 min。取上清并按照小鼠TNF-α與IL-6試劑盒操作。用酶標儀進行雙波長檢測,450 nm處測最大吸收波長,570 nm作為參考波長,最后的OD用最大波長OD值減去參考波長的OD值。
1.3.6 數據統計分析
數據均采用SPSS21.0進行統計分析,數據用x±s表示,采用單因素方差檢驗法處理,方差齊時用LSD方法進行組間的比較,方差不齊時,用Dunnett T3比較,P<0.05認為有統計學意義。
2 結果與分析
2.1 紫球藻多糖對細胞活力的影響
紫球藻多糖對細胞活力的影響見圖1。
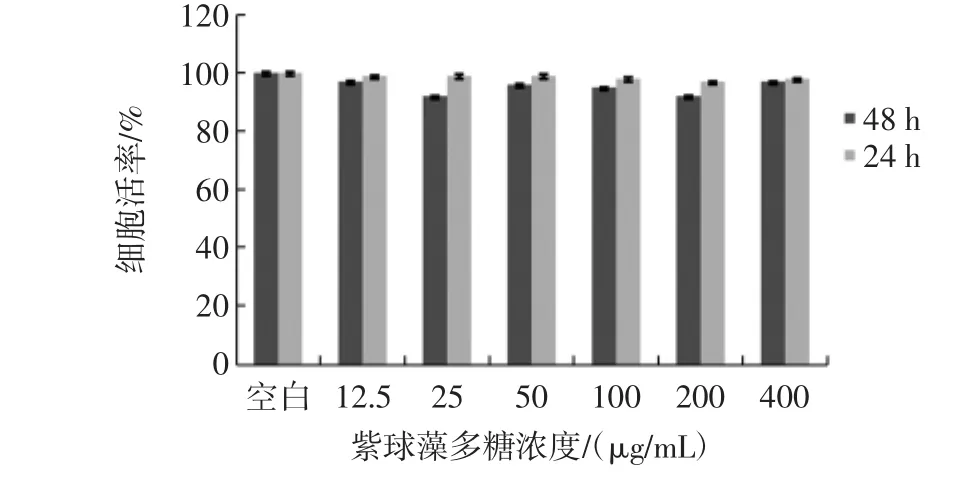
圖1 不同濃度紫球藻多糖對細胞活力的影響Fig.1 Effects of different concentrations of porphyridium creuntum polysaccharide on cell viability
采用MTT法檢測細胞活力時,用細胞相對增殖率表示藥物對細胞活力的影響,樣品組的吸光值與空白組的吸光值之比的百分率即為細胞相對增殖率。當細胞相對增殖率大于100%時,表明細胞增殖,活力上升,藥物對細胞無毒性;當細胞相對增殖率小于100%時,細胞生長受到抑制,活力下降,藥物對細胞有抑制作用。如圖1所示,加藥培養24 h與48小時后,細胞相對增殖率幾乎都是100%,與空白對照組相比,均無統計學意義,說明紫球藻多糖濃度在12.5 μg/mL~400 μg/mL范圍內不影響細胞活力,對細胞無毒性。
2.2 紫球藻多糖對巨噬細胞釋放NO的影響
紫球藻多糖刺激巨噬細胞釋放NO情況見圖2。
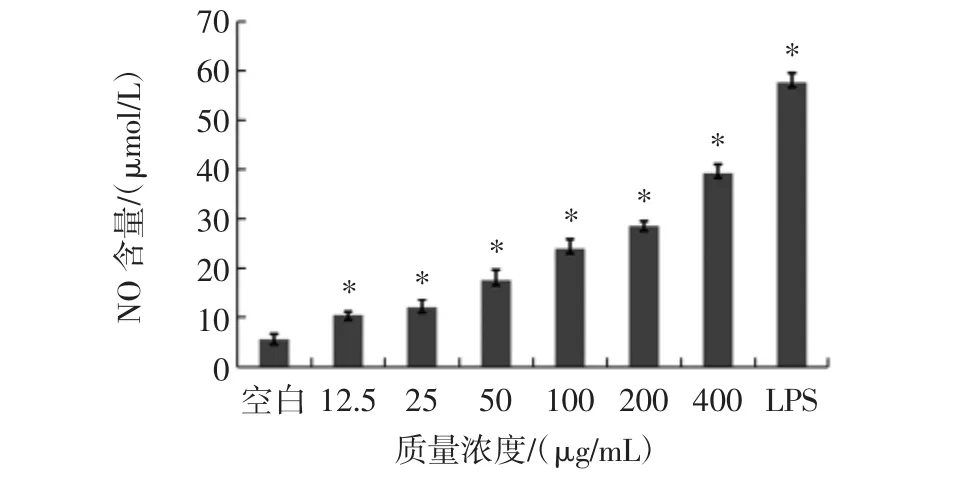
圖2 不同濃度紫球藻多糖刺激巨噬細胞釋放NO情況Fig.2 Effects of different concentrations of porphyridium creuntum polysaccharide on the release of NO of mirophage cell
從圖2可以看出,LPS和不同濃度的紫球藻多糖均能夠促進細胞釋放NO,與空白組相比均具有統計學意義(P<0.05),NO的釋放量與紫球藻多糖濃度呈劑量依懶性。
2.3 紫球藻多糖對巨噬細胞吞噬作用的影響
紫球藻多糖對巨噬細胞吞噬能力的影響見圖3。
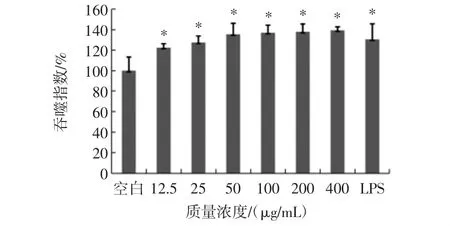
圖3 不同濃度紫球藻多糖對巨噬細胞吞噬能力的影響Fig.3 Effects of different concentrations of porphyridium creuntum polysaccharide on the phagocytosis of mirophage cell
與正常對照組相比,LPS與各濃度紫球藻多糖均能夠促進巨噬細胞吞噬中性紅,紫球藻多糖在12.5 μg/mL~400 μg/mL 質量濃度范圍內具有顯著性差異(P<0.05)。
2.4 細胞因子TNF-α與IL-6的分泌情況
紫球藻多糖對巨噬細胞分泌TNF-α的影響見圖4。
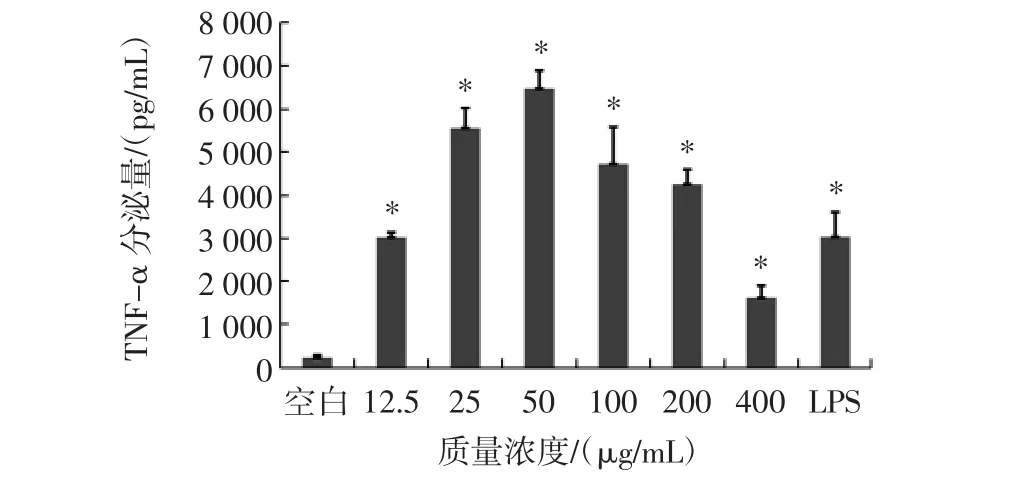
圖4 不同濃度紫球藻多糖對巨噬細胞分泌TNF-α的影響Fig.4 Effects of different concentrations of porphyridium creuntum polysaccharide on the secretion of TNF-α of macrophages
由圖4可知,與空白組相比,不同濃度的紫球藻多糖和LPS均能夠促進TNF-α的分泌,有顯著性差異(P<0.05)。TNF-α的分泌呈現先上升后下降的趨勢,質量濃度從 12.5 μg/mL~50 μg/mL時,分泌量上升,100 μg/mL~400 μg/mL 范圍內,分泌量下降。50 μg/mL的濃度促進作用最強。
紫球藻多糖對巨噬細胞分泌IL-6的影響見圖5。
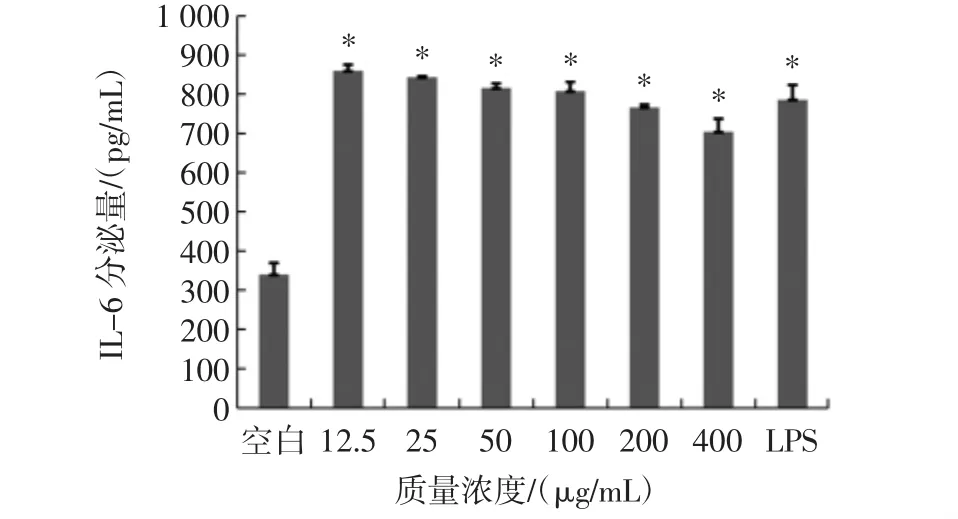
圖5 不同濃度紫球藻多糖對巨噬細胞分泌IL-6的影響Fig.5 Effects of different concentrations of porphyridium creuntum polysaccharide on the secretion of IL-6 of macrophages
不同濃度的紫球藻多糖和LPS均能夠促進IL-6的分泌,但是IL-6的分泌量隨著紫球藻多糖濃度的增加出現降低的趨勢,但是仍然有統計學意義(P<0.05)。在12.5 μg/mL時促進效果最佳。
3 討論與總結
巨噬細胞來源于單核細胞,是一種重要的免疫細胞,參與非特異性防御與特異性防御過程。巨噬細胞具有強大的吞噬能力,吞噬能力是巨噬細胞發揮免疫調節的通路之一。巨噬細胞通過其表面的受體識別入侵的病原微生物等抗原性異物,將異物進行吞噬或者胞飲作用傳遞到細胞內,成為吞噬體,在吞噬體內通過自身的滅菌系統將異物清除,同時巨噬細胞還可以作為提呈細胞,將吞噬的異物提呈給T淋巴細胞,啟動免疫應答。另一方面一些細胞因子如TNF-α,IL-6等與活性效應分子如NO的釋放均可以促進巨噬細胞識別抗原性異物,提高巨噬細胞吞噬能力,增強機體的抵抗力。
細菌感染主要是由革蘭陰性菌引起的,LPS是革蘭陰性菌細胞壁的成分,它對宿主有毒性作用,可引起發熱,內毒素休克等。LPS特異性的與細胞表面的TLR-4受體結合,促進巨噬細胞分泌TNF-α、IL-6、NO等細胞因子來抵抗外來入侵,發揮免疫調節作用。研究表明,多糖調節機體的免疫功能,表現為增強細胞的吞噬能力,刺激免疫細胞產生細胞因子如TNF-α、IL-6、NO等。如Song等[8]發現柴胡多糖通過促進NO和細胞因子TNF-α的產生來提高機體的免疫力。liu等[9]建立了環磷酰胺誘導小鼠免疫低下模型,給予黃芪多糖治療,結果發現黃芪多糖能夠增強小鼠巨噬細胞的吞噬能力,且能使免疫低下組小鼠的TNF-α、IL-2等細胞因子恢復到正常水平。Jose等[10]研究了硫酸化扇藻多糖對RAW264.7細胞的免疫調節作用,結果表明扇藻硫酸多糖通過促進RAW264.7細胞的增殖,增加NO的釋放,提高TNF-α,IL-6等細胞因子來發揮免疫調節作用。ren等[11]探究了羥乙基化猴頭菌多糖對巨噬細胞RAW264.7的免疫調節作用,試驗表明,羥乙基化猴頭菌多糖通過刺激TNF-α、IL-6、NO的分泌來提高免疫活性。
NO是一種重要的免疫調節因子[12],各種外界的刺激,如LPS等均可以誘導巨噬細胞釋放NO。NO對機體的免疫調節十分廣泛且復雜,是巨噬細胞發揮免疫調節作用的基礎,且參與殺害病原微生物,殺害腫瘤細胞,并介導一系列的免疫應答過程。
TNF-α是一種主要由巨噬細胞和單核細胞產生的促炎細胞因子,并參與炎癥反應與免疫反應。TNF-α也是一種關鍵的炎癥因子,在宿主防御過程中起著重要作用。IL-6可以誘導成熟的CD4+T分化為Th2細胞并促進B細胞對免疫球蛋白和急性期球蛋白的分泌。
本試驗基于小鼠腹腔巨噬細胞RAW264.7,初步探究了紫球藻多糖對其存活率,吞噬能力,NO釋放能力以及細胞因子TNF-α和IL-6分泌能力的影響。由于LPS能夠很好的激活巨噬細胞,是探究巨噬細胞免疫調節作用常用的陽性對照藥物,因此本試驗選擇LPS作為陽性對照,通過免疫調節的相關的指標,共同探究其與紫球藻多糖對巨噬細胞免疫調節作用規律。結果表明:紫球藻多糖作用24 h時,與空白對照組相比,無統計學意義,對細胞存活力無影響,但是作用48小時后,細胞存活率相對于空白組雖沒有統計學意義,但是細胞活力相比于24 h稍微有點降低,說明藥物作用24 h時效果較好。因此為了排除藥物本身對試驗的干擾,本文所采取藥物作用時間為24 h。在本試驗中,不同濃度的紫球藻多糖與LPS均可以刺激細胞釋放NO,紫球藻多糖組的NO釋放量均低于LPS組,但紫球藻多糖組與LPS組的釋放量均高于空白組,且相對于空白組都具有統計學意義(P<0.05);這與Zheng Pimiao等[13]研究的結果一致。說明紫球藻多糖能夠激活巨噬細胞。Zheng Yi等[14]研究川芎多糖對免疫抑制小鼠功能改善作用,研究結果發現川芎多糖可以提高免疫抑制小鼠吞噬細胞的活性,川芎多糖濃度越大,吞噬能力越強,呈劑量依賴性。類似的,本文的實驗結果表明不同濃度的紫球藻多糖都能夠增強巨噬細胞的吞噬能力,且吞噬能力隨著紫球藻多糖濃度的增加而增強,相比于空白組都具有顯著性差異(P<0.05)。在12.5 μg/mL~50 μg/mL 濃度范圍,吞噬能力增強的比較明顯,但是小于LPS的增強作用;濃度在100 μg/mL~400 μg/mL時,雖然吞噬能力隨著紫球藻多糖濃度增大而增強,且高于LPS的刺激,但是增強能力趨于平緩。說明低濃度范圍的紫球藻多糖能較好的增強巨噬細胞的吞噬能力,而這一點與Zheng Yi的報道有所區別。有研究表明多糖受體主要是Ш型補體受體,屬于整合素家族,主要存在于巨噬細胞,自然殺傷細胞和多形核中性粒細胞表面。多糖與受體結合有一下幾個特點:可逆性、飽和性,特異性且存在活性中心。基于此,紫球藻多糖與巨噬細胞的作用可能作用存在一個飽和值,這個飽和值可能與細胞膜表面受體有關,所以導致濃度升高,巨噬細胞的吞噬能力增強的效果不明顯。因此有關紫球藻多糖與巨噬細胞表面受體的相互作用機理有待進一步的研究。不同濃度的紫球藻多糖均可以刺激巨噬細胞釋放TNF-α,與空白對照組相比,都具有顯著性差異(P<0.05)。但是TNF-α釋放量呈先上升后下降的趨勢,最佳釋放量對應的紫球藻多糖濃度是50 μg/mL。各濃度的紫球藻多糖同樣可以刺激IL-6的釋放,但是IL-6的釋放量隨著紫球藻濃度的增加反而出現降低的趨勢,但是相比于空白對照組,仍具有顯著性差異(P<0.05)。紫球藻多糖濃度在12.5 μg/mL~100 μg/mL 區間內,對 IL-6 釋放量的促進作用比較明顯,且各組間的釋放量相差不大,而濃度在 200 μg/mL~400 μg/mL 區間促進作用明顯低于12.5 μg/mL~100μg/mL該區間的促進作用。因此綜上紫球藻多糖濃度為50 μg/mL時,是促進TNF-α與IL-6釋放的最佳濃度。據文獻報道Liu Wei等[15],Liu Xin等[16],多糖通過刺激TNF-α與IL-6分泌來提高免疫水平,且隨著多糖濃度的升高,TNF-α與IL-6的分泌量上升。然而本研究結果并未與文獻報道的結果相一致,這可能與紫球藻多糖復雜的結構,其與細胞表面受體作用特點,其巨大的分子量有關,因此紫球藻多糖劑量與TNF-α與IL-6的分泌量的關系仍需要更進一步的研究。
本試驗首次探究紫球藻多糖對兩種重要細胞因子TNF-α與IL-6分泌的影響,并且取得了良好效果。綜上,本研究初步證明,紫球藻多糖通過增強巨噬細胞的吞噬能力,促進NO、TNF-α與IL-6的釋放來參與免疫應答,提高機體的免疫力。

