下調miR-215-5p對TGF-β誘導的人肺成纖維細胞IMR-90增殖抑制作用觀察
杜偉,郭麗娜,龐席寧
(1 遼寧中置盛京老年病醫院,沈陽 110000;2 中國醫科大學附屬盛京醫院;3 沈陽軍區總醫院渾南分院)
肺纖維化是由多種病因引起的纖維增殖性疾病,其主要特征包括成纖維細胞異常增殖、細胞外基質沉積、炎性細胞浸潤等,最終會導致不可逆肺組織結構破壞和肺功能喪失[1]。目前對肺纖維化仍缺乏理想的治療手段,西醫治療以糖皮質激素為主,但長期應用會產生明顯的不良反應。中醫治療則主要采用辯證療法,但總體來看其治療效果仍然有限。因此,深入探討發病機制尋找有效的作用靶點對于肺纖維化的治療具有重要意義。miRNA是一類長度在19~25 bp的內源單鏈RNA分子,能夠通過對其下游靶基因的調控參與多種疾病的發生、發展,包括肺纖維化[2,3]。Huang等[4]研究發現,與對照組相比,在肺纖維化組織以及博來霉素誘導的小鼠肺纖維化組織中miR-215-5p表達均明顯升高,然而miR-215-5p是否與肺纖維化的發生有關以及其如何參與肺纖維化的進展仍未明確。2016年10月~2018年3月,本研究采用TGF-β處理體外培養的人肺成纖維細胞,在體外模擬肺纖維化的發病過程,觀察下調miR-215-5p對TGF-β誘導的人肺成纖維細胞IMR-90增殖的影響。
1 材料與方法
1.1 材料 細胞株:人肺成纖維細胞系IMR-90購自上海中喬新舟生物科技有限公司。主要試劑:EMEM細胞培養液和胎牛血清購自美國Gibco公司;Lipofectamine2000轉染試劑購自美國Invitrogen公司;陰性對照(NC)inhibitor以及miR-215-5p inhibitor購自上海吉瑪制藥技術有限公司;MTT試劑以及細胞周期檢測試劑盒購自上海碧云天生物技術有限公司;cyclinD1抗體購自武漢三鷹生物技術有限公司;α-SMA抗體購自美國Abcam公司;RB1抗體購自生工生物工程(上海)有限公司。RNA提取試劑盒以及SYBER green master mix購自天根生化科技有限公司。
1.2 細胞培養 IMR-90細胞培養于含10%胎牛血清、100 IU/mL青霉素和100 μg/mL鏈霉素的EMEM培養基中,置于5% CO2、37 ℃的細胞培養箱中培養。每2~3天傳代1次,取第12~20代的細胞進行后續實驗。
1.3 TGF-β處理與下調miR-215-5p方法 將IMR-90細胞按照3×104個/孔的細胞密度接種至6孔板,待細胞長至80%融合時進行轉染。按照Lipofectamine2000試劑盒說明書進行操作,采用終濃度為50 nmol/L的miR-215-5p inhibitor轉染細胞。實驗設置對照組、TGF-β組、TGF-β+NC inhibitor組、TGF-β+miR-215-5p inhibitor組。對照組正常培養;TGF-β組參考文獻[5],采用10 ng/mL的TGF-β處理;TGF-β+NC inhibitor組采用陰性對照inhibitor轉染24 h后采用10 ng/mL的TGF-β處理;TGF-β+miR-215-5p inhibitor組采用miR-215-5p inhibitor轉染24 h后采用10 ng/mL的TGF-β處理。
1.4 細胞增殖情況觀察 細胞分組及處理同1.3。按照3×103/孔的細胞密度將細胞接種至96孔板,在各組處理結束前4 h加入0.5 mg/mL的MTT試劑。分別在NC inhibitor或者miR-215-5p inhibitor轉染24、48、72、96 h吸除上清液,加入100 μL的DMSO溶解細胞生成的結晶。在酶標儀上測量各組在570 nm波長處的光密度值,以此代表各組細胞的增殖情況。
1.5 細胞周期檢測 細胞分組及處理同1.3。于NC inhibitor或者miR-215-5p inhibitor轉染48 h,350 g離心5 min收集各組細胞,洗滌后吸除上清。加入預冷的70%乙醇,將細胞置于4 ℃固定3 h。根據試劑盒說明書進行操作,加入25 μL的碘化丙啶染色液,將細胞置于37 ℃避光孵育45 min。染色結束后采用流式細胞儀觀察各組細胞周期變化情況。
1.6 細胞cyclinD1、RB1和α-SMA mRNA檢測 采用熒光定量PCR法。采用試劑盒提取細胞轉染48 h后各組細胞的總RNA并反轉錄成cDNA。在PCR反應管中加入1 μL 10倍稀釋的cDNA模板,上下游引物各0.5 μL,SYBER green master mix 10 μL,用雙蒸水補足總反應體積至20 μL。然后將反應管置于ExicyclerTM96 PCR儀上進行熒光定量檢測。實驗中用到的引物序列如下:cyclinD1正向引物為5′-AAACAGATCATCCGCAAACAC-3′,反向引物為5′-GTTGGGGCTCCTCAGGTTC-3′;α-SMA正向引物為5′-ACTGGGACGACATGGAAAAG-3′,反向引物為5′-AGATGGGGACATTGTGGGT-3′;RB1正向引物為5′-GGGTGATTCCTAAGCCACTTG-3′,反向引物為5′-TGGGTTATCAGGACTCCCACTC-3′;GAPDH正向引物為5′-ACCACAGTCCATGCCATCAC-3′,反向引物為5′-TCCACCACCCTGTTGCTGTA-3′。PCR反應條件:94 ℃ 5 min;94 ℃ 10 s,58 ℃ 20 s,72 ℃ 20 s,35個循環;72 ℃ 2 min;4 ℃ 5 min。以GAPDH為內參,采用2-ΔΔCt法計算各組目的mRNA相對表達量。
1.7 細胞cyclinD1、RB1和α-SMA蛋白檢測 采用Western blotting法。收集各組轉染48 h細胞,采用RIPA裂解液裂解,離心收集總蛋白,采用BCA試劑盒對蛋白進行定量。100 ℃煮沸5 min將蛋白變性后,取30 μg變性蛋白進行聚丙烯酰胺凝膠電泳,然后將蛋白電泳產物電轉移至PVDF膜上。采用5%脫脂奶粉封閉蛋白后采用TTBS洗膜3次,在雜交袋中分別加入稀釋一抗(cyclinD1 1∶5 000倍稀釋;α-SMA 1∶5 000倍稀釋;RB1 1∶1 000倍稀釋;GAPDH 1∶1 000倍稀釋),于4 ℃孵育過夜。TTBS洗膜后加入1∶10 000倍稀釋的二抗,于37 ℃孵育1 h。采用ECL試劑盒曝光膠片,按照試劑盒說明書進行操作并計算蛋白相對表達量。
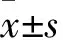
2 結果
2.1 各組細胞增殖情況比較 各組細胞增殖能力比較見表1。從轉染48 h開始,TGF-β組細胞增殖能力高于對照組(P均<0.05);與TGF-β組相比,TGF-β+NC inhibitor組細胞增殖能力沒有明顯變化(P均>0.05);然而與TGF-β+NC inhibitor組相比,TGF-β+miR-215-5p inhibitor組細胞增殖能力降低(P均<0.05)。

表1 各組細胞增殖能力比較
注:與對照組相比,aP<0.05;與TGF-β+NC inhibitor組相比,bP<0.05。
2.2 各組細胞周期變化情況比較 與對照組相比,TGF-β組G1期細胞比例降低,S期細胞比例升高(P均<0.05)。與TGF組相比,TGF-β+NC inhibitor組各個時期細胞比例均未發生變化(P均>0.05)。與TGF-β+NC inhibitor組相比,TGF-β+miR-215-5p inhibitor組G1期細胞比例增加,S期細胞比例降低(P均<0.05)。見表2。

表2 各組細胞周期變化情況比較
注:與對照組相比,aP<0.05;與TGF-β+NC inhibitor組相比,bP<0.05。
2.3 各組cyclinD1、RB1和α-SMA表達比較 與對照組相比,TGF-β組cyclinD1、α-SMA表達升高,RB1表達降低(P均<0.05)。與TGF-β組相比,TGF-β+NC inhibitor組cyclinD1、RB1和α-SMA均未發生明顯變化(P均>0.05)。與TGF-β+NC inhibitor組相比,TGF-β+miR-215-5p inhibitor組cyclinD1、α-SMA的表達下調,RB1表達升高(P均<0.05)。
3 討論
肺纖維化過程中巨噬細胞及損傷的上皮細胞會釋放大量的細胞因子,如TGF-β、IGF-1、PDGF等,促進成纖維細胞的增殖分化,誘導膠原的大量生成進而引發不可逆的肺部損傷[6,7]。其中,TGF-β是作用最強的致纖維化因子[8,9]。在TGF-β作用下肺成纖維細胞和間質細胞異常增生是肺纖維化的重要機制之一[10]。

表3 各組細胞cyclinD1、RB1和α-SMA表達比較
注:與對照組相比,aP<0.05;與TGF-β+NC inhibitor組相比,bP<0.05。
本研究采用TGF-β處理肺成纖維細胞,在體外模擬了肺纖維化過程,結果顯示,與對照組相比TGF-β組肺成纖維細胞增殖能力顯著增強,表明在TGF-β的作用下肺成纖維細胞發生了類似肺纖維化損傷,與前人研究[5]結論一致。而與TGF-β組相比,TGF-β+NC inhibitor組細胞增殖能力無顯著變化,表明轉染NC inhibitor未影響肺成纖維細胞的增殖能力。而與TGF-β+NC inhibitor組相比TGF-β+miR-215-5p inhibitor組細胞增殖能力降低,說明下調miR-215-5p能夠抑制TGF-β誘導的肺成纖維細胞增殖。
細胞的增殖周期有G1/S和G2/M兩個關鍵性限制點,細胞周期蛋白cyclinD1是細胞通過G1/S限制點的重要調節蛋白[11]。在胃癌細胞中上調miR-215-5p能夠顯著提高細胞內cyclinD1的表達并增加S期細胞的比例;相反,抑制miR-215-5p則能夠顯著降低cyclinD1表達并阻礙細胞周期的進展[12]。本研究結果顯示,與對照組相比,TGF-β組肺成纖維細胞G1期比例降低,S期比例升高,同時cyclinD1表達升高,表明TGF-β促進了細胞周期轉換。而與TGF-β組相比,TGF-β+ NC inhibitor組細胞周期未發生顯著變化,cyclinD1表達不變,表明轉染NC inhibitor不影響細胞周期轉換。與TGF-β+NC inhibitor組相比,TGF-β+miR-215-5p inhibitor組G1期細胞比例增加,S期細胞比例降低,cyclinD1表達降低,該結果提示下調miR-215-5p能夠逆轉TGF-β誘導的細胞周期轉換。我們的結果與前人研究結果一致。
RB1是細胞周期的負性調控因子,該基因因為與視網膜母細胞瘤的發生密切相關而得名。RB1能夠結合轉錄因子調節細胞增殖和分化,維持細胞生長發育的平衡[13]。在細胞內,RB1通過與E2F結合而抑制E2F的活性,進而調節細胞周期由G1期向S期的轉化。抑制RB1的活性會促使細胞進入S期,促進細胞的增殖[14]。Deng等[15]研究發現,miR-215-5p能夠結合于RB1的3′-UTR,抑制RB1的表達,進而影響胃癌細胞的周期轉換以及細胞增殖。我們的研究結果顯示,與對照組相比,TGF-β組RB1的表達顯著降低,與TGF-β組相比TGF-β+ NC inhibitor組細胞RB1的表達未發生顯著變化,表明轉染NC inhibitor不影響細胞RB1的表達水平。與TGF-β+NC inhibitor組相比,TGF-β+miR-215-5p inhibitor組細胞內RB1表達顯著降低,表明下調miR-215-5p能夠促進RB1的表達。我們推測其原因可能是由于下調miR-215-5p阻礙了miR-215-5p對RB1的靶向抑制作用,進而延緩了細胞周期轉換。
α-SMA是肌成纖維細胞的標志物,當肺部受損后肺成纖維細胞會向肌成纖維細胞轉化,而過多的肌成纖維細胞會引起肺組織過度收縮,順應性下降以及膠原的形成,最終導致纖維化[16,17]。在多種因素導致的肺纖維化過程中均能夠檢測到α-SMA的升高[18,19]。本研究結果顯示,與對照組相比,TGF-β組α-SMA表達顯著升高,表明TGF-β在體外引發了肺成纖維細胞向肌成纖維細胞的轉化。與TGF-β組相比,TGF-β+NC inhibitor組α-SMA未發生明顯變化,表明轉染NC inhibitor不影響細胞中α-SMA的表達。然而與TGF-β+NC inhibitor組相比,TGF-β+miR-215-5p inhibitor組α-SMA的表達顯著降低,表明下調miR-215-5p能夠通過阻礙肺成纖維細胞向肌成纖維細胞的轉化而緩解肺纖維化。Freytsis等[20]研究同樣發現,RB1基因敲除小鼠的主動脈瓣組織中α-SMA的表達顯著下降,然而其機制仍不明確。我們將在未來的研究中進一步探討其具體機制。
綜上可見,下調miR-215-5p能夠抑制RB1表達進而下調cyclinD1,阻礙TGF-β誘導的肺成纖維細胞的周期轉換進而抑制肺成纖維細胞的增殖;同時,下調miR-215-5p也能夠抑制α-SMA的表達阻礙TGF-β誘導的肺成纖維細胞向肌成纖維細胞轉化。抑制miR-215-5p具有緩解肺纖維化的潛力,miR-215-5p可以作為肺纖維化的治療靶點。

