胃泌素釋放肽前體及胃蛋白酶原與胃息肉的相關性研究
劉姍 馮玉良 鄭培奮?
胃息肉是胃鏡檢查最常發現的病變之一,由胃黏膜上皮或腺體過度增生形成[1]。亞洲國家胃息肉主要以增生性息肉和胃底腺息肉為主[2],但國內相關報道較少。有研究顯示,有2%~19%的增生性息肉發生異型增生,0.6%~2%伴隨同時性胃癌[3]。胃泌素釋放肽前體(ProGRP)是胃泌素釋放肽基因編碼的產物,在血漿中穩定表達,能反映胃泌素釋放肽的水平。胃泌素釋放肽刺激胃竇G細胞分泌胃泌素,可能通過影響細胞增殖、凋亡、遷移、血管形成等,促進胃上皮腫瘤形成[4]。本文分析胃息肉患者內鏡下息肉切除術后血清ProGRP及胃蛋白酶原的變化,現報道如下。
1 臨床資料
1.1 一般資料 選擇2017年1月至6月本院行胃鏡檢查的患者120例。排除:(1)因患者不耐受或其他原因未完成胃鏡檢查。(2)既往有胃癌、胃手術史。(3)胃鏡及病理活組織檢查證實存在癌變。(4)1個月內曾接受過質子泵抑制劑、鉍劑、抗生素等藥物治療。(5)幽門螺旋桿菌感染。(6)有嚴重心、腎、肝、肺等疾病患者。胃息肉診斷標準:胃息肉胃鏡下表現為由胃黏膜面突起到胃腔的一種隆起性病變,病理組織學提示增生性、腺瘤性息肉、炎性息肉、胃底腺息肉。幽門螺旋桿菌(HP)感染診斷標準:14C呼氣試驗>100Dpm。診斷胃息肉患者60例,男28例,女32例;平均年齡(62.74±8.59)歲。無胃息肉者(胃鏡檢查提示非萎縮性胃炎及大致正常胃黏膜)60例,男27例,女33例;平均年齡(61.01±9.30)歲。兩組性別、年齡,差異無統計學意義。本項目經本院醫學倫理委員會批準,所有患者均簽署知情同意書。
1.2 方法 所有患者均于清晨空腹狀態下進行胃鏡檢查并取活組織病理檢查,組織學標本固定于10%的甲醛溶液中,常規石蠟包埋、切片、HE染色后行組織學評價與分類。抽取肘靜脈血檢測ProGRP、PGI、PGII水平,14C呼氣試驗檢測HP感染情況、比較兩組血清ProGRP、PGI、PGII水平及PGI/PGII差異。觀察組患者接受內鏡下息肉摘除術后6個月時復查胃鏡,根據內鏡下胃息肉切除術后是否有息肉復發將觀察組分為治愈組及復發組,比較息肉切除前后血清ProGRP、PGI、PGII水平及PGI/PGII差異。檢查均由有經驗的消化內科醫師進行操作,ProGRP、PGI、PGII均采用酶聯免疫吸附測定檢測,ProGRP測定采用ProGRP定量試劑盒,PGI、PGII采用胃蛋白酶原定量試劑盒。
1.3 統計學方法 采用SPSS19.0統計統計。計量資料以()表示,用t檢驗,計數資料比較用χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 胃息肉部位及組織學類型 發生在胃竇的增生性息肉35例,占58.3 %,發生在胃體及胃底的增生性息肉10例,占16.7 %,腺瘤性息肉15例,占25%。
2.2 胃息肉組與對照組ProGRP、PG水平比較 見表1。
表1 兩組患者ProGRP、PG水平比較()

表1 兩組患者ProGRP、PG水平比較()
組別 ProGRP(pg/ml) PGI(ng/ml) PGII(ng/ml) PGI/PGII觀察組(n=60) 105.88±18.10 128.82±16.58 16.62±1.59 7.77±0.84對照組(n=60) 59.74±13.89 81.13±8.55 7.40±1.45 11.34±2.53 t值 161.691 229.079 343.753 -93.190 P值 <0.001 <0.001 <0.001 <0.001
2.3 不同病理類型胃息肉患者ProGRP、PG水平比較 見表2。
表2 不同病理類型胃息肉患者ProGRP、PPGI/PGII G水平比較()
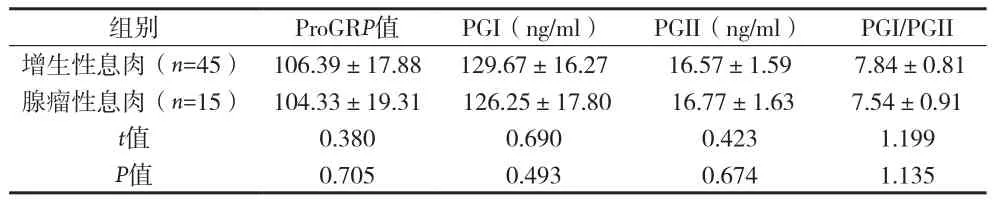
表2 不同病理類型胃息肉患者ProGRP、PPGI/PGII G水平比較()
組別 ProGRP值 PGI(ng/ml) PGII(ng/ml) PGI/PGII增生性息肉(n=45) 106.39±17.88 129.67±16.27 16.57±1.59 7.84±0.81腺瘤性息肉(n=15) 104.33±19.31 126.25±17.80 16.77±1.63 7.54±0.91 t值 0.380 0.690 0.423 1.199 P值 0.705 0.493 0.674 1.135
2.4 復發組與未復發組患者治療前后ProGRP、PG水平比較 見表3。
表3 復發組與未復發組患者治療前后ProGRP、PG水平比較()

表3 復發組與未復發組患者治療前后ProGRP、PG水平比較()
組別 時間 ProGRP(pg/ml) PGI(ng/ml) PGII(ng/ml) PGI/PGII復發組 治療前 100.41±10.63 131.00±10.35 16.39±1.69 8.02±0.69(n=14) 治療后 103.39±11.53 128.57±16.15 16.23±1.63 7.94±0.76 t值 -0.615 0.405 0.247 0.285 P值 0.544 0.689 0.807 0.778未復發組 治療前 107.39±19.22 128.21±16.92 16.69±1.54 7.70±0.86(n=47) 治療后 83.41±16.15 107.76±15.71 11.40±1.28 9.48±1.16 t值 6.476 6.009 17.890 -8.374 P值 0.001 0.001 0.001 0.001
3 討論
胃息肉為胃癌的癌前病變,發病率正逐年升高,但關于胃息肉發生癌變的具體機制目前尚不完全清楚,可能與幽門螺旋桿菌感染、長期使用質子泵抑制劑、遺傳與環境、膽汁反流等多種因素有關[5]。胃泌素釋放肽是一種重要的胃腸肽類激素,刺激胃竇G細胞分泌胃泌素,在胃腸道疾病,尤其是胃腸道腫瘤的發生發展中具有重要作用[6-7]。INS-GAS小鼠的動物實驗研究表明,高胃泌素血癥能促進胃腺癌發生發展[8]。胃泌素釋放肽半衰期較短,臨床通常采用檢測血清ProGRP反映胃泌素釋放肽水平。PG為胃蛋白酶前體,分為PGI和PGII兩種亞型,PGI由胃底黏膜的主細胞和黏液頸細胞分泌,PGII由賁門、胃底、胃竇、十二指腸近端黏膜分泌,兩者經胃酸活化后形成胃蛋白酶,在分解蛋白質中具有重要作用,是診斷胃部疾病的重要血清學標志物[9]。血清胃蛋白酶原水平反映胃黏膜腺體和細胞的數量,體現了胃黏膜的形態及分泌功能[10]。目前臨床長期使用質子泵抑制劑、幽門螺旋桿菌根除失敗率增加,胃息肉的患病率也逐年升高。研究表明,在胃酸抑制狀態及幽門螺旋桿菌感染時胃泌素分泌增加[11]。本資料顯示胃息肉患者血清ProGRP、PGI、PGII水平較正常對照組明顯升高,PGI/PGII比值降低。而內鏡下息肉切除術后血清ProGRP、PGI、PGII水平較治療前下降、PGI/PGII比值升高。提示胃息肉患者血清ProGRP、PG水平異常,可能與胃息肉的發病相關。胃炎狀態下ProGRP水平升高,促進胃泌素分泌增加,胃竇G細胞周圍的細胞因子釋放增加[12]。高胃泌素血癥促使胃腺體囊狀擴張,形成息肉。血清PG水平受胃黏膜病理生理狀態影響,與胃炎嚴重程度、胃萎縮程度有關[13]。血清ProGRP、PG 可能通過改變胃內pH值,促進白介素-1、細胞生長因子等多種促炎細胞因子的釋放,損害胃黏膜屏障,使胃黏膜長期處于炎癥狀態,引起胃黏膜萎縮。胃息肉與胃黏膜炎癥、萎縮等組織學病變相關。ProGRP、PG可能通過以上機制,促進胃息肉的發生。此外,不同病理類型胃息肉患者血清ProGRP、PGI、PGII水平差異均無統計學意義,提示血清ProGRP、PG水平可能與胃息肉病理類型無關,也可能與本研究樣本量等因素有關。
總之,胃息肉患者血清ProGRP、PG水平明顯升高,進一步研究血清ProGRP、PG與胃息肉發生的機制,可為深入探究胃息肉的發病機制及早期診斷,對于胃息肉癌變的早期干預和臨床治療具有重要意義。

