黑曲霉葡萄糖氧化酶基因改造及其在畢赤酵母中的表達(dá)
聶金梅, 李陽(yáng)源, 劉金山, 王 勇, 唐 業(yè)
(廣東溢多利生物科技股份有限公司,廣東珠海 519060)
葡萄糖氧化酶(glucose oxidase,GOD),能專(zhuān)一地氧化β-D-葡萄糖成為葡萄糖酸和過(guò)氧化氫,反應(yīng)產(chǎn)物葡萄糖酸可降低胃腸內(nèi)pH值,為乳酸菌生長(zhǎng)制造酸性環(huán)境。反應(yīng)生成的過(guò)氧化氫具有滅菌作用,當(dāng)過(guò)氧化氫積累到一定濃度時(shí),直接抑制大腸桿菌、沙門(mén)氏菌、巴氏桿菌、葡萄球菌和弧菌的生長(zhǎng)繁殖。因?yàn)榫哂刑烊粺o(wú)毒副作用的獨(dú)特優(yōu)點(diǎn),葡萄糖氧化酶被廣泛應(yīng)用于食品加工、醫(yī)藥、葡萄糖定量分析及生物領(lǐng)域[1-3]。許多研究者對(duì)該酶的性質(zhì)做了大量的工作,尤其對(duì)葡萄糖氧化酶的輔基黃素腺嘌呤二核苷酸(FAD)作了深入的研究[4],并給予詳細(xì)的說(shuō)明。Bentley等應(yīng)用同位素18O2和H218O明確了在有過(guò)氧化氫酶存在下的一系列試驗(yàn)[5];Keilin等對(duì)黑曲霉的葡萄糖氧化酶的動(dòng)力學(xué)及其作用形式也作了較詳細(xì)的研究[6]。
葡萄糖氧化酶不僅能夠代替抗菌藥物,而且還能代替抗球蟲(chóng)藥物,是一種新型綠色飼料添加劑。它還能除去葡萄糖,以防蛋白成品在貯藏期間變色、變質(zhì)。用于全脂奶粉、谷物、可可、咖啡、蝦類(lèi)、肉等食品,可防止由葡萄糖引起的褐變。用于柑橘類(lèi)飲料及啤酒等的脫氧,以防色澤增深、降低風(fēng)味和金屬溶出。由于葡萄糖氧化酶催化底物所生成的H2O2能使面筋中的-SH基氧化成S-S-基,有助于面筋蛋白之間形成較好的蛋白質(zhì)網(wǎng)絡(luò)結(jié)構(gòu),故近年來(lái)用于面包制造的效果良好,可用以代替可致癌的溴酸鉀,受到愈來(lái)愈多的重視。此外,工業(yè)上還將葡萄糖氧化酶用于生產(chǎn)葡萄糖酸鹽。
本研究克隆了來(lái)源于黑曲霉(Aspergillusniger)的葡萄糖氧化酶全長(zhǎng)基因,綜合運(yùn)用了定點(diǎn)突變法、重疊PCR法獲得了含突變基因的葡萄糖氧化酶基因,本研究首次去除葡萄糖氧化酶基因的信號(hào)肽,構(gòu)建并篩選葡萄糖氧化酶畢赤酵母工程菌株的產(chǎn)酶活性有顯著提高,為實(shí)現(xiàn)葡萄糖氧化酶工業(yè)化生產(chǎn)提供一種切實(shí)可行的方法。
1 材料與方法
1.1 材料
1.1.1 菌種 采用本實(shí)驗(yàn)室保存的黑曲霉。
1.1.2 儀器設(shè)備 基因擴(kuò)增儀購(gòu)于HEMA,電泳儀購(gòu)于北京君意,基因?qū)雰x購(gòu)于Bio-rad,TG16-WS臺(tái)式高速離心機(jī)、核酸蛋白凝膠圖像分析系統(tǒng)購(gòu)于HEMA,酶標(biāo)儀購(gòu)于Molecular devices,紫外分光光度計(jì)carybo UV-vis購(gòu)于安捷倫公司。
1.1.3 主要試劑 限制性?xún)?nèi)切酶和連接酶購(gòu)于NEB公司;酵母粉(OXFORD)、蛋白胨(OXFORD)、抗生素Zeocin&Amp購(gòu)于Invitrogen公司;感受態(tài)細(xì)胞制備試劑盒購(gòu)于上海生工生物工程有限公司;其他試劑均為國(guó)產(chǎn)分析純產(chǎn)品。
1.1.4 培養(yǎng)基 大腸桿菌培養(yǎng)基為L(zhǎng)B,LBA為L(zhǎng)B培養(yǎng)基加100 μg/mL氨芐青霉素,LBZ為L(zhǎng)B培養(yǎng)基加25 μg/mL Zeocin。酵母培養(yǎng)基為YPD,酵母篩選培養(yǎng)基為YPDZ(YPD+100 μg/mL Zeocin),BMGY酵母誘導(dǎo)培養(yǎng)基和BMMY(除了以0.5%甲醇代替甘油,其余成分與BMGY相同)。
1.1.5 酶活性定義 在pH值為5.5、溫度為37 ℃的條件下,每分鐘能把1.0 μmol的β-D-葡萄糖氧化成D-葡萄糖酸和H2O2所需的酶量稱(chēng)為1個(gè)酶活性單位(U)。
1.2 測(cè)定葡萄糖氧化酶活性方法
鄰聯(lián)(二)茴香胺分光光度法:在有氧條件下,葡萄糖氧化酶催化葡萄糖脫氫產(chǎn)生葡萄糖酸和過(guò)氧化氫,在辣根過(guò)氧化物酶作用下,過(guò)氧化氫和鄰聯(lián)(二)茴香胺反應(yīng),生成水和紅色的氧化型鄰聯(lián)茴香胺。加入2 mol/L硫酸終止反應(yīng),在 540 nm 下測(cè)定反應(yīng)液吸光值,依據(jù)酶活力標(biāo)準(zhǔn)曲線,從而換算為葡萄糖氧化酶的活性。
1.3 試驗(yàn)方法
1.3.1 表達(dá)載體的構(gòu)建 首先根據(jù)葡萄糖氧化酶全基因序列,設(shè)計(jì)引物GODF/GODR、GODF(mut)/GODR(mut)(表1)。

表1 本研究所用引物序列
1.3.2 提取黑曲霉基因組 本試驗(yàn)所用的黑曲霉保藏編號(hào)是:CGMCC NO.4235,用察氏培養(yǎng)基培養(yǎng),紗布過(guò)濾培養(yǎng)液,稱(chēng)取100 mg菌體,用液氮研細(xì),加入到經(jīng)65 ℃預(yù)熱的裝有700 μL PCB溶液的1.5 mL EP管中,混勻,再加入7 μLβ-巰基乙醇。其余操作參照真菌基因組DNA抽提試劑盒。將黑曲霉基因組置于-20 ℃保存。
1.3.3 克隆葡萄糖氧化酶基因 以黑曲霉基因組作為模板、引物GODF/GODR,通過(guò)PCR方法克隆葡萄糖氧化酶基因,PCR共35個(gè)循環(huán),其中98 ℃ 30 s,98 ℃ 10 s,58 ℃ 30 s,72 ℃90 s,72 ℃ 120 s;經(jīng)1%瓊脂糖凝膠電泳分析,切膠回收約 1.8 kb 的片段。
1.3.4 定點(diǎn)突變法和重疊PCR法 本研究將GOD基因序列中的GAATTC序列突變?yōu)镚AGTTC,針對(duì)該位點(diǎn)設(shè)計(jì)了1對(duì)突變引物GODF(mut)/GODR(mut),采用重疊PCR方法擴(kuò)增其編碼區(qū)基因序列。重疊PCR分PCR1和PCR2兩步進(jìn)行,擴(kuò)增條件如下:
PCR共30個(gè)循環(huán),其中94 ℃ 5 min,94 ℃ 1 min, 61 ℃1 min,72 ℃ 2 min,72 ℃ 5 min。將PCR產(chǎn)物用1%濃度的瓊脂糖凝膠進(jìn)行電泳分析,分別切膠回收大小約為 0.96 kb 和0.88 kb的基因片段并純化,置于-20 ℃保存,具體操作參照PCR純化試劑盒。取5 μL純化后的PCR產(chǎn)物進(jìn)行瓊脂糖電泳分析。以上述PCR1和PCR2產(chǎn)物片段為模板和引物,進(jìn)行PCR擴(kuò)增,PCR3共18個(gè)循環(huán),其中94 ℃ 5 min,94 ℃ 1 min, 61 ℃ 1 min,72 ℃ 4 min,72 ℃ 5 min。以PCR3產(chǎn)物為模板,以GODF及GODR為引物,進(jìn)行PCR擴(kuò)增,PCR4共40個(gè)循環(huán),其中94 ℃ 5 min,94 ℃ 1 min, 61 ℃ 1 min,72 ℃ 4 min,72 ℃ 5 min。將PCR4產(chǎn)物用1%瓊脂糖凝膠進(jìn)行電泳分析,并切膠回收大小約1.8 kb基因片段,置于-20 ℃保存。取 5 μL 純化后的DNA進(jìn)行瓊脂糖電泳分析。
取葡萄糖氧化酶突變基因GODmut以及pPICZαA各 20 μL,用NotⅠ和EcoRⅠ雙酶切,37 ℃,3 h,T4連接酶連接,4 ℃ 過(guò)夜,轉(zhuǎn)化大腸桿菌Top10。轉(zhuǎn)化步驟如下:冰上放置 30 min,42 ℃孵育90 s,冰上放置20 min,加1 mL LB培養(yǎng)基后37 ℃振蕩培養(yǎng)1 h,涂布LBZ平板,37 ℃培養(yǎng)過(guò)夜,挑取單菌落共20個(gè),采用菌落PCR法鑒定陽(yáng)性克隆子,菌落PCR條件如下:反應(yīng)條件為94 ℃ 4 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min,72 ℃ 10 min,30個(gè)循環(huán)。取10 μL PCR產(chǎn)物進(jìn)行瓊脂糖凝膠電泳分析。對(duì)陽(yáng)性克隆進(jìn)行酶切鑒定以及測(cè)序序列,DNA測(cè)序由華大基因完成。
1.3.5 去除葡萄糖氧化酶基因的信號(hào)肽 去除葡萄糖氧化酶基因序列中的信號(hào)肽,設(shè)計(jì)上游引物GODECONS,以葡萄糖氧化酶突變基因(GODmut)為模板、引物GODECONS/GODR擴(kuò)增GODnew基因,經(jīng)1%瓊脂糖凝膠電泳分析,切膠回收約1.75 ku的片段。采用上述試驗(yàn)方法,酶切連接,轉(zhuǎn)化及鑒定。
1.3.6 構(gòu)建葡萄糖氧化酶畢赤酵母工程菌株 將重組質(zhì)粒用限制性?xún)?nèi)切酶PmeI線性化,采用電擊法將線性化的重組質(zhì)粒轉(zhuǎn)化至畢赤酵母X33,涂布于YPDZ平板,30 ℃下靜置培養(yǎng)2~3 d,直至長(zhǎng)出單菌落。
1.3.7 篩選高效分泌表達(dá)的葡萄糖氧化酶畢赤酵母工程菌株 挑取單菌落接種于裝有5 mL BMGY的50 mL離心管中,于28~30 ℃、200 r/min培養(yǎng),直到細(xì)胞密度達(dá)108(D600 nm為 1.2~1.6)時(shí),添加甲醇至終溶度為0.6%,每隔24 h補(bǔ)加甲醇并留樣,采用測(cè)定酶活性的方法初步篩選高產(chǎn)菌株,再以1%的量接種至裝有50 mL BMGY的500 mL三角瓶中,用雙層紗布封口,于28~30 ℃、200 r/min的搖床培養(yǎng),復(fù)篩,分別得到高效分泌表達(dá)的葡萄糖氧化酶突變基因工程菌株和新葡萄糖氧化酶基因工程菌株各1株,將它們分別命名為X33-PIC-GODmut和X33-PIC-GODnew。
1.3.8 中試試驗(yàn) 50 L液體發(fā)酵罐采用蒸汽滅菌,發(fā)酵原料20 L,加水量為16 L,121 ℃滅菌24 min,然后冷卻至室溫;制備YPD液體種1 L,分為8瓶裝,125 mL/瓶,接種葡萄糖氧化酶畢赤酵母菌株,220 r/min、30 ℃培養(yǎng)24 h;待發(fā)酵液冷卻至室溫后,接種菌液1 L。將上述工程菌株進(jìn)行高密度發(fā)酵培養(yǎng)。配置20 L基本鹽培養(yǎng)基,在50 L自動(dòng)控制發(fā)酵罐中滅菌后,冷卻至常溫備用。用氨水和磷酸調(diào)節(jié)發(fā)酵液的pH值至6.0,通過(guò)調(diào)節(jié)轉(zhuǎn)速和空氣流量控制溶氧大于30%,發(fā)酵溫度為30 ℃。整個(gè)發(fā)酵過(guò)程分3個(gè)階段:第一階段為菌體培養(yǎng)階段,將重組菌X33-PIC-GODmut和X33-PIC-GODnew按照10%的接種量接種至發(fā)酵罐中,流加已滅菌的4 L 50%葡萄糖,培養(yǎng)24~30 h,以補(bǔ)充完葡萄糖為標(biāo)志;第二階段為饑餓階段,當(dāng)葡萄糖補(bǔ)完之后,不流加任何碳源,當(dāng)溶氧上升至80%以上即表明該階段結(jié)束,需30~60 min;第三階段為誘導(dǎo)表達(dá)階段,在此階段,流加誘導(dǎo)培養(yǎng)基,并且保持溶氧在20%以上,培養(yǎng)時(shí)間在180~200 h之間。發(fā)酵液可通過(guò)陶瓷膜或超濾膜處理后獲得酶液。在發(fā)酵過(guò)程中的不同時(shí)間點(diǎn)取樣測(cè)定酶活。同樣發(fā)酵條件下,將本實(shí)驗(yàn)室保藏的改造信號(hào)肽之前的葡萄糖氧化酶畢赤酵母菌株進(jìn)行高密度發(fā)酵培養(yǎng),誘導(dǎo)培養(yǎng)185 h的發(fā)酵液的酶活性為由原來(lái)的460.3 U/mL提高到了 714.9 U/mL。說(shuō)明信號(hào)肽改造后的葡萄糖氧化酶畢赤酵母菌株能明顯地提高了葡萄糖氧化酶的表達(dá)水平。
1.3.9 葡萄糖氧化酶活性分析 采用酶活力測(cè)定方法,在pH值為5.5的條件下,分別在30、35、40、45、50、55、60、65、70、80 ℃測(cè)定酶的活力;在37 ℃的條件下,分別在pH值為3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0時(shí)測(cè)定酶的活力;在測(cè)定葡萄糖氧化酶活性的體系中,加入20 mmol/L金屬離子磷酸鹽緩沖液溶解(pH值=5.0)至金屬離子的終濃度為2 mmol/L,測(cè)定葡萄糖氧化酶的活性。
1.3.10 葡萄糖氧化酶SDS-PAGE蛋白電泳 制備濃度為5%的濃縮膠,凝固后,再加入12%的蛋白分離膠,收集工程菌株X33-pPIC-GODmut和X33-pPIC-GODnew185 h的發(fā)酵上清液,分別稀釋12倍和15倍后,加入5×loading buffer,煮沸5 min使蛋白變性,電泳條件:電壓100 V、2 h,用染色液染色2 h后,再用脫色液脫色至條帶顯色清晰。
2 結(jié)果與分析
2.1 葡萄糖氧化酶突變基因誘導(dǎo)表達(dá)載體的構(gòu)建及鑒定
本試驗(yàn)克隆的葡萄糖氧化酶基因全長(zhǎng)1 818 bp(圖1),編碼605個(gè)氨基酸,測(cè)序結(jié)果表明,它與登錄號(hào)為FJ979866.1的基因完全一致,利用重疊PCR法擴(kuò)增出含突變位點(diǎn)的2段葡糖糖氧化酶基因PCR1和PCR2,大小分別為960 bp和 880 bp(圖2);構(gòu)建重組質(zhì)粒pPIC-GODmut,轉(zhuǎn)化至Top10感受態(tài)細(xì)胞,利用通用引物5′AOX和3′AOX進(jìn)行菌落PCR鑒定陽(yáng)性轉(zhuǎn)化子,結(jié)果如圖3所示。
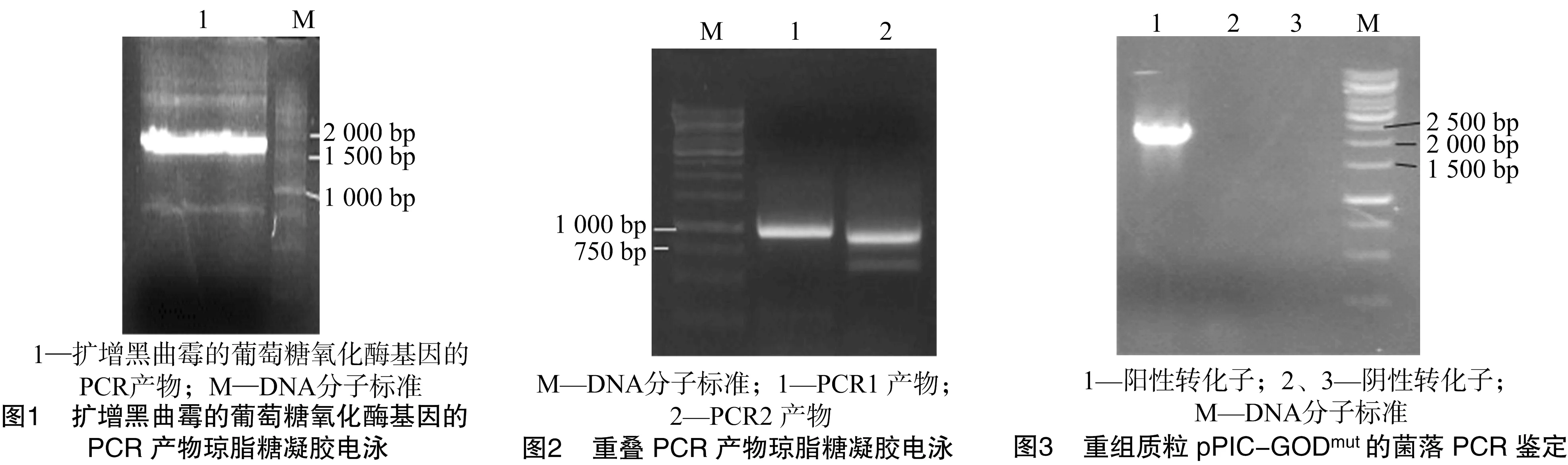
克隆新型葡萄糖氧化酶基因,大小為1 752 bp(圖4)。利用特征引物GODECONS和GODR進(jìn)行菌落PCR鑒定陽(yáng)性轉(zhuǎn)化子,結(jié)果如圖5所示。
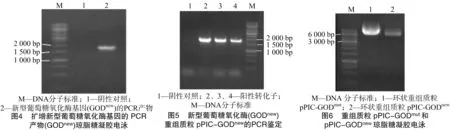
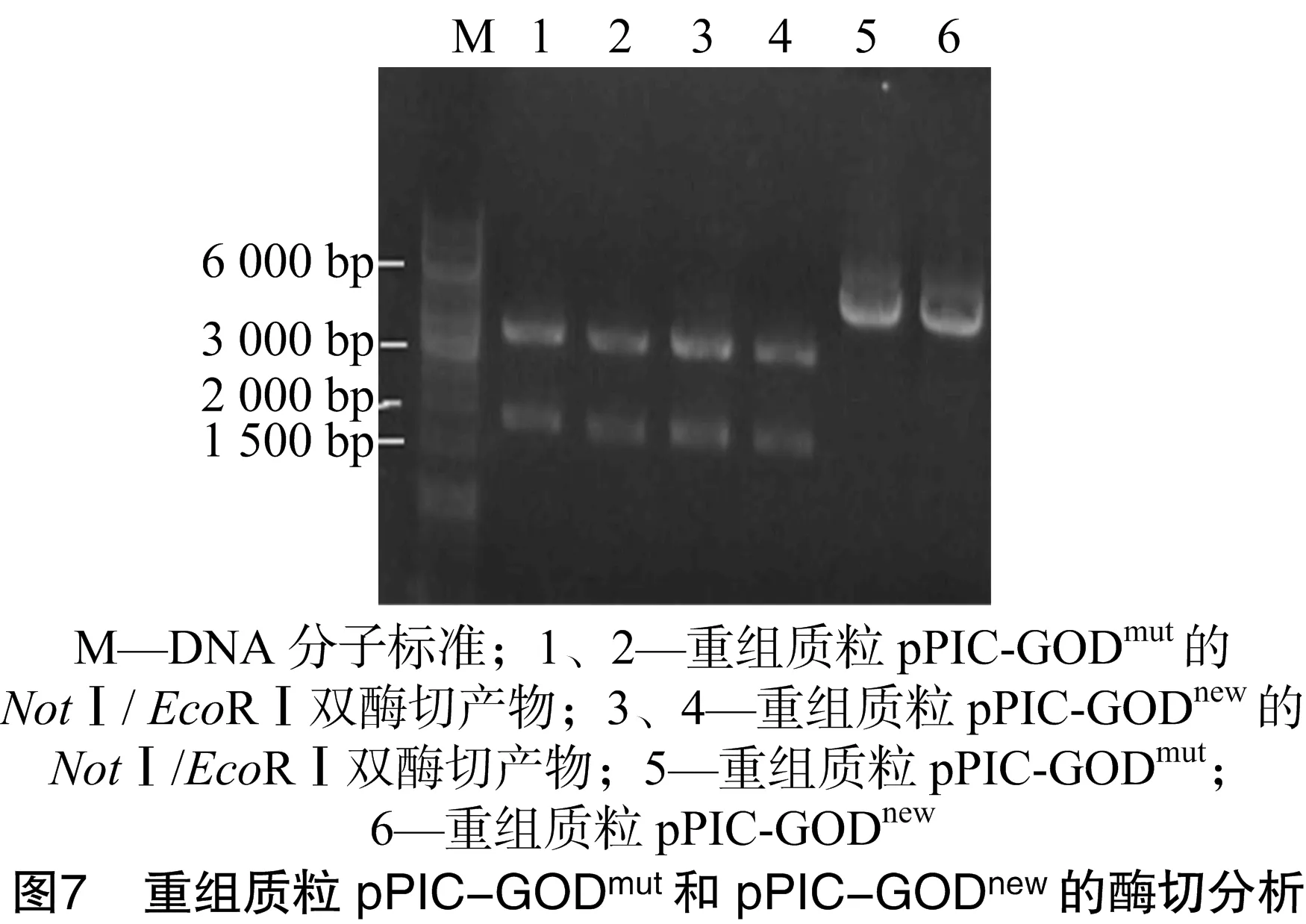
提取重組質(zhì)粒pPIC-GODmut和pPIC-GODnew,用瓊脂糖凝膠電泳鑒定(圖6)和NotⅠ和EcoRⅠ酶切鑒定(圖7),測(cè)序結(jié)果都表明成功構(gòu)建重組質(zhì)粒。
2.2 重組畢赤酵母表達(dá)菌株的誘導(dǎo)表達(dá)
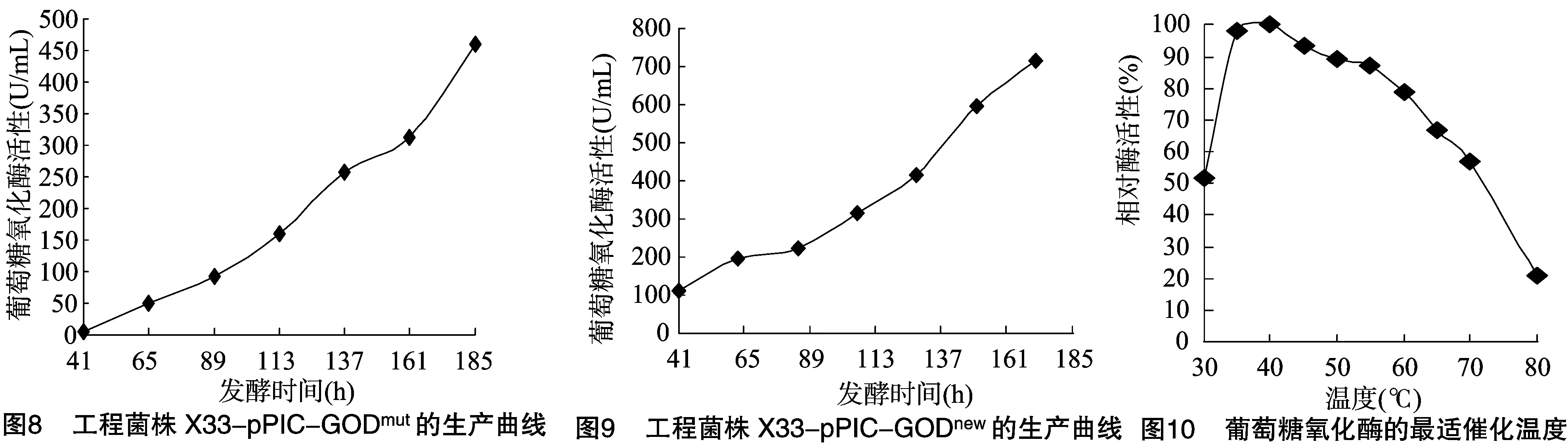
將篩選得到的高效分泌表達(dá)的工程菌株X33-pPIC-GODmut和X33-pPIC-GODnew,分別利用50 L液體發(fā)酵罐進(jìn)行高密度培養(yǎng),每24 h取樣1次,測(cè)定葡萄糖氧化酶活性,發(fā)酵至185 h,X33-pPIC-GODmut的產(chǎn)酶水平為460.3 U/mL,X33-pPIC-GODnew的產(chǎn)酶水平為714.9 U/mL(圖8、圖9)。
2.3 葡萄糖氧化酶酶學(xué)性質(zhì)分析
2.3.1 最適催化溫度 在pH值為5.0的條件下,分別在30、35、40、45、50、55、60、65、70、80 ℃測(cè)定酶的活力,40 ℃時(shí)酶活力最高。以pH值5.0、40 ℃條件測(cè)定的酶活力為100%,80 ℃時(shí)酶活力急劇下降,僅為最高酶活力的20.9%(圖10)。
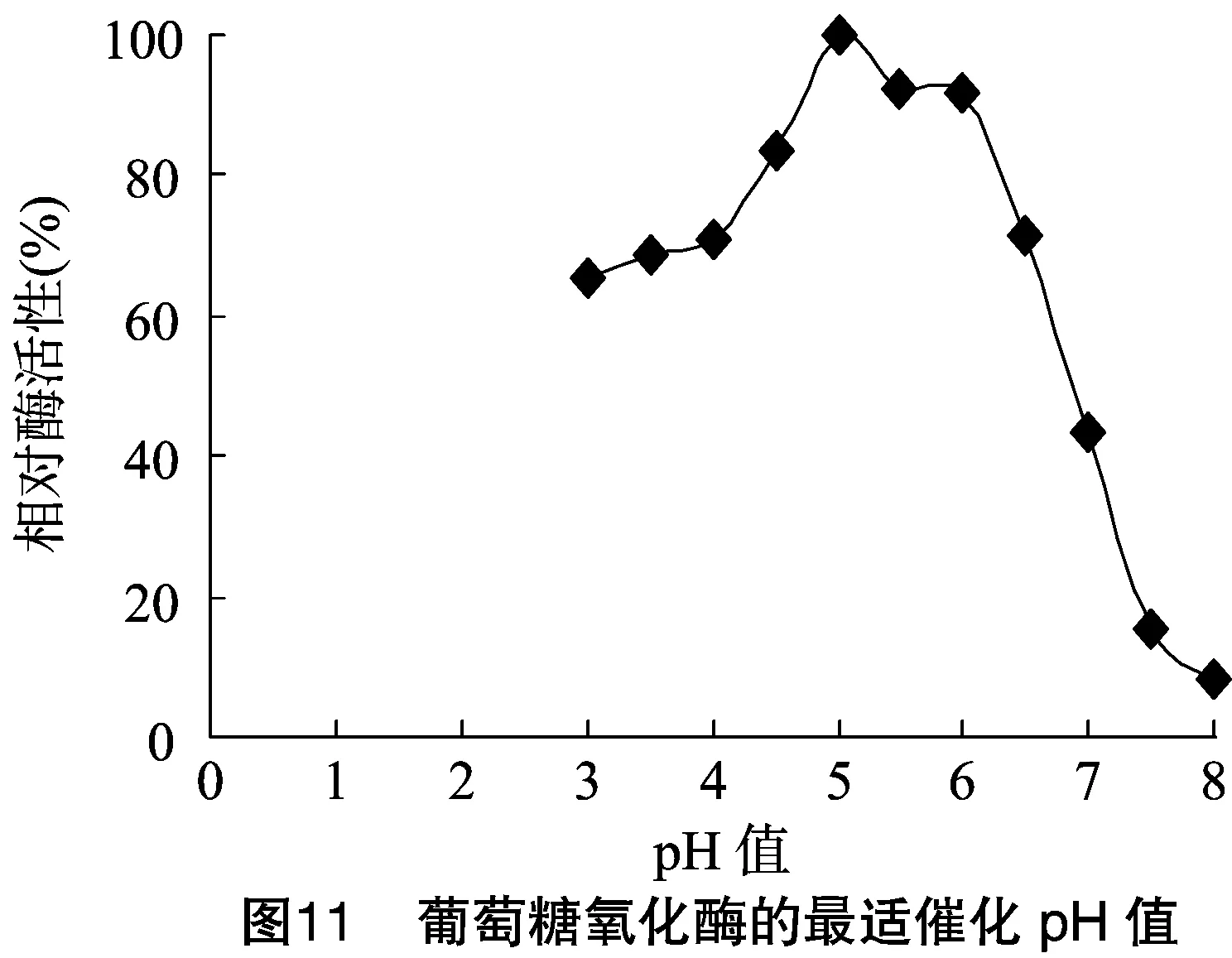
2.3.2 最適催化pH值 在37 ℃的條件下,分別在pH值為3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0時(shí)測(cè)定酶的活力,結(jié)果顯示,在pH值為5.0時(shí)酶活力最高。以40 ℃、pH值5.0時(shí)酶活力為100%,pH值為3.0~6.0時(shí)相對(duì)酶活在50%以上,但在pH值為7.5時(shí),相對(duì)酶活性低于20%(圖11)。
2.3.3 金屬離子及乙二胺四乙酸(EDTA)對(duì)葡萄糖氧化酶催化活性的影響 采用酶活力測(cè)定方法,在測(cè)定葡萄糖氧化酶活性的體系中,加入20 mmol/L金屬離子磷酸鹽緩沖液溶解(pH值=6.0),至金屬離子的終濃度為2 mmol/L,測(cè)定葡萄糖氧化酶的相對(duì)活力,進(jìn)行3組平行試驗(yàn),以未加入任何金屬離子的葡萄糖氧化酶溶液作為對(duì)照組,結(jié)果如圖12所示。
2.4 葡萄糖氧化酶發(fā)酵上清液蛋白電泳分析
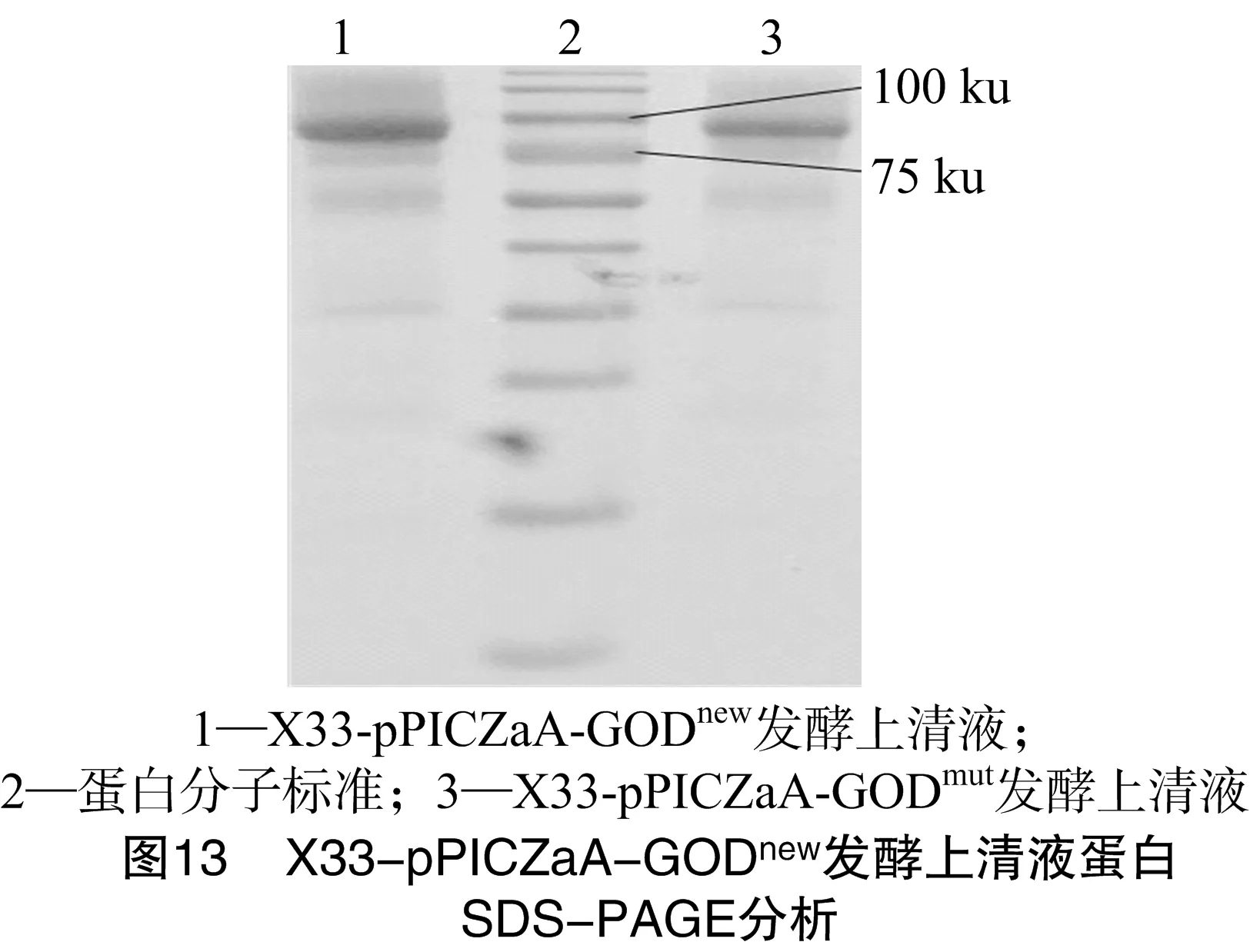
將發(fā)酵上清液煮沸使其失活后,進(jìn)行蛋白電泳分析,上樣量均為30 μL,葡萄糖氧化酶大小為80 ku左右,結(jié)果如圖13所示。

3 討論
從黑曲霉(Aspergillusniger)分離的葡萄糖氧化酶是二聚體,由2個(gè)相等的亞基單元組成,每個(gè)分子量為80 ku。每個(gè)亞基單元含有1個(gè)黃素腺嘌呤的二核苷酸部分和1個(gè)鐵。該酶是一種糖蛋白,含有16%的中性糖和2%的氨基糖。該酶也包含3個(gè)半胱氨酸殘基和8個(gè)潛在的N-連接糖基化位點(diǎn)。葡萄糖氧化酶極具商業(yè)開(kāi)發(fā)潛力,但其構(gòu)象不穩(wěn)定的特點(diǎn)大大限制了葡萄糖氧化酶的研究及應(yīng)用。葡萄糖氧化酶的動(dòng)力學(xué)特性以及其熱穩(wěn)定性,在很大程度上依賴(lài)它的氧化還原狀態(tài)。蛋白的糖基化可影響活性位點(diǎn)的構(gòu)象動(dòng)力學(xué)并最終影響酶的活性[7],但糖基化以何種途徑影響葡萄糖氧化酶穩(wěn)定性目前尚不十分清楚。此外,葡萄糖氧化酶表面經(jīng)合成的聚乙烯·乙二醇長(zhǎng)鏈修飾后,其熔點(diǎn)升高,并且體外添加多元醇,如山梨醇或丙三醇,也可顯著升高葡萄糖氧化酶的熔點(diǎn)。報(bào)道指出,黑曲霉葡萄糖氧化酶比青霉菌葡萄糖氧化酶更加穩(wěn)定,但是青霉菌葡萄糖氧化酶的底物親和力是黑曲霉葡萄糖氧化酶的7倍,其催化速率也接近黑曲霉葡萄糖氧化酶的4倍[8-10]。
本研究去除信號(hào)肽大小為69 bp,測(cè)定發(fā)酵上清液的酶活性結(jié)果表明,信號(hào)肽對(duì)葡萄糖氧化酶的活性產(chǎn)生很大的影響,究其原因是信號(hào)肽對(duì)分子構(gòu)象的影響,所以,進(jìn)一步研究其構(gòu)象的變化有利于清晰掌握葡萄糖氧化酶的結(jié)構(gòu)與酶學(xué)性質(zhì)之間的關(guān)系,為深入研究和應(yīng)用葡萄糖氧化酶提供理論基礎(chǔ)。
4 結(jié)論
本研究通過(guò)改造黑曲霉葡萄糖氧化酶基因,提高了葡萄糖氧化酶在畢赤酵母表達(dá)系統(tǒng)的產(chǎn)酶水平,目前正在對(duì)黑曲霉葡萄糖氧化酶基因針對(duì)畢赤酵母密碼子偏好性進(jìn)行優(yōu)化,構(gòu)建優(yōu)化后的黑曲霉葡萄糖氧化酶畢赤酵母基因工程菌株,以期獲得產(chǎn)酶水平更高的工程菌株,并初步研究葡萄糖氧化酶分子結(jié)構(gòu)對(duì)其活性的影響。
- 江蘇農(nóng)業(yè)科學(xué)的其它文章
- 金融知識(shí)與農(nóng)村居民消費(fèi)金融行為
——基于江蘇省昆山市陸楊鎮(zhèn)的調(diào)查 - 蘇南家庭農(nóng)場(chǎng)深化發(fā)展影響因素及提升研究
- 創(chuàng)業(yè)政策對(duì)新生代農(nóng)民工創(chuàng)業(yè)意愿和行為的差異化影響
- 休閑農(nóng)業(yè)旅游線路創(chuàng)意設(shè)計(jì)的探析
——基于“洞庭春曉-蘇州太湖休閑農(nóng)業(yè)之旅”的案例 - 硝化抑制劑DCD和NP對(duì)溫室菜田土壤氮素轉(zhuǎn)化及N2O、CO2排放的影響
- 湘東第四紀(jì)紅土發(fā)育水稻土在中國(guó)土壤系統(tǒng)分類(lèi)中的歸屬

