羊草種子萌發相關基因的篩選及表達分析
劉書,劉盼盼,楊偉光,齊冬梅,李曉霞*,劉公社*
(1.中國科學院植物研究所,北京 100093;2.中國科學院大學,北京 100049;3.黑龍江省畜牧研究所,黑龍江 齊齊哈爾 161005)
種子的萌發需要適宜的溫度條件,有些植物種子的萌發需要變化的溫度[1]。種子的活力和相關代謝對溫度信號的響應是萌發的關鍵,溫度能夠直接影響種子萌發或間接地通過調節種子休眠以影響種子萌發。種子在開始萌發的過程中,低溫信號可導致種子內部激素含量的變化,調控種子萌發[2];溫度的變化也能夠影響種子休眠,較高的環境溫度中種子休眠度深,而低溫對于種子破除休眠有著非常關鍵的作用[3]。
種子萌發調控中,激素之間的協同和拮抗有重要作用[4]。ABA與GA是關鍵的兩種萌發調控激素,其各自的合成與代謝形成的種子內激素含量的平衡決定種子的生理狀態,以溫度為代表的環境信號通過一系列信號轉導途徑作用于激素的合成代謝途徑,導致激素含量的變化,從而影響種子的萌發[5]。在植物體內,GA和ABA的合成代謝基因及信號轉導相關基因已被大量鑒定。GA促進種子萌發的過程中,調控GA合成的關鍵基因是GA3ox1和GA3ox2[6],而GA2ox調控GA的降解,GID1是GA信號通路中的關鍵基因[7]。ABA抑制萌發,拮抗GA的促進作用[8-9],玉米黃質環氧化酶(zeaxanthin epoxidase,ZEP)和9-順式-環氧類胡蘿卜素雙加氧酶(9-cis-epoxy-carotenoid oxygenase,NCED)是ABA合成途徑中的兩個關鍵酶,而CYP707A2是ABA降解的關鍵基因[10-11],PP2Cs在ABA信號轉導中有重要作用[12]。有研究表明,低溫能上調GA合成代謝基因(AtGA20ox1、AtGA20ox2和AtGA3ox1)和下調GA分解代謝基因(AtGA2ox2),從而提高種子內活性GA的含量,進而促進萌發[13]。高溫使ABA合成相關基因NCED2,NCED5和NCED9的表達上調,導致ABA水平上升,并抑制GA合成途徑基因的表達,使種子萌發受到抑制[14-15]。此外,細胞壁松弛蛋白能夠軟化胚乳組織,促進細胞壁解聚,幫助胚根伸出[16]。已有研究表明細胞壁松弛蛋白編碼基因EXPA1,EXPA2,EXPA3,EXPA8,EXPA9和EXPA20等在吸漲的種子中表達量顯著提高,因此細胞壁松弛蛋白在促進種子萌發中有著非常重要的作用[17-18]。
羊草(Leymuschinensis)是我國重要的禾本科牧草[19],應用價值高,但種子萌發率偏低限制了羊草種子的生產應用[20]。已有研究表明變溫能夠促進羊草種子萌發,而恒溫不利于其萌發[21-27];并且本實驗室已對羊草種子的萌發條件進行了大量實驗,發現相較恒溫28 ℃條件,變溫(28 ℃ 12 h/16 ℃ 12 h)可顯著提高羊草種子萌發率。本研究在確定羊草種子響應變溫信號敏感期的基礎上,結合前期變溫處理羊草種子萌發的轉錄組測序數據,對初選的24個可能與種子萌發、休眠及低溫響應與激素代謝等相關的基因進行定量分析,篩選出與變溫萌發有關的關鍵基因,并對其在種子萌發初期的表達進行了初步分析,旨在為羊草種子萌發早期的分子機理研究奠定基礎。
1 材料與方法
1.1 實驗材料
本研究所用的羊草種質為SF2-1和XQ10-1,本研究組前期研究已表明其萌發率存在顯著差異。羊草材料均種植于中國科學院植物研究所(北京)羊草種質資源圃,在自然條件下生長,于2014年收獲種子供試。
1.2 實驗方法
1.2.1羊草種子萌發不同時段變溫處理 取直徑9 cm鋪有浸濕濾紙的玻璃平皿,將人工挑選的50粒飽滿種子均勻地排列在濾紙上,平皿中加入5 mL蒸餾水使濾紙充分吸水濕潤,4次重復。將皿蓋傾斜45°蓋于平皿上,平皿和皿蓋一起放入托盤內,托盤內倒入1 cm深的蒸餾水。將托盤放入人工氣候箱(相對濕度65%)。對處于28 ℃恒溫條件下進行萌發的SF2-1和XQ10-1種子,在不同的時間段(第0~12 h、12~24 h、24~36 h、36~48 h、48~60 h、60~72 h)以16 ℃低溫處理12 h后,繼續放入恒溫培養箱中萌發12 d。以持續處于恒溫28 ℃條件下萌發的種子作為對照,測定各處理中最終的種子萌發率(變溫處理后的第12天),4次重復。發芽標準為胚根伸出1 mm。
1.2.2羊草種子總RNA提取與cDNA合成 以1.2.1的羊草種子萌發的方法,取恒溫(28 ℃)1 d和變溫(28 ℃ 12 h/16 ℃ 12 h)處理1 d后的羊草種子,用濾紙吸干種子表面水分,液氮處理后,保存于-80 ℃超低溫冰箱備用。
采用植物總RNA提取試劑盒(TIANGEN)分別提取各溫度處理的羊草種子中的總RNA,利用DNase I (TIANGEN)消化基因組DNA。用1%的瓊脂糖凝膠電泳檢測RNA完整性,并使用Biodropsis BD-2000測定RNA濃度和純度。使用TaKaRa公司PrimeScriptTM RT reagent Kit(Perfect Real Time 編號:RR037Q)進行cDNA合成,反應體系為10 μL:5×PrimeScript?Buffer(2 μL),PrimeScript?RT Enzyme Mix I(0.5 μL),OligodT Primer(50 μmol·L-1)(0.5 μL),Random 6 mers(100 μmol·L-1)(0.5 μL),Total RNA(500 ng),RNase-Free ddH2O(補足至10 μL)。反轉錄反應條件為:37 ℃,15 min;85 ℃,5 s。合成后的cDNA存貯于-20 ℃冰箱備用。
1.2.3羊草種子萌發變溫處理轉錄組測序 前期研究組選取萌發率較高的羊草種質SF2-1的種子,以恒溫(28 ℃)12 h萌發的種子作為對照組,變溫(28 ℃ 12 h/16 ℃ 12 h)1 d和恒溫(28 ℃)24 h萌發種子作為實驗組,進行轉錄組測序,并對轉錄組測序數據深度分析。
結合轉錄組數據的初步分析結果,篩選與高等植物種子萌發過程中的生理變化和激素代謝,以及與低溫響應相關的24個候選基因(表1),并以轉錄組測序數據中這24個基因在不同溫度條件下的RPKM值利用R語言制作基因表達熱圖。
1.2.4基因表達定量分析 根據轉錄組測序數據初步篩選的24個候選相關基因的CDS序列設計熒光定量引物,以羊草Actin基因序列設計內參引物(表1),以恒溫處理為對照,通過定量PCR(qRT-PCR)分析相關基因在高、低萌發率羊草種質于變溫處理下萌發中的表達變化。定量PCR體系和條件按照TaKaRa公司SYBR?Premix Ex TaqTMII (TliRNaseH Plus)試劑盒說明書進行操作。反應程序為:95 ℃,30 s;45個循環(95 ℃,5 s;68 ℃,30 s)。技術重復3次。定量PCR反應完成后,采用2-ΔΔCt方法對所得數據進行相對定量分析[28]。
1.3 數據處理與分析
采用SPSS 17.0和Microsoft Excel 2010軟件完成統計分析,圖表制作使用Microsoft Excel 2010和Origin 8.0軟件。采用單因素方差分析和LSD最小顯著差異法檢驗不同變溫時段羊草種子萌發率以及各基因相對表達量的差異性。使用R語言制作基因表達熱圖。
2 結果與分析
2.1 羊草種子萌發對不同時段變溫處理的響應
為了探究羊草種子萌發過程中對變溫信號的響應,以12 h為梯度的變溫處理萌發實驗結果表明:與對照相比,不論是高萌發率種質SF2-1,還是低萌發率種質XQ10-1,在萌發的第12 h之后的任何時段進行低溫處理,其萌發率均極顯著(P<0.01)提高,表明羊草種子在萌發的第12 h已經開始響應變溫信號。在低萌發率種質XQ10-1中對各低溫處理時段的LSD分析表明,第12~24 h進行低溫處理的萌發率與恒溫對照以及第0~12 h低溫處理相比,均有極顯著提高(P<0.01),而在第12~24 h之后的12 h時段低溫處理后的萌發率與第12~24 h處理相比差異不顯著;在高萌發率種質SF2-1中進行LSD分析,在第12~24 h低溫處理極顯著地提高了萌發率,但相比于第12~24 h,在第24~36 h低溫處理仍表現出萌發率的顯著提高(P<0.01),且在各時段處理中的調高幅度最大。通過兩個種質中不同時段低溫處理后的萌發率差異可以得出,第12~24 h是羊草種子響應低溫信號的關鍵時段,詳見圖1。
2.2 羊草種子萌發相關基因的篩選
依據羊草種子萌發不同時段變溫處理實驗結論“第12~24 h是羊草種子響應低溫信號的關鍵時段”,選取了高萌發率種質SF2-1的種子進行了變溫處理轉錄組測序,利用轉錄組數據分析得到的各基因的RPKM值,對初步篩選的24個可能與羊草種子萌發、休眠及低溫相關的基因進行熱圖分析,得到不同溫度條件下基因的差異表達情況(圖2)。
結果表明:與恒溫(28 ℃ 12 h)對照相比,16 ℃低溫處理12 h后,表達明顯上調的基因有SAIN1,PP2C62,EXPB3,EXPB4,GA3ox,EXPA2和EXPA7,而表達明顯下調的基因有bHLH49,GID1,ABI8,Chi1,11833,CBF3,NAC2,PP2C72,SAIN2和5423。與恒溫28 ℃ 12 h對照相比,恒溫28 ℃處理24 h后,表達明顯上調的基因有SAIN1,PP2C62,PYL8,GID8,ABI8,SPATULA和ROS1,而表達明顯下調的基因有GA2ox,ZEP,EXPA5,EXPB16,Chi1,11833,CBF3,NAC2,PP2C72和5423。與對照相比,兩組不同的溫度處理中,表達均明顯上調的基因有SAIN1,PP2C62和EXPB3,而在兩種溫度處理中表達均明顯下調的有Chi1,11833,CBF3,NAC2,PP2C72和5423。
2.3 羊草種子變溫萌發中相關基因的表達變化
以恒溫處理為對照,對各基因在變溫處理后的SF2-1和XQ10-1羊草種子中的表達進行PCR熒光定量分析。結果表明:變溫處理1 d后,在兩種材料中表達量都上調的基因有SAIN1,NAC2,EXPB4,EXPB16和EXPA2等5個。在萌發率高的SF2-1的材料中,還有11個基因分別有不同程度上調(圖3),其中,EXPA2和PP2C72這兩個基因的上調明顯,分別較對照上調13.7和9.0倍。而在萌發率低的XQ10-1的材料中,僅有上述5個基因的表達量上調(圖4)。在兩個種質中均上調表達的5個基因中,SAIN1基因在SF2-1中上調較XQ10-1明顯,而其他4個基因在XQ10-1中的上調更加明顯。

圖2 羊草種子萌發相關基因表達熱圖Fig.2 The heat map of expression of the genes related to germination in L. chinensis

圖3 SF2-1種子變溫處理后上調基因Fig.3 The up-regulated genes in SF2-1 L. chinensis seeds after variable temperature treatment
各基因在變溫處理后的相對表達量均以其恒溫處理作為對照,因此各基因的相對表達量均以1作為對照。下同。The expression of the each genes under the variable temperature treatment were compared to the constant temperature control, therefore the expression level of the control groups is 1. The same below.
變溫處理1 d后,在SF2-1和XQ10-1中的表達量都下調的基因有Chi1,CBF3,5423和SAIN2。在SF2-1中,有8個基因的表達出現不同程度的下調(圖5),SPATULA和Chi1基因下調均在5倍以上。在XQ10-1中,有6個基因出現不同程度的下調(圖6),且與在SF2-1中的表達相比,Chi1、5423、CBF6、SAIN2在XQ10-1中的表達下調更加明顯。
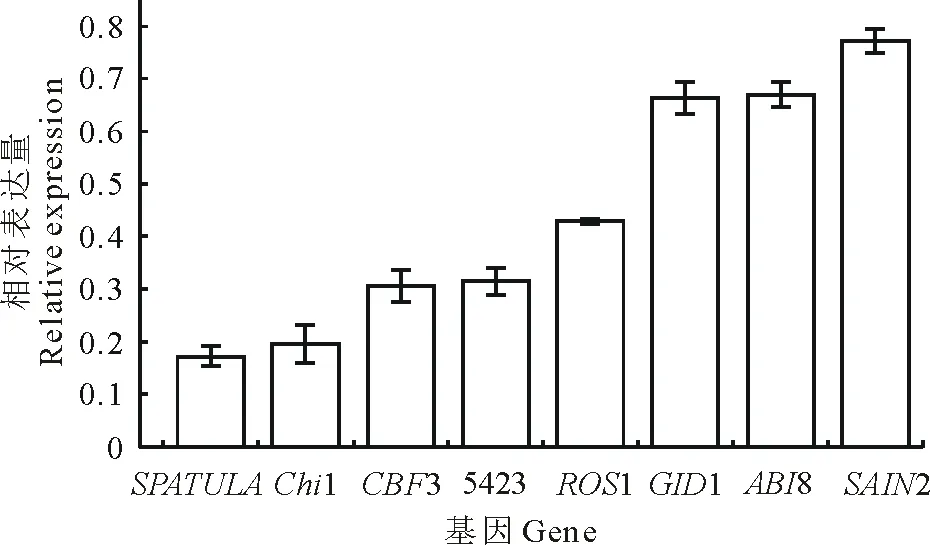
圖5 SF2-1種子變溫處理后下調基因Fig.5 The down-regulated genes in SF2-1 L. chinensis seeds after variable temperature treatment

圖6 XQ10-1種子變溫處理后下調基因Fig.6 The down-regulated genes in XQ10-1 L. chinensis seeds after variable temperature treatment
通過基因表達的分析挑選高萌發率種質SF2-1中表達差異顯著的11個基因,與低萌發率種質XQ10-1中的表達量分別進行比較分析(如圖7,其中下調基因的表達量用負倒數表示)。結果表明,Chi1,CBF3,5423在兩個種質中的表達均下調;而NAC2,EXPB4,EXPB16和EXPA2在兩個種質中的表達均上調。

圖7 在SF2-1和XQ10-1中均特異表達的基因Fig.7 Genes specifically expressed in both of the seed genotypes SF2-1 and XQ10-1
依據各基因在不同溫度處理下萌發的種質中表達的情況,以相對表達量上調或下調大于2倍為基準,篩選出9個相關基因,分別是Chi1、CBF3、5423、NAC2、GA3ox、EXPB4、EXPB16、SAIN1和EXPA2。對上述基因在高萌發率SF2-1種質和低萌發率種質XQ10-1中的表達量進行分析, 若基因在SF2-1中上調倍數大于XQ10-1或在SF2-1種質中下調倍數小于XQ10-1,則表明該基因與種子萌發相關,進而明確各基因與變溫和萌發的相關程度(表2)。結果表明,這9個基因在變溫條件下均差異表達,表明這些基因均與變溫相關,而其中6個基因與高萌發率與低萌發率的兩個種質均有關。因此,篩選得到變溫影響羊草種子萌發的6個關鍵基因:Chi1,CBF3,5423,GA3ox,EXPB4和SAIN1。
3 討論
種子萌發是一個復雜的生理生化過程,其中相關酶的活性、膜的通透性、膜結合蛋白的活力以及種子內GA和ABA的合成代謝均受溫度影響。種子的萌發需要適宜的溫度。前人的研究表明,恒溫不利于羊草種子的萌發,低溫和變溫都能顯著提高種子萌發率。本課題組在對羊草種子萌發的前期研究表明,恒溫(16、20、22、28、37 ℃)處理下羊草中種子萌發率均較低(小于20%),而在不同的變溫(28 ℃ 12 h/16 ℃ 12 h)條件下,羊草種子萌發率顯著升高。 在此基礎上, 系統地研究了變溫對羊草種子萌發的效應,通過不同時段的變溫處理改變種子萌發的溫度條件,發現羊草種子萌發的第1天(第12~24 h)經低溫處理可顯著提高種子萌發率,該時段(第12~24 h)可以說是羊草種子萌發中對響應低溫信號的關鍵時段。

表2 與變溫或萌發相關的基因Table 2 The genes related to variable temperature treatment or germination
注:數字“1”代表相關; “0”代表不相關。
Note: The number “1” stands for related; The number “0” stands for none-related.
細胞壁松弛素家族基因在變溫處理后的萌發期羊草種子中表達變化較普遍,上調較明顯。已有研究表明,在萌發中的擬南芥(Arabidopsisthaliana)種子中,相比于在擬南芥中編碼細胞松弛蛋白的其他35個基因,EXPA2的表達量極高,并已證實了EXPA2是種子萌發所必需的,且EXPA2對萌發的作用受到GA的調控[29]。前人在番茄(Lycopersiconesculentum)的研究中發現,LeEXP4在胚乳的珠孔端特異表達,種子萌發過程中mRNA累積水平與胚乳珠孔端的軟化程度保持一致,通過軟化胚乳促進胚根的伸出,進而參與調控種子萌發[30-31]。本研究中的羊草種子變溫處理1 d后,EXPA2表達量上調了13.7倍,EXPB4和EXPB16在變溫處理后的表達也有明顯的上調,據此可以初步判斷細胞壁松弛素家族基因在羊草種子萌發中有重要作用。
植物激素參與對種子萌發的調控,其中,GA和ABA的作用較為關鍵。GA促進種子萌發。已有研究表明,擬南芥種子經低溫處理后,AtGA3ox1及AtGA3ox2的表達量提高,參與GA的合成代謝[13]。羊草種子經變溫處理后,GA3ox的表達量也明顯上調,可見羊草種子接受變溫信號后增強GA的合成,從而促進萌發。GA2氧化酶參與GA的分解代謝,我們發現羊草種子在變溫處理后其GA2ox的表達也表現為上調,這可能是種子萌發初期活躍的激素合成與代謝平衡的表現。GA3ox1和GA3ox2的轉錄受SPATULA抑制,SPATULA通過影響GA代謝而調控萌發,且受低溫層積下調表達[32];發現羊草種子變溫處理后,SPATULA的表達下調,進而可能通過GA效應作用于萌發。ABA維持種子休眠,抑制萌發。ABA在高等植物中的合成途徑中,ZEP可能起關鍵性作用[33];本實驗中經變溫處理后的羊草種子,ZEP基因的表達量上調,可能說明變溫萌發中ABA的效應在一定程度上受到抑制。ABI8是ABA信號通路的一個重要調控因子,在擬南芥中有通過調節細胞纖維素合成影響細胞壁合成的功能[34],在本研究中發現,羊草種子變溫處理后,ABI8的表達量有小幅的下調,可能表明在此過程中ABA含量降低或ABA效應受阻,降低ABA對種子萌發的抑制效應。
植物中幾丁質酶參與植物發育和環境脅迫響應,目前關于植物幾丁質酶基因的研究主要集中在植物的抗病性[35]。Chi1在羊草種子萌發過程中可能由響應低溫信號而表達下調,其在萌發中具體功能有待進一步研究。轉錄因子CBF基因包括CBF1、CBF2和CBF3,在植物冷適應與植物抗冷抗凍性中有重要作用,已有研究表明CBF突變體表現出對低溫冷害的極度敏感[36]。在羊草種子接受低溫信號后,CBF3的表達明顯下調,與植物冷適應過程相反,在此過程中可能由于CBF3表達的下調提升種子內對低溫信號的響應,從而使低溫進入種子萌發相關的信號通路,促進種子萌發。在羊草種子中,NAC2的表達在低溫誘導后的下調明顯;而NAC2在花生(Arachishypogaea)中參與ABA信號途徑,而且在擬南芥中過量表達NAC2可導致根生長及種子萌發對ABA過度敏感[37]。SAIN1和5423是在本研究組已有研究中發現的羊草新基因[38],在羊草種子變溫萌發中的表達分析表明,SAIN1和5423可能與種子萌發有關,且可能受低溫誘導。
本研究在確定羊草種子響應變溫的敏感期及關鍵時間點的基礎上, 探究羊草種子萌發過程中變溫響應關鍵時期的基因表達變化,并初步篩選出可能與羊草種子萌發及變溫相關的關鍵基因,為深入研究種子萌發、變溫響應相關基因的具體功能及種子萌發分子機理奠定了一定的基礎。
4 結論
羊草種子萌發中的第一天是接受變溫信號的關鍵時期。本研究對前期羊草種子轉錄組測序數據深度分析,篩選與羊草種子萌發、休眠、低溫等相關基因24個,并對這些基因在變溫萌發過程中的表達進行分析,篩選出一些可能與變溫處理及種子萌發相關的關鍵基因。由分析結果得到與變溫相關但與萌發無關的基因有轉錄因子基因NAC2和細胞松弛素編碼基因EXPB16、EXPA2;篩選得到6個與變溫處理和萌發均相關的基因,分別是幾丁質酶基因Chi1、低溫響應基因CBF3、赤霉素合成相關基因GA3ox、細胞松弛素編碼基因EXPB4和羊草新基因SAIN1、5423。

