銀杏葉提取液對腐生葡萄球菌的作用機理
王 倩 , 藍蔚青 *, 侯 旻 , 張皖君 , 謝 晶
(1.上海海洋大學 食品學院,上海 201306;2.上海水產品加工及貯藏工程技術研究中心,上海201306)
銀杏 (Ginkgo biloba)為銀杏科銀杏屬裸子植物,俗稱白果樹、公孫樹等,是中國最古老的樹種之一,有“活化石”之稱[1]。相關研究證明,銀杏葉中含有200多種藥用成分,其中包含46種黃酮類活性成分、25種微量元素、17種氨基酸和生物堿等,具有保護中樞神經系統、擴張血管、保護心臟、抗氧化、抗腫瘤等作用,保健價值高[2-4]。
近年來,研究人員對銀杏葉提取工藝、提取物的化學成分、藥理作用和藥動學等方面研究取得了一定進展[5]。部分研究表明,銀杏葉提取物中的銀杏酚酸具有抑菌殺菌作用,對此,部分學者對其抑菌活性進行了研究。Sati等[6]研究了不同溶劑(甲醇、乙酸乙酯、正丁醇、水)提取的銀杏葉提取物對革蘭氏陽性菌、革蘭氏陰性菌、放線菌及真菌的抑菌活性,結果表明銀杏葉提取物對細菌作用最強,放線菌次之,且甲醇提取物的抑菌效果最好。曲莉等[7]通過測定抑菌圈直徑和最低抑菌濃度研究了銀杏葉提取物對金黃色葡萄球菌和大腸埃希菌的抑菌作用,最終得出銀杏葉提取物對兩者均有明顯抑制作用。現有研究主要集中于金黃色葡萄球菌、大腸埃希菌等常見致病菌,但對水產品中腐敗菌的抑制作用及作用機理方面的研究較少,抑菌機制也不明確。作者以水產品腐敗菌——腐生葡萄球菌為研究對象,測定了銀杏葉提取液對其的最小抑菌濃度與抑菌率的影響,并研究其對菌體細胞膜通透性、細胞壁完整性與菌體形態的影響,進一步分析銀杏葉提取液的抑菌作用機理,為后期將其應用于水產品保鮮研究提供理論依據。
1 材料與方法
1.1 實驗材料
銀杏葉:摘自上海海洋大學校園主環路上。8月份選取新鮮、無病蟲害、葉面扇形、邊緣完整的銀杏葉進行采摘。采摘后將其清洗、烘干、粉碎后保存備用。
供試菌株:腐生葡萄球菌(Staphylococcus saprophyticus)為作者所在課題組前期從腐敗鯧魚中分離、篩選并鑒定保存菌株。
主要試劑:胰蛋白胨大豆肉湯 (Tryptic Soy Broth,TSB)、胰蛋白胨大豆瓊脂(Tryptic Soy Agar,TSA)培養基:國藥集團化學試劑有限公司;堿性磷酸酶(Alkaline Phosphatase,AKP)測試盒:南京建成生物工程研究所;其他化學試劑氯化鈉、無水乙醇、戊二醛等:均為分析純。
1.2 主要儀器設備
Centrifuge 5810R冷凍離心機:德國Eppendorf公司;BCD-256KF冰箱:青島海爾股份有限公司;ZQZY-70B振蕩培養箱:上海知楚儀器有限公司;MLS-3750滅菌鍋:日本SANYO公司;Synergy2自動酶標儀:美國BioTek公司;DDB-11A電導率儀:杭州齊威儀器有限公司;S3400N掃描電子顯微鏡:Hitachi日本株式會社;全M334712自動微生長曲線分析儀:芬蘭Bioscreen公司等。
1.3 實驗方法
銀杏葉提取液制備稱取10 g銀杏葉粉末,加入500 mL 60%乙醇,混合后在60℃下超聲波提取30 min,冷凍離心后進行抽濾,取上清液旋轉蒸發除去乙醇和水,濃縮至最終體積為20 mL,過0.45 μm濾膜,得到質量濃度為500 mg/mL的銀杏葉提取液。
菌懸液的制備挑取活化后的腐生葡萄球菌單菌落接種于TSB培養基中,37℃培養7 h,用滅菌生理鹽水將其配制成含菌數106~107CFU/mL的菌懸液備用,現配現用。
1.3.3 最 小 抑 菌 濃 度 (MinimalInhibitory Concentration,MIC) 采用肉湯稀釋法[8]和平板計數法[9]測定銀杏葉提取液對腐生葡萄球菌的MIC值,以特定環境下孵育24 h,可抑制微生物出現明顯增長的最低濃度即最小抑菌濃度。通過梯度稀釋將銀杏葉提取液用無菌TSB在試管中依次稀釋,使各組終質量濃度分別為 300、250、200、150、100、50 mg/mL,對照組用無菌水代替銀杏葉提取液。向各組接種菌懸液達最終濃度為106CFU/mL,取100 μL用無菌生理鹽水進行10倍稀釋,選取合適稀釋液100 μL均勻涂布于TSA平板培養基上,37℃培養24 h后進行菌落計數。將試管置于37℃搖床中恒溫培養24 h,再次進行稀釋、涂布、培養與計數。通過比較銀杏葉提取液處理前后菌數變化,得出最小抑菌濃度(MIC)。
抑菌率向無菌96孔板中分別加入MIC、2MIC質量濃度的銀杏葉提取液,并接種一定量已制備的菌懸液,使孔中溶液含菌量為106CFU/mL。充分混勻后置于37℃微孔板振蕩器中培養12 h,用酶標儀測其600 nm處的吸光度值,計算其抑菌率[10]:
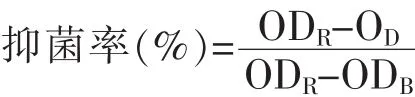
式中,ODR為對照孔吸光值;OD為樣品孔吸光值;ODB為空白孔吸光值。
細菌生長曲線將已制備的供試菌菌懸液按1%接種體積分數分別加至MIC、2MIC質量濃度的銀杏葉提取液中,以不加銀杏葉提取液組為對照組。37℃、150 r/min搖床培養24 h,用全自動微生物生長曲線分析儀每隔30分鐘自動取樣,測其620 nm處的OD值。以時間(h)為橫坐標,OD值為縱坐標,繪制銀杏葉提取液對腐生葡萄球菌抑制作用的生長曲線。
細胞膜通透性通過培養液中電導率的變化,表征銀杏葉提取液對腐生葡萄球菌菌體細胞膜通透性的影響。將已制備的供試菌菌懸液按1%接種體積分數分別加入到MIC、2MIC質量濃度的銀杏葉提取液中,以不加銀杏葉提取液組作為對照。37 ℃、150 r/min搖床培養 12 h,參考 Tao等[11]法,每隔2小時取樣,測其電導率。
細胞膜完整性當菌體細胞膜完整性遭到破壞時,細胞內容物外泄,通過測定培養液中蛋白質質量濃度的變化反映細胞膜完整性的破壞程度。制備菌懸液后,分別加入MIC、2MIC質量濃度的銀杏葉提取液,以不加銀杏葉提取液組為對照。37℃、150 r/min搖床培養12 h,每隔2小時取培養液,8 000 r/min離心3 min,取上清液用考馬斯亮藍法[12]測其蛋白質質量濃度。
銀杏葉提取液對腐生葡萄球菌細胞壁的影響參考藍蔚青等[13]方法,將已制備的供試菌液按1%接種體積分數加入到MIC、2MIC質量濃度的銀杏葉提取液中,以不加銀杏葉提取液組為對照。37℃、150 r/min搖床培養12 h,每隔2小時取樣,3 500 r/min離心10 min,取上清液用測試盒進行堿性磷酸酶(AKP)的測定。
掃描電鏡觀察向MIC、2MIC質量濃度的銀杏葉提取液中接種體積分數1%已制備好的供試菌液,37℃、150 r/min搖床培養12 h,取菌液1.5 mL在4℃、8 000 r/min離心5 min,收集沉淀。用2.5%戊二醛溶液使菌體沉淀重懸浮,在4℃固定10 h。將固定后的菌體用磷酸鹽緩沖液洗滌3次后,分別用30%、50%、70%、90%、無水乙醇進行梯度脫水。冷凍干燥12 h后,將其涂至金屬載體上,噴金后進行掃描電鏡觀察。
1.4 數據分析
實驗數據采用重復實驗平均值,以平均值±標準偏差表示。通過SPASS17.0軟件用單因素方差分析(ANOVA)進行顯著性差異分析(p<0.05),通過Origin8.5軟件進行繪圖。
2 結果與討論
2.1 最小抑菌質量濃度(MIC)
如表1所示,銀杏葉提取液對腐生葡萄球菌有較好的抑制作用。當銀杏葉提取液質量濃度≥200 mg/mL時,腐生葡萄球菌無菌落生長。當銀杏葉提取液質量濃度為100 mg/mL時,菌體數量未出現明顯上升。因此,銀杏葉提取液對腐生葡萄球菌的MIC為100 mg/mL。此結果與白秀君等[14]研究荷葉提取液對大腸桿菌的MIC為125 mg/mL結果相似。
2.2 抑菌率
計算得出MIC、2MIC質量濃度的銀杏葉提取液對腐生葡萄球菌的抑菌率分別為60.58%和81.34%,這一結果也表明銀杏葉提取液對腐生葡萄球菌有較好的抑制作用。
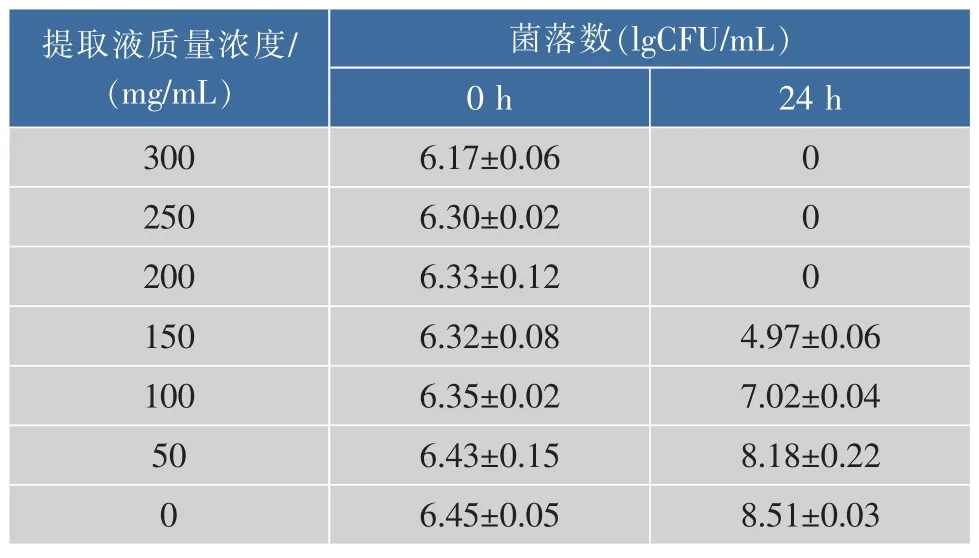
表1 銀杏葉提取液對腐生葡萄球菌的抑菌效果Table 1 Antibacterial effect of Ginkgo biloba leaf extracts against Staphylococcus saprophyticus
2.3 細菌生長曲線
將MIC、2MIC質量濃度銀杏葉提取液處理的腐生葡萄球菌與正常生長腐生葡萄球菌的生長曲線進行對比,結果見圖1。

圖1 銀杏葉提取液對腐生葡萄球菌生長的影響Fig.1 Effect of Ginkgo biloba leaf extracts on the growth of Staphylococcus saprophyticus
由圖1可知,銀杏葉提取液處理組的細菌生長曲線發生了明顯變化。在0~4 h內,MIC、2MIC質量濃度銀杏葉提取液處理組的細菌數量未出現明顯增長,在4 h后進入對數生長期時,其細菌數量也明顯低于正常生長的腐生葡萄球菌。因此,銀杏葉提取液可顯著抑制細菌的菌體分裂,減緩其繁殖速度,延緩菌體進入對數生長期,從而抑制菌體生長。
2.4 細胞膜通透性
細胞膜是 Na+、K+、Ca2+等離子的通透性屏障,細胞膜的結構和化學成分可影響這些小分子物質。當細胞膜的結構發生改變時,可造成其離子滲漏,從而影響菌體的細胞膜功能和生長代謝,導致細胞死亡[15]。表2反映了銀杏葉提取液對腐生葡萄球菌細胞膜通透性的影響。
如表2所示,隨著時間的延長,培養液中電導率有顯著性差異(p<0.05)。經MIC、2MIC質量濃度銀杏葉提取液處理的兩組菌液中電導率明顯高于對照組,說明銀杏葉提取液可破壞菌體細胞膜的結構,改變細胞膜的通透性,使細胞中金屬離子外泄,抑制細菌正常生長代謝,造成菌體死亡。對照組的培養液中電導率也有上升趨勢,可能是由于菌體細胞的自溶和死亡[12]。
2.5 細胞膜完整性
蛋白質等大分子物質是細胞膜和細胞質的重要單位結構物質,當細胞膜的完整性遭到破壞,這些大分子物質被釋放出來,影響菌體的正常生長代謝,從而抑制細菌繁殖[12]。圖2反映了銀杏葉提取液對菌體細胞膜完整性的影響。
如圖2所示,隨著培養時間的延長,對照組培養液中蛋白質質量濃度相對穩定,而MIC、2MIC質量濃度銀杏葉提取液處理組的培養液中蛋白質質量濃度迅速增大,呈明顯上升趨勢。說明經銀杏葉提取液處理的菌體細胞膜完整性受到破壞,蛋白質大量泄漏,影響了其正常生長繁殖。菌體培養液中蛋白質質量濃度的上升趨勢與張赟彬等[12]研究結果一致。
2.6 銀杏葉提取液對腐生葡萄球菌細胞壁的影響
堿性磷酸酶(AKP)是一種水解酶,可催化β-甘油磷酸酯等有機磷酸單酯的水解,釋放無機磷酸鹽,廣泛存在于動植物及微生物體內,對生物體內物質代謝有重要作用[16]。由于其存在于細胞膜與細胞壁間、與細胞膜相結合,所以當細胞壁遭到破壞時,在胞外可檢測到堿性磷酸酶的存在。

表2 銀杏葉提取液對腐生葡萄球菌細胞膜通透性的影響Table 2 Effects of Ginkgo biloba leaf extracts on the membrane permeability of Staphylococcus saprophyticus

圖2 銀杏葉提取液對腐生葡萄球菌細胞膜完整性的影響Fig.2 Effects of Ginkgo biloba leaf extracts on the membrane integrity of Staphylococcus saprophyticus
如圖3所示,對照組中堿性磷酸酶量基本未發生變化,而經MIC、2MIC銀杏葉提取液處理后,菌懸液中的堿性磷酸酶量變化明顯。經銀杏葉提取液處理2 h后,其堿性磷酸酶量顯著升高,在處理6 h后達到最大值,隨后降低直至趨于平穩。結果表明,菌體經銀杏葉提取液作用后,菌體細胞壁受損嚴重,內容物滲出,導致胞外的堿性磷酸酶量明顯升高。此結果變化趨勢與藍蔚青等[17]研究結果相似。

圖3 銀杏葉提取液對腐生葡萄球菌菌體細胞壁的影響Fig.3 Effects of Ginkgo biloba leaf extracts on the cell wall of Staphylococcus saprophyticus
2.7 掃描電鏡分析
掃描電鏡圖可從細菌的菌體形態上直觀反映銀杏葉提取液的抑菌機理。銀杏葉提取液對腐生葡萄球菌的作用電鏡結果見圖4。

圖4 對照組和銀杏葉提取液處理6 h的腐生葡萄球菌掃描電鏡圖Fig.4 Scanning electron microscopy of Staphylococcus saprophyticus treated by Ginkgo biloba leaf extracts for 6 h
由圖4可知,未經銀杏葉提取液處理的腐生葡萄球菌菌體細胞呈圓潤球狀、表面光滑,細胞聚集成葡萄串狀,細胞間界限明顯。而經銀杏葉提取液處理6 h后,菌體細胞呈無規律排列,細胞大小不一、部分菌體細胞相互粘結,菌體細胞周圍有小分子物質聚集。說明銀杏葉提取液可通過抑制菌體細胞壁的合成或破壞細胞壁、改變細胞膜通透性來影響細菌的正常生長代謝,從而實現抑菌效果。
3 結 語
通過最小抑菌濃度、抑菌率、細菌生長曲線、電導率與堿性磷酸酶量測定,結合掃描電鏡觀察菌體形態,研究了銀杏葉提取液對腐生葡萄球菌的抑菌機理。結果表明:銀杏葉提取液對腐生葡萄球菌的最小抑菌質量濃度為100 mg/mL,MIC、2MIC質量濃度的銀杏葉提取液對腐生葡萄球菌的抑菌率分別為60.58%和81.34%。各指標測定和掃描電鏡結果表明,銀杏葉提取液可抑制菌體細胞分裂繁殖,延緩其進入對數生長期,降低細胞膜流動性使細胞膜通透性增大,破壞細胞壁及細胞膜完整性,使細胞內容物外泄,抑制菌體正常生長代謝,造成菌體死亡。通過以水產品特定腐敗菌——腐生葡萄球菌為研究對象,實驗結果將為銀杏葉提取液應用于水產品保鮮貯藏,為其向著天然、安全的方向發展提 供理論基礎與研究思路。

