抗雙酰胺類殺蟲劑小菜蛾的cDNA代表性差異分析
王瑩瑩,李廣閱,2,徐巨龍,孫詩晴,薛超彬
(1.山東農業大學植物保護學院/農藥毒理與應用技術省級重點實驗室,山東 泰安 271018;2.山東鼎益生態農業有限公司,山東 臨沂 276000)
近年來,隨著氯蟲苯甲酰胺和氟苯蟲酰胺等雙酰胺類殺蟲劑的大量使用,小菜蛾對該類藥劑的抗性問題也變得十分突出,尤其是在亞熱帶地區更為嚴重[1]。在菲律賓、泰國和中國的南方較早發現了高抗氯蟲苯甲酰胺小菜蛾田間種群[2,3],與敏感品系/種群相比,采自泰國的田間抗性種群具有超過200倍的抗性[2];廣東增城的抗性種群具有2 140倍的抗性[3];菲律賓的種群(Sudlon)具有超過4 100倍的抗性[2],近期的研究表明該Sudlon種群對氯蟲苯甲酰胺的抗性倍數高達10 000[1];在巴西發現了對氯蟲苯甲酰胺具有22 793倍的田間抗性種群[4]。
研究發現,泰國和菲律賓的小菜蛾田間高抗種群中魚尼丁受體基因(PxRyR)的4 946位點均存在一個甘氨酸(G)到谷氨酸(E)的突變[2,5],被認為是導致小菜蛾對氯蟲苯甲酰胺產生抗性的主要原因。本課題組在廣東增城地區的田間高抗小菜蛾種群中也發現了該突變位點,位于受體基因羧基末端的跨膜區附近,且在所有昆蟲魚尼丁受體中高度保守[6]。同時,我們對不同抗性品系/種群小菜蛾進行了抗性頻率檢測,發現增城地區的抗性基因突變頻率高達90%以上[7]。此外,解毒酶活性的提高,如細胞色素P450單加氧酶(P450)、羧酸酯酶(CarE)和谷胱甘肽S-轉移酶(GSTs)活性的提高[8,9],PxRyR基因中4個位點的協同突變[10]以及PxRyR基因mRNA轉錄表達變化等[7,11,12],也是小菜蛾對氯蟲苯甲酰胺產生抗性的重要機制,可見,小菜蛾對氯蟲苯甲酰胺產生抗性的機制多樣且較為復雜。
本試驗在前期研究基礎之上,利用小菜蛾敏感品系cDNA作為“驅動子”來源,小菜蛾抗氯蟲苯甲酰胺品系、抗氟苯蟲酰胺品系的cDNA分別作為“檢測子”來源,采用改進的cDNA代表性差異分析法(cDNA RDA),篩選小菜蛾抗藥性品系和敏感品系間的差異性表達基因,為鎖定抗性靶標基因,進一步揭示小菜蛾的抗性機制奠定基礎。
1 材料與方法
1.1 供試材料
小菜蛾敏感品系(S)于2006年采自山東農業大學南校區實驗站園,在室內不接觸任何藥劑,用小白菜苗長期飼養且穩定繁殖;抗氯蟲苯甲酰胺品系(Rf)和抗氟苯蟲酰胺品系(Rh)是小菜蛾S品系分別在氯蟲苯甲酰胺、氟苯蟲酰胺藥劑的持續選擇壓力下篩選獲得的抗性品系,抗性倍數分別為684.54和677.25倍[13]。
1.2 RNA提取
分別選取抗氯蟲苯甲酰胺品系(Rf)、抗氟苯蟲酰胺品系(Rh)和敏感品系(S)小菜蛾的4齡幼蟲,迅速用液氮冷凍,用RNAiso Plus試劑盒(寶生物大連工程有限公司)提取RNA,并利用1.5%瓊脂糖凝膠電泳檢測。采用PolyATtract?mRNA 純化系統 Ⅲ (Promega,Madison,美國)進行小菜蛾mRNA的純化。
1.3 小菜蛾雙鏈cDNA的合成
采用RTAid Prem DS cDNA Synth Kit10 rxn (賽默飛世爾科技,北京)進行小菜蛾雙鏈cDNA的合成。其中采用苯酚∶氯仿∶異戊醇(25∶24∶1)抽提雙鏈cDNA,在30 μL 10 mol/L乙酸銨和250 μL乙醇中沉淀,然后-20℃過夜。4℃、14 000 r/min離心15 min,將得到的沉淀用70%乙醇洗滌2次,并風干。-20℃保存在ddH2O中備用。
1.4 檢測子(Testers)和驅動子(Drivers)制備
本試驗采用的代表性差異分析法(RDA)參考Hubank和Schatz[14]介紹的方法。其中接頭和引物選用了3對接頭(由上海生工生物工程有限公司合成),每對接頭均為24個堿基及12個堿基的寡核苷酸序列,其中的24個堿基作相應的引物。“R”接頭用于制備擴增子,“J”及“N”接頭用于雜交擴增反應,所用引物如表1所示。
取獲得的cDNA樣品2 μg經DpnⅡ(New England Biolabs,Ipswich,MA,USA)消化酶切處理,將酶切消化產物連接R24/R12接頭,16℃過夜。為了獲得足夠的下游所需擴增子,PCR反應采用22個擴增循環。擴增前先于72℃孵育3 min,隨后加入Taq聚合酶,進行22個循環:95℃ 1 min,72℃ 3 min,72℃延伸10 min。經凝膠電泳證實每個擴增子的大小。用DpnⅡ消化去除擴增子的R24引物,作為下游反應的切割驅動子。在J12引物的作用下,將J24引物連接到切割驅動子中,即可作為第一輪雜交的檢測子。

表1 cDNA代表性差異分析的接頭和引物
1.5 消減雜交與RDA差異片段的分離
第一輪雜交將50 ng J24連接的檢測子與4 μg驅動子混合,將混合物用苯酚+氯仿+異戊醇(25∶24∶1)抽提,然后置于30 μL 10 mol/L乙酸銨和250 μL乙醇中,-70℃沉淀1 h。4℃、14 000 r/min離心15 min,所得沉淀用70%乙醇洗滌2次,風干。將所得沉淀溶于5 μL雜交緩沖液(30 mmol/L EPPS pH 8.0,30 mmol/L EDTA pH 8.0,ρ=0.1 g/mL PEG8000)中, 37℃溫育5 min,渦旋、離心。樣品用35 μL礦物油覆蓋,然后加熱至95℃ 3 min進行變性,冷卻至67℃,并將1 μL 1 mol/L的NaCl加入到DNA中,之后,樣品在67℃中溫育20 h。孵育后去除礦物油,用TE(Tris-EDTA)進行稀釋,在下游PCR反應中使用5 μL雜交產物。雜交產物PCR擴增前,先72℃孵育3 min,加入Taq聚合酶。隨后72℃ 5 min,加入引物(根據雜交輪次選用不同引物)。擴增條件:95℃ 1 min,然后70℃ 3 min(J24),共25個循環,最后72℃延伸10 min。為了將所得擴增產物用綠豆芽核酸酶(寶生物大連工程有限公司)消化,消除單鏈的擴增產物,本試驗采用改進的PCR反應,即在7個循環后從PCR反應中取出10 μL試樣,將其置于同樣PCR反應條件中進行額外20個循環。按上述條件進行第二輪和第三輪的雜交和擴增,共進行三輪,至少兩次重復,每輪反應中“驅動子”用量均為4 μg,檢測子與驅動子的比例從第一輪的1∶100提高到第二輪的1∶800,直至第三輪的1∶20 000,其采用的接頭引物分別為N24/N12和J24/J12。最終獲得的基因片段在瓊脂糖凝膠上呈現清晰條帶,并進行測序分析。
2 結果與分析
2.1 cDNA RDA 差異片段的獲得
小菜蛾S品系、Rf和Rh抗性品系的cDNA經DpnⅡ酶切后,在T4連接酶的作用下兩端連上R接頭,經PCR擴增,制備得到驅動子和檢測子,瓊脂糖凝膠電泳檢測到200~750 bp的片段(圖1)。分析三輪消減雜交片段,發現第一輪雜交產物背景較高并有嚴重的拖尾現象,說明除了選擇性擴增之外仍有大量的相同基因未能被消減。隨著消減雜交次數的增加,所獲得的差異性片段逐漸減少,在第二輪雜交后出現明顯的差異條帶,第三輪消減雜交之后,主要差異條帶得到了進一步的增強,大約在150~200 bp之間(圖2)。
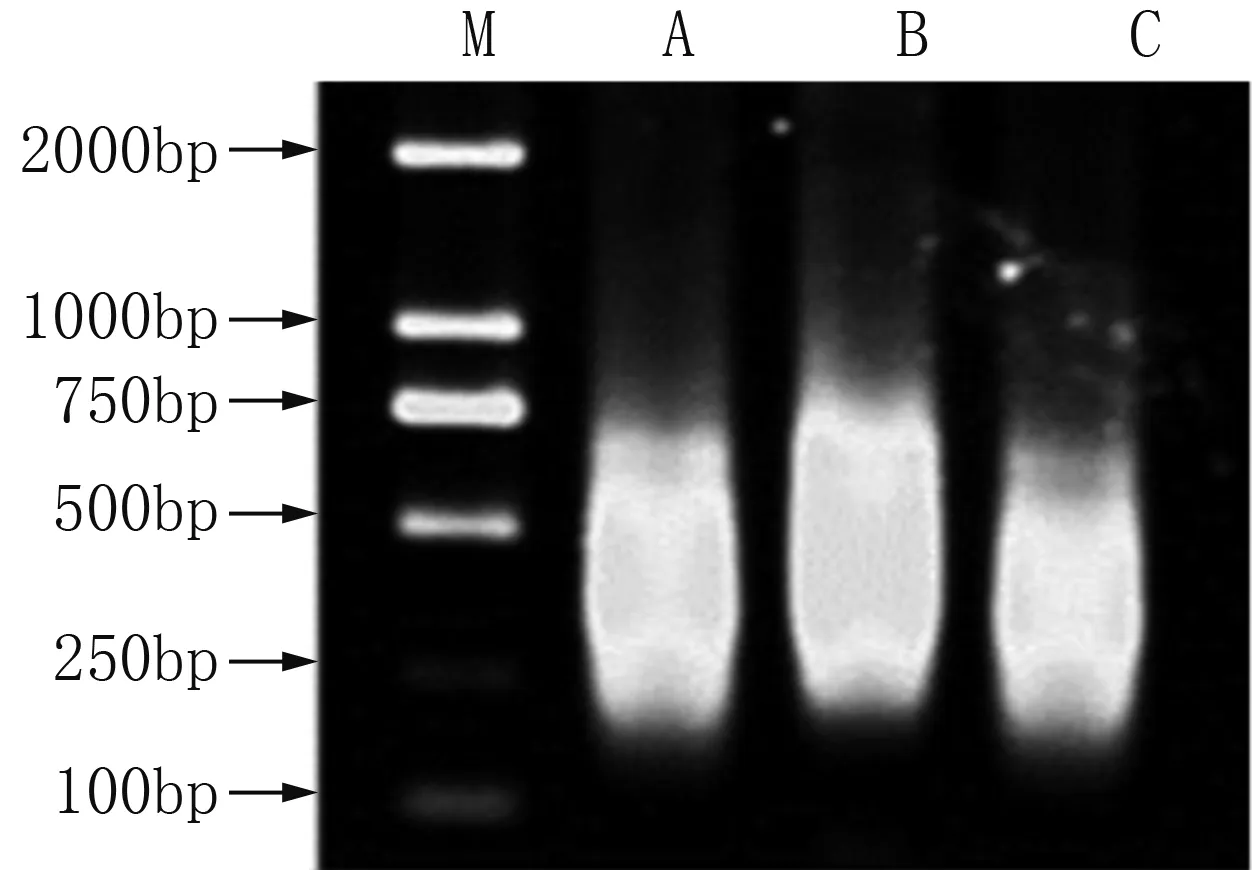
M為DNA Marker 2000;A為敏感品系;B為抗氯蟲苯甲酰胺抗性品系;C為抗氟蟲雙酰胺抗性品系。
2.2 差異性片段的序列分析
將差異擴增片段克隆于pSIMPLE-18 vector(TaKaRa)載體上,轉入菌株、氨芐篩選,菌落PCR鑒定陽性克隆,隨機挑取12個菌落進行測序,將所得序列分別用NCBI BLAST 進行同源性比較。
小菜蛾抗氯蟲苯甲酰胺品系獲得9個cDNA RDA序列,其中有2條與28S rRNA基因有較高同源性,分別命名為DP3-1和DP3-2,同時發現有1個序列與已知任何序列無同源性,命名為DP3-3,可能為未知基因,其它序列均為重復序列。小菜蛾抗氟苯蟲酰胺品系獲得10個序列,其中有2個序列為DP3-1和DP3-2,同時也發現1個未知序列,但不同于DP3-3,命名為DP3-4(表2)。
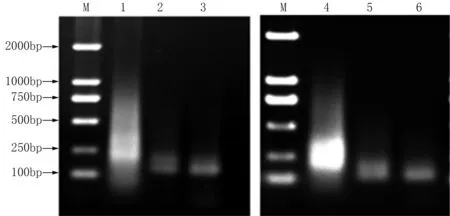
M為DNA Marker 2000;1~3為抗氯蟲苯甲酰胺品系第一、二、三輪的雜交產物;4~6為抗氟苯蟲酰胺品系第一、二、三輪的雜交產物。

表2 cDNA RDA 獲得的差異性片段序列
2.3 差異性片段的同源性比較
DP3-1經NCBI BLAST同源性比較,其與家蠶28S rRNA的同源性為98%,與棉鈴蟲細胞色素P450類TBP蛋白基因同源性為97%(表3)。研究發現棉鈴蟲P450基因與昆蟲的抗藥性相關,主要表現為該基因的表達量上調,并表現出較高的P450活性。DP3-2經NCBI BLAST同源性比較,其與家蠶28S rRNA基因同源性為99%,與赤擬谷盜的TcasGA2_TC010626蛋白基因同源性為93%(表3),但該蛋白的功能目前尚不明確。
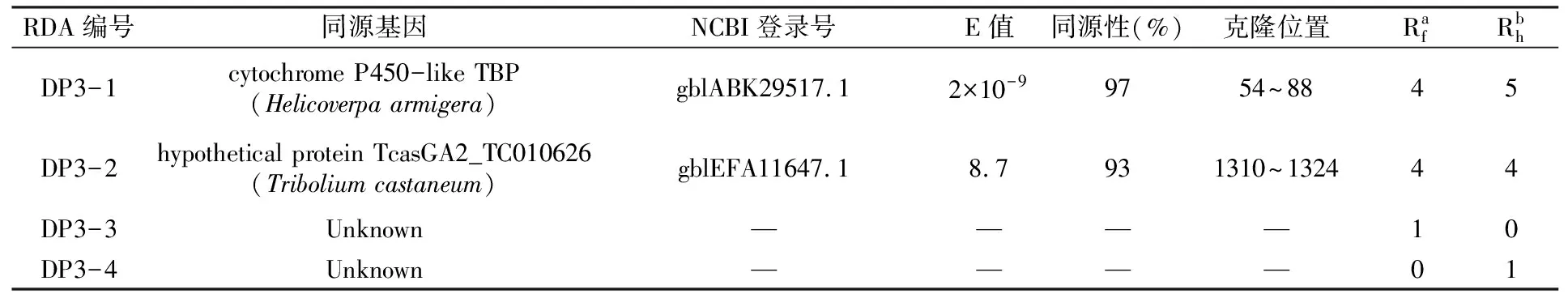
表3 cDNA RDA 獲得的差異性片段的同源性比較
注:a、b分別代表序列在Rf和Rh抗性品系中RDA克隆的數目。
3 討論
cDNA RDA方法被廣泛應用于小菜蛾差異性基因片段的研究中,李宗英等利用代表性差異分析技術在抗殺蟲雙近等位基因中得到了2條差異片段(150~300 bp),初步確認為2個新序列[15];張曉飛等采用代表性差異分析方法,研究了敏感品系和抗殺蟲雙近等基因系,得到了2個差異片段[16];王淑珍用cDNA 代表性差異分析技術從小菜蛾殺蟲雙抗性品系和敏感品系中得到了一個差異性片段(100~200 bp),該基因片段與28S rRNA基因有較高的同源性[17];劉白朵等通過雙向cDNA RDA方法,從溴氰菊酯抗性品系小菜蛾和敏感品系小菜蛾中發現了一條序列與編碼S3a蛋白的基因有較高的同源性[18]。由此可見,cDNA RDA方法在小菜蛾抗藥性基因的篩選中發揮了重要的作用。
在消減雜交試驗中,抑制性消減雜交(SSH) 和cDNA代表性差異性分析(cDNA RDA)是目前應用最廣泛的方法,但是SSH更適合構建差異基因文庫,因為該方法僅兩輪雜交,當兩個樣本間的差異較小時假陽性率高,SSH中兩次驅動子 cDNA使用量均過量,可能會掩蓋檢測子cDNA中某些有表達差別的基因,因此,有些差異表達的基因可能檢測不到。本試驗中兩個樣本之間遺傳背景相同,差異性較小,所以更適合用cDNA 代表性差異分析方法。
本研究利用cDNA 代表性差異分析技術從抗氯蟲苯甲酰胺和抗氟苯蟲酰胺抗性品系中篩選出了2個差異基因片段DP3-1和DP3-2,同時得到了2個未知序列,DP3-1與棉鈴蟲的細胞色素P450類TBP蛋白基因有97%的同源性。在已報道消減雜交的試驗中都得到了細胞色素P450類TBP蛋白,何鵬通過抑制性消減雜交方法在低鹽脅迫下的橡膠樹中得到了細胞色素P450類TBP蛋白基因[19];張建清通過抑制性消減雜交的方法從球孢白僵菌侵染昆蟲和附著胞形成時期受BbMPK1 MAPK調控的下游基因分離得到了煙草細胞色素蛋白(cytochrome P450 like TBP)[20];李玲等在桃花芽休眠解除SSH差減文庫中得到了紅花煙草細胞色素 P450類TBP[21]。研究表明,昆蟲的細胞色素P450與殺蟲劑的抗藥性有關,細胞色素P450酶系是與代謝抗性相關的主要解毒酶系之一,其抗藥性原理主要是由解毒作用的增強而導致的,表現為相應的P450酶活性提高或其表達量的增強。本研究為后續深入研究小菜蛾對雙酰胺類殺蟲劑的抗性機制提供了新線索。

