慢性阻塞性肺疾病患者組織基質金屬蛋白酶-9、基質金屬蛋白酶抑制劑-1及血管內(nèi)皮生長因子測定的臨床價值
卓致遠 張 琦 付國昊
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD) 是一種以氣流受限為特征的慢性氣道炎癥性疾病,具有較高的患病率和病死率[1],給患者家庭及社會造成了嚴重的經(jīng)濟負擔[2]。研究發(fā)現(xiàn), COPD 的發(fā)生機制是多種因素共同作用的結果,而蛋白酶/抗蛋白酶失衡學說在其發(fā)病機制的研究中起重要作用,其中基質金屬蛋白酶9(matrix metalloproteinases 9,MMP-9)和組織型金屬蛋白酶抑制物-1(tissue inhibitor of metalloproteinases-1,TIMP-1)平衡失調即MMP-9 /TIMP-1 比值的變化在COPD 發(fā)病機制中發(fā)揮重要作用[3]。在近年來COPD患者發(fā)病機制中,血管新生和肺血管重構進程尤為重要,許多血管生成促進因子參與其中。其中血管內(nèi)皮生長因子(vascular endothelial growth factor,VEGF)作為血小板源性生長因子(platelet derived growth factor,PDGF)的重要一員,被認為是參與血管新生和重構的最重要的因子。本研究通過檢測COPD急性加重期(AECOPD)及穩(wěn)定期患者血清中的MMP-9、TIMP-1及VEGF水平,并監(jiān)測AECOPD 患者治療前后血清中上述指標水平變化,探討其與COPD不同病程階段及肺通氣功能的相關性, 以期為研究COPD 發(fā)病機制和臨床診治COPD 提供新策略。
資料與方法
1.病例資料 根據(jù)慢性阻塞性肺疾病診治全球策略(2011 年修訂版),患者在吸入支氣管舒張劑后,若 FEV1/FVC<70%,即可定義為不完全可逆性氣流受限,該類患者在排除其他慢性支氣管肺疾病,可確診為慢性阻塞性疾病。本研究根據(jù)以上標準,選擇2015年7月至2016年6月,于我院就診并確診的COPD患者共73例設為COPD組,分為以下兩個亞組:于本院呼吸內(nèi)科住院的慢性阻塞性肺病急性加重期患者34例為A組;同期門診隨訪的慢性阻塞性肺病穩(wěn)定期患者39例為B組;A、B兩組患者入組前均無長期吸入糖皮質激素(ICS) 及長效β2 受體激動劑(LABA) 史。選擇健康體檢無吸煙史或戒煙5年以上志愿者為健康對照組(C組),該組患者近1個月無呼吸系統(tǒng)疾病史,經(jīng)病史詢問、體格檢查、胸X線檢查、肺通氣功能測定(包括支氣管舒張試驗)均未發(fā)現(xiàn)異常,共32例為對照組(C組)。所有入組患者均同意并簽署知情同意書。
排除標準:不能配合肺功能檢查者;嚴重心、肝、腎功能損害者。退出標準:患者或家屬以任何理由要求中途退出治療或隨訪期失聯(lián)者。
2.檢測方法 B組患者及C組受檢者入組后清晨空腹抽血,行肺功能檢查,A組患者為入院次日清晨空腹抽血并行肺功能檢查。采用雙抗體夾心酶聯(lián)免疫吸附(enzyme-linked immunosorbent assay, ELISA)試驗法檢測MMP-9、TIMP-1、VEGF的濃度。肺功能檢查結果記錄FEV1及FCV占預計值數(shù)值。
3.肺通氣功能檢測 所有受試對象吸入支氣管舒張劑后行肺功能通氣檢測,測各組研究對象用力最大肺活量(FVC)、第一秒用力呼氣容積(FEV1),計算FEV1/FVC百分比及FEV1占預計值百分比,各做3次,取最佳值。
4.統(tǒng)計學方法 采用SPSS 21.0統(tǒng)計學軟件包處理數(shù)據(jù)。計量資料以均數(shù)±標準差表示,兩組數(shù)據(jù)比較采用獨立樣本t檢驗,三組比較采用方差分析,兩組比較采用SNK法;相關性分析采用Pearson線性相關分析法。以P<0.05為差異有統(tǒng)計學意義。
結 果
1.共納入本實驗受檢者共105例,男性66例,女性39例,年齡46~80歲,平均年齡63.2歲。COPD組和對照組受檢者性別、年齡比較,差異無統(tǒng)計學意義(表1),具有可比性,兩組受試者肺功能指標具有顯著性差異(P<0.01)。
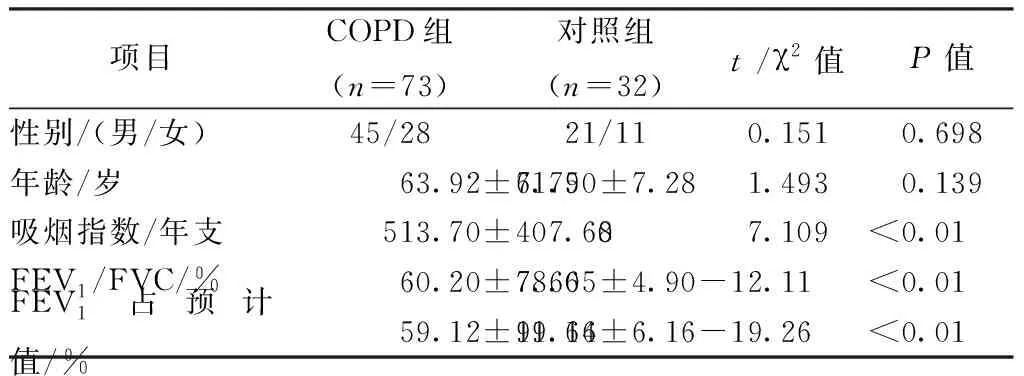
表1 兩組患者一般資料
COPD 組急性加重期患者血清VEGF、MMP-9 及 TIMP-1 的水平以及MMP-9/TIMP-1比值均明顯高于正常對照組,差異均有統(tǒng)計學意義(P<0.01)
2.COPD 組穩(wěn)定期患者血清VEGF、MMP-9 及 TIMP-1 的水平以及MMP-9/TIMP-1比值均明顯高于正常對照組,差異均有統(tǒng)計學意義(P<0.05),尤其是MMP-9、MMP/TIMP-1比值、VEGF水平差異更為顯著(P<0.01,表2)。
COPD 組急性加重期VEGF、MMP-9 及 TIMP-1 的水平以及MMP-9/TIMP-1比值與穩(wěn)定期相比明顯升高,差異均有統(tǒng)計學意義(P<0.05),尤其是MMP-9、MMP/TIMP-1比值、VEGF水平差異更為顯著(P<0.01)。

表2 三組受試者MMP、TIMP-1、VEGF的濃度分析
3.相關分析 (1)對 COPD急性加重期及穩(wěn)定期組患者VEGF、MMP-9 及 TIMP-1 血清濃度進行相關分析,結果見表3。
COPD 組中,MMP-9 與TIMP-1存在顯著正相關性,VEGF與MMP-9、TIMP-1分別具有顯著的正相關性,VEGF與MMP-9/TIMP-1比值有良好的正相關性。
(2)COPD組患者VEGF、MMP-9、TIMP-1濃度與肺功能的相關性分析(表4)。
COPD組患者血漿中MMP-9、TIMP-1濃度、VEGF濃度與FEV1 /FVC%、FEV1占預計值 %均呈顯著負相關性(P<0.01,圖1)。MMP-9/TIMP-1濃度比值與FEV1占預計值 %呈現(xiàn)良好的負相關性(P<0.05),與FEV1 /FVC%成更為顯著的負相關性 (P<0.01)。
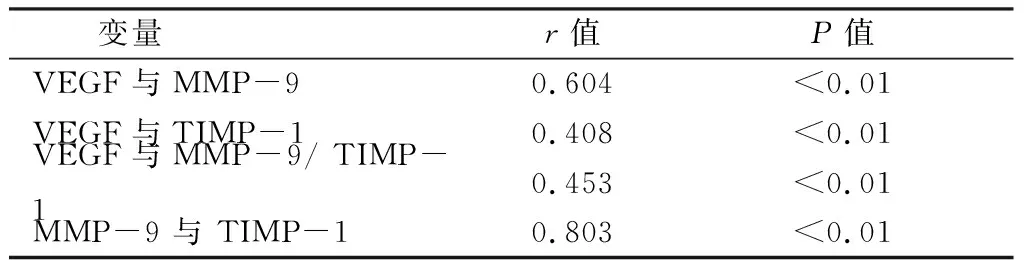
表3 COPD組患者VEGF、MMP-9 及 TIMP-1 血清濃度相關分析結果

表4 VEGF、MMP-9、TIMP-1及MMP-9/TIMP-1與FEV1/FVC%,F(xiàn)EV1占預計值 %相關分析結果
討 論
慢性阻塞性肺疾病是一種慢性呼吸系統(tǒng)疾病,COPD 是可以預防和可以治療的常見疾病[4]。COPD 的發(fā)病機制復雜多樣,目前其具體的發(fā)病機制尚未完全清楚,普遍認為其發(fā)病機制是多種因素作用的結果。蛋白酶/抗蛋白酶失衡學說是近數(shù)十年來較為廣泛接受的COPD發(fā)病機制學說。研究認為,COPD發(fā)生、發(fā)展的重要原因之一是肺組織中彈性基質成分的降解,而調節(jié)細胞外基質ECM降解合成的主要酶類即本研究所涉及的MMP-9及TIMP-1[3]。
基質金屬蛋白酶家族(MMPs)是進化高度保守的一類酶,能降解大部分ECM及蛋白成分,參與呼吸道構建,按底物分為明膠酶、間質膠原酶、基質溶解素、膜型基質金屬蛋白酶及其他;MMP-9又稱明膠酶B,是明膠酶類的主要成分,是一種鋅離子依賴性內(nèi)肽酶,在呼吸系統(tǒng),主要由中性粒細胞、內(nèi)皮細胞、巨噬細胞、單核細胞、平滑肌細胞、小膠質細胞及粒細胞等多種細胞合成和分泌[5]。MMP-9的增加加速了呼吸道管壁ECM的降解,進而使得基底膜崩裂,誘導炎性細胞在氣道的聚集,增加了氣道高反應性[6]。
TIMPs 是一組低分子量糖蛋白,可以抑制MMPs的活性。包括TIMP-1,TIMP-2,TIMP-3,TIMP-4四個家族成員,其中TIMP-1是MMP-9的天然組織抑制劑,正常情況下TIMP-1 以1∶1的分子比例與pro-MMP-9 或MMP-9催化區(qū)中羧基末端特異性結合形成復合物,從而特異性抑制MMP-9的活性,共同維持呼吸道壁修復及破壞之間的平衡,參與支氣管、肺泡壁進行性破壞和不可逆的呼吸道重構過程[7]。
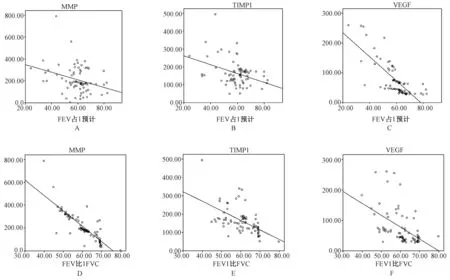
圖1 COPD組MMP-9、TIMP-1濃度、VEGF濃度與FEV1 /FVC%、FEV1占預計值(%)的相關性 A:MMP-9 與FEV1占預計值(%)的相關性;B:TIMP-1與FEV1占預計值(%)的相關性;C:VEGF與FEV1占預計值(%)的相關性;D: MMP-9 與FEV1 /FVC(%)的相關性;E:TIMP-1與FEV1 /FVC(%)的相關性;F:VEGF與FEV1 /FVC(%)的相關性
目前普遍認為MMP-9、TIMP-1共同參與COPD氣道炎癥反應、氣流受限、氣道重塑、血管重建等發(fā)病過程的多個環(huán)節(jié),MMP-9/TIMP-1比值的失衡更是與COPD肺氣腫、肺心病的形成密切相關[8]。國內(nèi)外學者通過測定COPD患者痰液、肺組織、血清中的MMP-9及TIMP-1的濃度,多項研究結果發(fā)現(xiàn)二者比例異于健康人群。Vignola等得出結論:COPD 患者的痰液中MMP-9/ TIMP-1比例下降, 且與FEV1%呈正相關, 此時以TIMP-1增多更顯著[9]。而鑒于肺組織標本取得的風險性、痰標本合格率等影響因素,把MMP-9及TIMP-1在外周血濃度作為COPD患者急性加重和氣道阻力的指標可以更為方便地反映特定人群氣道阻力及氣道重塑的變化。本研究結果顯示,COPD急性加重期患者血清中MMP-9、TIMP-1含量以及MMP-9/TIMP-1比值高,穩(wěn)定期患者上述指標亦增加,且前者增高更為明顯。上述指標均且與氣道阻力指標(包括FEV1/FVC%,F(xiàn)EV1占預計值%)均成負向關系,部分結果與國外學者Higashimoto研究相符[10]。
COPD的患病率及病死率在最近年來呈逐漸上升趨勢, 并有可能在2020年之前成為全球第3位死亡原因[4]。氣道重塑是COPD疾病進程中復雜的病理生理過程,涉及多種因素,最終導致不可逆的氣流受限[11-12]。近年來,血管新生機制在COPD氣道重塑中的作用受到很多學者的關注[13-14]。國內(nèi)外研究認為,許多血管生成促進因子參與了血管新生和肺血管重構的進程,其中VEGF被認為是其中最重要的因子之一[15-16]。而近年來,血管VEGF信號通道在COPD氣道重塑中的作用受到越來越多的關注[17-18]。近年有研究[19]認為VEGF 與COPD 的發(fā)病可能有密切關系,并參與了COPD的病情進展。
VEGF是血小板衍生生長因子家庭成員之一,分為VEGF-A, -B, -C, -D, -E六個等型,VEGFR-1、-2、-3三個血管內(nèi)皮生長因子受體與各等型特異性相結合而發(fā)揮不同的生物學特性[20]。在COPD 病程中, 多種病因造成氣道上皮細胞、血管內(nèi)皮細胞損傷, 激活炎癥反應, 刺激VEGF表達, 肺組織及血中VEGF水平升高并與VEGFR結合,促進內(nèi)皮細胞增殖、增加微血管通透性,促進血管增生并修復血管損傷[21],同時刺激平滑肌細胞分裂增殖,支氣管壁和血管壁的基質增厚,參與慢性炎癥和血管生成,由此導致了氣道重塑,臨床上表現(xiàn)為進行性加重的氣道阻塞[22-23]。
本研究COPD兩個亞組血清VEGF水平均高于對照組,急性加重組升高更為顯著,可能與急性加重期患者缺氧加重[24],炎癥介質釋放增加,肺血管重構加重,造成VEGF的高表達[25]有關。本研究亦顯示,COPD患者血清VEGF水平與氣道阻力指標(包括FEV1/FVC%,F(xiàn)EV1占預計值%)成負向關系,這進一步證實了VEGF是參與COPD血管重塑和氣道重塑的重要物質,與Anna等[26]的研究結果相符。
通過本研究可以表明,MMP-9,TIMP-1與VEGF的表達與COPD嚴重程度及肺功能程度密切相關,這與MMP-9、TIMP-1、MMP-9/TIMP-1失調的水平參與了肺氣腫的形成,氣道阻塞以及VEGF參與血管重塑有關。MMP-9,TIMP-1及 MMP-9/TIMP-1的比率與VEGF明確的相關關系,其內(nèi)部是否存在調控機制尚需進一步細胞層面研究。在 COPD 患者中,我們可以監(jiān)測其血清中 MMP-9,TIMP-1與VEGF的水平變化,預測其氣道重塑、血管重塑及肺功能情況,有著良好的靈敏性及特異性。目前國內(nèi)COPD患者的病情控制不良,COPD患者的生命質量遠差于健康人群[27],因此在疾病早期控制病情進展尤為重要。在疾病早期或急性加重期如可適當使用兩種因子的抑制劑或臨床上的藥物調節(jié)機體內(nèi)水平的變化,預防氣道和血管的重塑,以期對COPD的多個環(huán)節(jié)進行調控,更有利的減慢或逆轉肺功能的進展。

