畢赤酵母糖基化對布魯菌P39抗原誘導巨噬細胞吞噬的影響
劉思陽 王巖 付玉芹 胡祥坤 王茗宇 盧天成 王秀然
(吉林農業大學生命科學學院 生物反應器與藥物開發教育部工程研究中心,長春130118)
布魯菌病是全球性人畜共患傳染病,可引發家畜(豬、羊和牛)發熱、流產及死亡,對農牧經濟造成重大的損失并嚴重威脅人類的健康[1-2]。Rev.1、S19等減毒菌株是目前可用于控制動物布氏桿菌病的有效疫苗之一,但減毒疫苗存在一定的風險,安全性差[3]。布魯菌抗原在激活宿主免疫時,特別是天然免疫的水平較低,不能形成穩定的免疫保護,因此提高蛋白免疫保護水平成為布魯菌亞單位疫苗的熱點[4]。Denoel等[5]研究表明胞間質結合蛋白(P39)作為T細胞免疫布魯菌抗原可誘導Th1導向型的免疫反應,具有較高的免疫原性,因此P39成為很有前景的亞單位候選抗原。
近年來通過糖基化修飾改變蛋白質的生物學活性,提高蛋白免疫保護水平在疫苗領域備受關注,已有部分疫苗應用于臨床[6-8]。有研究表明,通過糖基化修飾后的蛋白可激活宿主TLR4受體系統,提高宿主細胞天然免疫水平,從而提高抗原的免疫保護作用[9]。
本研究選取可進行糖基化修飾的畢赤酵母表達系統[10],對布魯菌優勢抗原蛋白P39進行分泌表達,探究其修飾后對巨噬細胞吞噬的影響。為進一步研究糖基化影響蛋白免疫原性的機理,開發新型糖基化布魯菌亞單位疫苗提供理論和實驗依據。
1 材料與方法
1.1 材料
大腸桿菌Escherichia coliTOP10株購自全式金生物公司(北京,中國)畢赤酵母P. pastoris GS115由山東大學微生物實驗室惠贈(山東,中國)、pPICZαA真核表達載體購自Invitrogen公司(長春,中國)、布魯菌(B.melitensis16M)DNA由軍事醫學科學院軍事獸醫研究所提供。
ExTaq DNA 聚合酶、T4 DNA ligase、EcoR I、NotI、SacI、DNA marker 均為TaKaRa公司產品(長春,中國),Zeocin 為Invitrogen公司產品(長春,中國);Protein Find Anti-His Mouse Monoclonal Antibody、Protein Find Goat Anti-Mouse IgG(H+L),HRP Conjugate購自全式金公司(北京,中國)。PNGaseF糖苷酶購自NEB公司(上海,中國);PVDF膜、濾紙購自promega公司(上海,中國),引物合成及基因測序由上海華大基因有限公司完成(上海,中國)。
1.2 方法
1.2.1 畢赤酵母真核表達載體pPICZαA-P39 的構建根據GenBank公布的Brucella melitensis16M(GenBank Accession ID:WP:087932960)序列,應用DMAMAN及primer 5.0基因分析軟件,設計擴增P39基因序列,以布魯菌基因組為模板進行PCR擴增。上游引物序列gaattc(EcoR I)ATGGCACCTGTTGCCAATGC,下游引物序列gcggccg(NotI)TTTTGCGGCTTCAACCGCC。將膠回收的 PCR 擴增產物P39基因與pPICZα-A 質粒用EcoRI、NotI進行雙酶切,將酶切后的P39基因片段用 T4DNA 連接酶連接pPICZα-A 載體上,熱激法轉化大腸桿菌 TOP 10 感受態細胞中。經雙酶切鑒定正確后送上海華大基因有限公司測序。
1.2.2 重組蛋白P39的誘導表達 挑取生長在Zeocin抗性YPD平板上的陽性單菌落,接種于5 mL的BMGY液體培養基中,在50 mL三角瓶中培養,28℃、250 r/min搖床培養16-20 h,至OD600值約為2.0-4.0,此時酵母菌處于對數生長期。離心收集菌液,6 000 r/min,4℃離心,收集沉淀,重懸于5 mL的BMMY液體培養基,轉入50 mL的BMMY液體培養基中,250 mL三角瓶繼續震蕩培養。每隔24 h加入1%的甲醇進行誘導表達。同時電轉化空載體pPICZαA的GS115菌株作為陰性對照。培養96 h后收集樣品,10 000 r/min,4℃離心2 min,取上清進行SDS-PAGE分析蛋白的表達情況。
1.2.3 重組蛋白P39的純化 將收集好的上清液進行真空凍干,10 mmol/L,pH 7.4的磷酸鹽溶液(PBS)透析48 h,0.22 μm無菌過濾器過濾,利用Sephacryl S-100蛋白層析純化柱純化,20 mmol/L NaCl洗脫蛋白,每管3 mL,Nanodrop在280 nm處檢測吸光值,SDS-PAGE鑒定各層析成分。
1.2.4 蛋白P39免疫印跡實驗(Westen blot)鑒定 通過 Western blotting 檢驗純化后的重組目的蛋白。SDS-PAGE后100 V恒壓轉膜55 min。用5%脫脂奶粉室溫封閉2 h,TBST漂洗3次,加入1∶1 000 稀釋的抗his標簽鼠單克隆抗體,37℃孵育45 min,TBST 漂洗3次后,加入1∶1 000稀釋的HRP標記的羊抗鼠IgG抗體,室溫孵育45 min,TBST漂洗3次后用DAB顯色試劑盒進行顯色(購自sigma公司),觀察目的條帶并記錄結果。
1.2.5 發酵條件對蛋白表達量的影響
1.2.5.1 pH值對重組蛋白P39表達量的影響 取陽性重組菌以1%的接種量分別接入pH值分別為3.0、5.0、6.0、8.0的200 mL BMGY培養基中,鹽濃度0.05M,28℃搖床培養,至OD600值為0.6-0.8時,1%甲醇誘導72 h。
1.2.5.2 磷酸鹽濃度對重組蛋白P39表達量的影響 取陽性重組菌以1%的接種量分別接入磷酸鹽濃度分別為0.02 mol/L、0.05 mol/L、0.1 mol/L和0.2 mol/L的BMGY培養基進行培養,pH 6.0,OD600值為0.6-0.8時,1%甲醇誘導72 h。
1.2.5.3 甲醇濃度對重組蛋白P39表達量的影響 取陽性重組菌以1%的接種量BMGY培養基中,28℃搖床培養,鹽濃度0.05 mol/L,pH 6.0,OD600值為0.6-0.8時,分別以0.5%、1%、2%和3%不同濃度的甲醇誘導72 h。
1.2.5.4 誘導時間對重組蛋白P39表達量的影響 取陽性重組菌以1%的接種量BMGY培養基中,28℃搖床培養,鹽濃度0.05 mol/L,pH 6.0,OD600值為0.6-0.8時,以1%濃度的甲醇分別誘導24 h、48 h、72 h和 96 h。
1.2.5.5 NanoDrop檢測蛋白濃度 以100 μg/mL牛血清白蛋白作為對照,對目的蛋白進行蛋白濃度標定。
1.2.6 酵母分泌表達的P39蛋白糖基化鑒定 將純化后10 μg的真核蛋白加入1 μL糖蛋白變性緩沖液,總體積10 μL。100℃變性10 min,加入2 μL的glycobuffer,10% NP-40和1 μL的PNGaseF糖苷酶,37℃,孵育1 h。500 MHz核磁共振氫譜檢測重組P39蛋白糖基化修飾水平。
1.2.7 巨噬細胞RAW264.7吞噬熒光抗原實驗 將FITC與真核蛋白及原核蛋白進行混合反應,在4℃避光反應18 h后收集樣品。復蘇RAW264.7巨噬細胞后將其以105個每孔接種于24孔板中,加入FITC標記的真核蛋白和原核蛋白,PBS作為空白對照組,熒光顯微鏡觀察巨噬細胞吞噬抗原蛋白情況,分別記錄4 h、6 h不同時間巨噬細胞吞噬蛋白情況。
2 結果
2.1 構建真核表達載體pPICZαA-P39
DNA核酸電泳顯示成功構建pPICZαA-P39真核表達載體,電轉化后挑選出的陽性菌株。條帶大小與理論的片段大小一致為1 206 bp,如圖1所示。
2.2 真核P39抗原表達純化與Western blot鑒定
甲醇誘導陽性轉化子表達,SDS-PAGE檢測P39蛋白的表達,目的條帶在45 kD處,如圖2。目的蛋白條帶與理論值大小一致,純化后的蛋白純度較好,高效液相色譜檢測純化蛋白純度,純度可達93.77%,如圖3和圖4所示。經Western blot免疫印跡法檢測確定該蛋白為P39蛋白,特異性良好,如圖5所示。
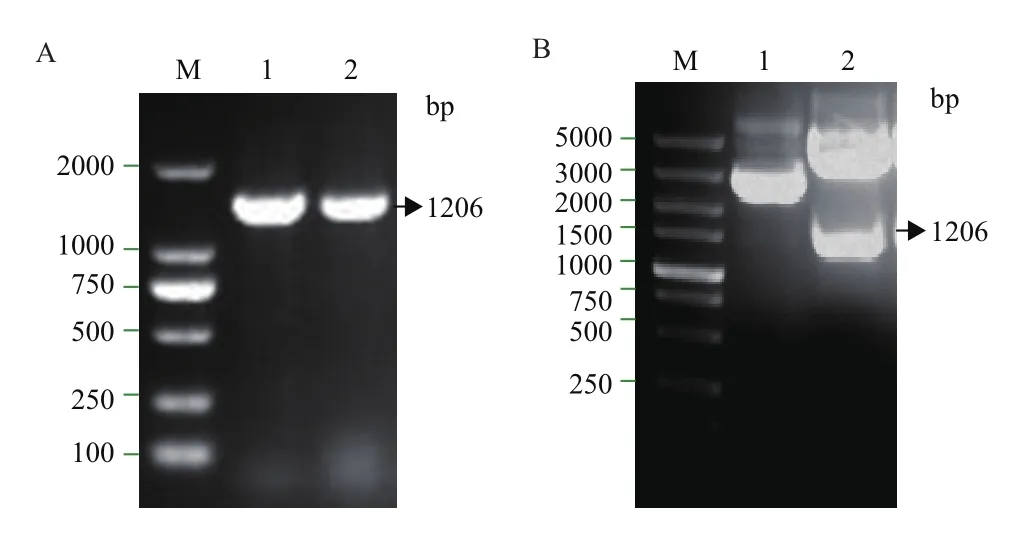
圖1 真核表達載體pPICZαA-P39的構建
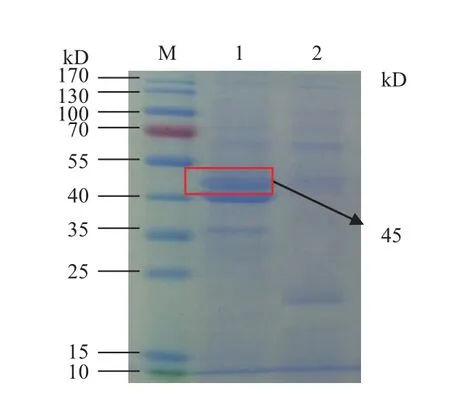
圖2 SDS-PAGE分析重組蛋白在畢赤酵母中的表達
圖3 純化后重組蛋白P39
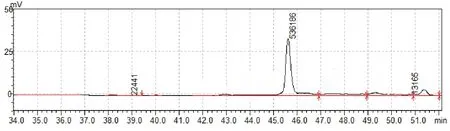
圖4 高效液相色譜(HPLC)檢測純化蛋白純度

圖5 重組蛋白P39 western blot鑒定
2.3 真核P39抗原發酵條件的優化
2.3.1 pH值對重組蛋白P39表達量的影響 由圖6-A可以看出,蛋白得率隨pH的升高先增高后降低,當pH至為6時,蛋白的得率最高,實驗表明該重組蛋白在酸性或弱堿性的條件下表達條件較好,所以,最佳的發酵pH 6左右,最高得率為3.86mg/mL。

圖6 不同因素對P39蛋白表達量的影響
2.3.2 鹽濃度對重組蛋白P39表達量的影響 由圖6-B可見,隨磷酸鉀濃度的升高蛋白得率降低,在磷酸鉀濃度為0.05 mol/L時,蛋白得率最高,過高的鹽濃度可能會抑制蛋白的表達,所以,最佳的磷酸鉀濃度為0.05 mol/L,最高得率為3.64 mg/mL。
2.3.3 甲醇濃度對重組蛋白P39表達量的影響 由圖6-C可見,隨甲醇誘導濃度的增加蛋白得率先增加后減少,在甲醇濃度1%時,蛋白得率最高,低濃度和高濃度的甲醇對蛋白的表達都有不利影響,最佳的甲醇誘導濃度1%,最高得率為4.96 mg/mL。
2.3.4 誘導時間對重組蛋白P39表達量的影響 由圖6-D可見,隨誘導時間的增加,蛋白得率出現先增加后下降的趨勢,過長時間的誘導不利于目的蛋白的表達,實驗表明,誘導72 h的條件下,長時間的誘導可能導致蛋白降解,所以,72 h蛋白得率最高,最高得率為5.05 mg/mL。
2.4 酵母分泌表達的P39蛋白糖基化鑒定
本研究對酵母表達的 P39蛋白和利用PNGaseF糖苷酶酶解的 P39蛋白利用核磁共振氫譜進行了糖基化修飾分析,結果(圖7-C)表明,重組蛋白圖譜在3.6-3.8 ppm處出現寡糖H信號,說明在純化后的重組蛋白上存在糖信號,重組后的 P39蛋白在畢赤酵母中發生糖基化修飾。同時利用PNGaseF糖苷酶酶解蛋白N-糖鏈后的重組 P39蛋白糖信號未消失,P39 蛋白存在潛在的糖基化修飾位點,但酶解后糖信號仍然存在,說明蛋白的糖基化形式不是理論上N-糖修飾類型,畢赤酵母表達系統對蛋白的糖基化修飾主要表現為N-糖修飾和 O-糖修飾兩種類型,綜合上述結果表明該重組 P39蛋白的糖基化形式可能是O-糖基化修飾[11-12]。
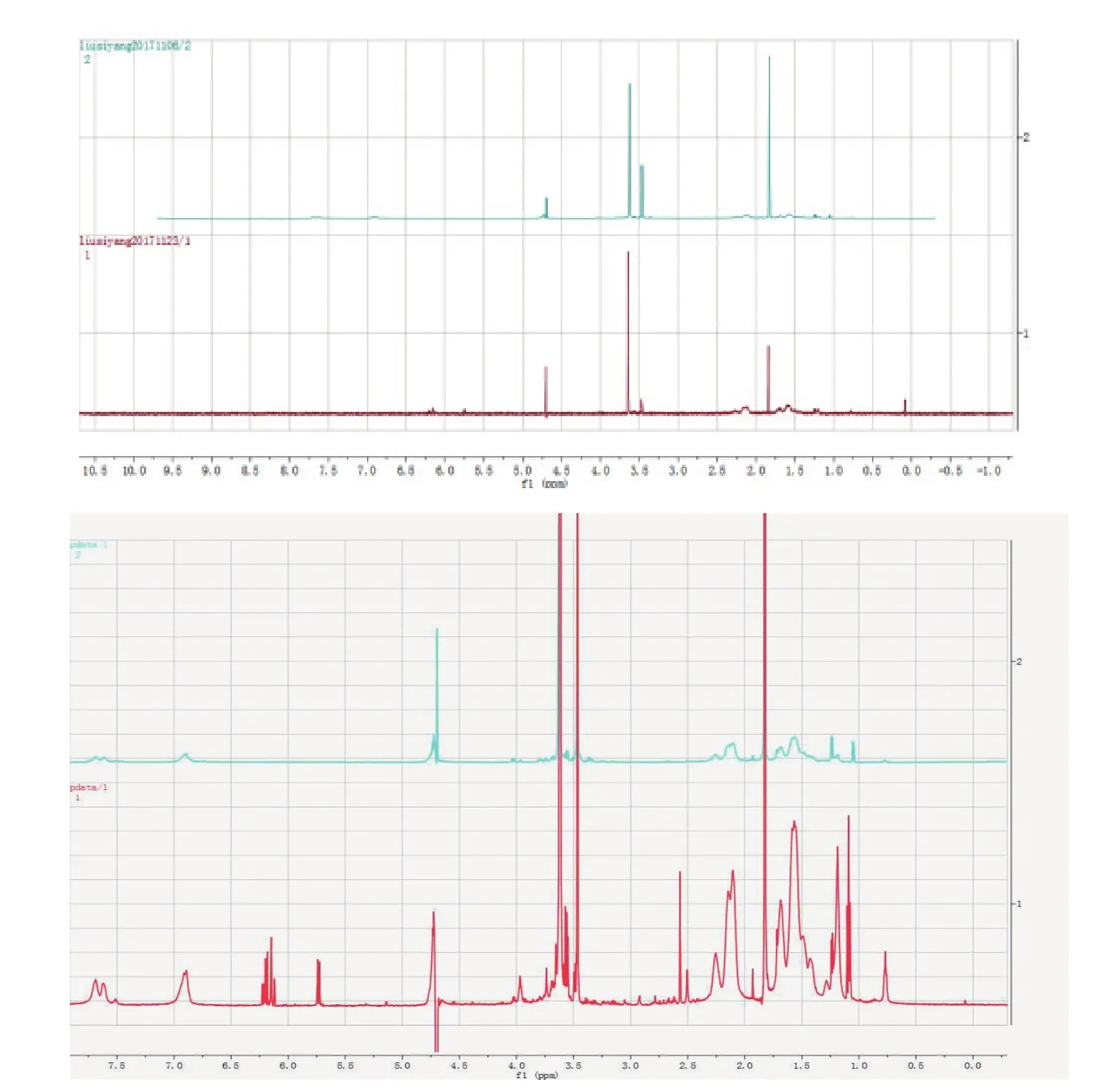
圖7 一維核磁共振氫譜(1H NMR)分析蛋白糖基化
2.5 巨噬細胞RAW264.7吞噬熒光蛋白
熒光顯微鏡觀察實驗結果顯示,兩種蛋白在 2 h開始出現熒光,熒光強度隨時間呈現增強趨勢,真核蛋白出現熒光效果早于原核蛋白,在 6 h時熒光現象明顯,PBS空白對照組未見明顯熒光細胞。根據圖8顯示,巨噬細胞吞噬真核蛋白的熒光強度明顯優于吞噬原核蛋白。說明糖修飾對巨噬細胞的吞噬作用具有一定的影響,可增強蛋白的免疫原性[13]。
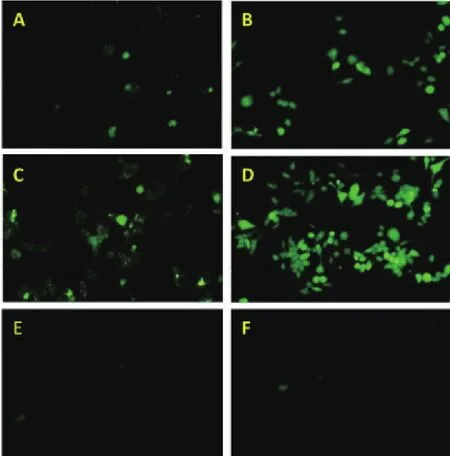
圖8 檢測巨噬細胞吞噬熒光蛋白情況
3 討論
布魯菌進入宿主細胞之后,可被宿主免疫系統分解,同時釋放細胞質結合蛋白,這些蛋白質分子繼續發揮免疫刺激與侵染的作用[14]。P39蛋白是布魯菌優勢抗原,其蛋白可以有效地誘導機體產生特異性免疫應答,而且P39基因在多個不同種型布魯菌中高度保守,該成分可以在不同的布魯菌中形成交叉保護作用,用于制備的新型布病疫苗具有較大優勢[15-16]。近年許多研究表明,糖基化對蛋白的結構和活性有很大的影響,消除N-糖基化位點可延長IFN-α/ Fc融合蛋白的半衰期[17],糖鏈長短的變化及不同糖型的修飾都會影響蛋白的生物活性[18-19],本課題組發現甘露六糖修飾后的布魯菌 AHCY蛋白的免疫性得到大幅度的提升[20],說明糖修飾會改變蛋白的生物功能,這為開發安全有效的布魯氏菌亞單位疫苗提供了可能。
本實驗中,為獲得大量 P39抗原,選擇具有分泌優勢的畢赤酵母表達系統,并在酵母體內對 P39抗原蛋白進行天然的糖基化修飾。結果發現,糖基化后的 P39蛋白更容易被巨噬細胞捕獲,與原核表達的 P39蛋白相比,其結合巨噬細胞的效率更好,也更有可能高效的激活巨噬細胞。重組后的 P39蛋白顯示出優于原核 P39蛋白的免疫原性,這可能是由于糖鏈的存在及其結構引發的改變,在 P39蛋白的理論 N-端糖基化位點并為發生修飾作用,說明糖基化的修飾可能存在隨機性,或是由于蛋白空間結構折疊后掩蓋其理論的糖基化位點,使其潛在的糖基化位點未進行修飾。隨著基因工程的發展,已經實現了在分子水平對酵母糖基化系統進行改造,從而更有利于生產人源糖蛋白藥物及亞單位疫苗的開發[21-22]。
4 結論
本研究成功在畢赤酵母中分泌表達 P39抗原,優化發酵條件產量可達 5.05 g/L,通過核磁共振氫譜結果表明 P39抗原發生糖基化修飾,糖基化修飾后的 P39抗原被巨噬細胞捕獲的程度明顯高于原核蛋白,說明糖基化修飾作用會在一定程度上影響蛋白的免疫原性。