膿毒血癥性急性腎損傷的發生機制
馬成龍,曾加禮
膿毒血癥是指致病菌感染導致的宿主反應紊亂,引發的致命性器官功能障礙的病癥[1-2]。急性腎損傷(AKI)是膿毒血癥常見且最嚴重的并發癥[3]。膿毒血癥性AKI的主要臨床表現為腎小管上皮細胞出現急性損傷,提示患者病情加重,甚至可能引起多臟器衰竭。研究表明,膿毒血癥性AKI的發病機制與腎臟血流動力學變化、炎癥介質浸潤、腎臟細胞凋亡等相關[4],其中腎小管上皮細胞凋亡可能起重要作用[5]。有研究報道,Tec非受體型激酶與膿毒血癥的發病機制相關,成為治療膿毒血癥的新靶點[6],但是Tec非受體激酶在膿毒血癥AKI發病中扮演什么角色,是否與膿毒血癥AKI的發病過程相關,尚未得知。因此,本研究分析討論了Tec非受體激酶在膿毒血癥性AKI發病過程中的變化,探討其在膿毒血癥性AKI發病機制中的作用。
1 材料與方法
1.1 主要試劑與設備 Immun-blot PVDF膜(Bio-Rad公司,美國);ECL化學發光試劑盒(Pierce公司,美國);LC3-Ⅱ及 Beclin-1的蛋白單克隆抗體(Pierce公司,美國);Experion全自動電泳系統(Bio-rad公司,美國)。
1.2 動物分組及樣本采集 選取健康雄性清潔級雄性SD大鼠(中科院上海實驗動物中心,合格證書2015-025)32只,隨機分為2組,每組16只,常規飼養7 d。模型組給予腹腔注射脂多糖(LPS)20 mg/kg建立膿毒血癥模型,建模成功后進行充分的液體復蘇。正常組給予腹腔注射等量生理鹽水。分別在建模后1、24和48 h,麻醉動物,心臟穿刺取血,置于EP管中靜置,待凝固后于37℃水浴30 min,離心分離血清備用(當天檢測)。此外,在建模后1、24和48 h,每組各隨機選擇4只大鼠,取右腎上極組織,10%福爾馬林固定,石蠟包埋、切片,蘇木素伊紅(HE)染色,于顯微鏡下觀察腎小管細胞形態。
1.3 檢測指標
1.3.1 血生化指標 使用A720全自動生化分析儀(北京松上技術有限公司),采用紫外-谷氨酸脫氫酶法檢測血清尿素氮(BUN)水平,采用改良苦味酸速率法檢測血清肌酐(Cr)水平,采取免疫比濁法檢測血清胱抑素C水平(CysC),采用ELISA法檢測血清白介素 -1β(IL-1β)和腫瘤壞死因子 -α(TNF-α)水平。
1.3.2 腎小管間質損傷指數評分 采用Paller法,對大鼠腎小管間質損傷程度進行評估。在光鏡下,每個大鼠腎組織隨機選取10個無重疊視野(放大倍數×200),觀察腎小球以及腎小管間質細胞形態,通過病理專科醫生采取盲法的原則,對病理觀察結果進行評分,評分標準:腎小管明顯擴張、細胞扁平,計1分;刷狀緣損傷,計1分;脫落,計2分;管型,計2分;腎小管管腔內有脫落、壞死的細胞(未成管型或細胞碎片),計2分。得分越高,表示腎小管間質損傷越嚴重。
1.3.3 腎小管自噬體膜標志蛋白微管相關蛋白水平檢測 采用 Western blot法檢測 Tec、LC3-Ⅱ及Beclin-1的表達水平,將Western blot膠片掃描,通過凝膠成像處理系統,測定目的條帶的光密度,以對應的β-actin蛋白條帶為對照,計算Tec、LC3-Ⅱ及Beclin-1與β-actin蛋白積分光密度比值(ODI)。
1.4 統計學方法 應用SPSS20.0統計軟件分析,計量資料以±s表示,行t檢驗;計數資料以例和百分率表示,行χ2檢驗;P<0.05為差異有統計學意義。
2 結果
2.1 兩組腎功能變化 與正常組相比,建模后1 h,模型組血Cr和BUN無明顯變化,而血CysC已升高(P< 0.05);建模后 24 h,血 Cr、BUN 及 CysC 水平均升高;建模后48 h,血Cr及BUN水平下降到接近正常范圍,而血CysC水平仍明顯高于正常組(P<0.05)。 見表 1。
2.2 兩組炎癥因子水平及腎小管間質損傷程度變化 在建模后各時間點,模型組TNF-α、IL-1β水平均升高,其中TNF-α在建模后1 h即升高,之后顯著降低,但48 h時仍明顯高于正常對照組(P<0.05);IL-1β在建模后1 h即開始升高,24 h時達峰值,其后開始下降,但均明顯高于對照組(P<0.05)。模型組在建模后各個時間點腎小管間質損傷指數均明顯升高(P<0.05),尤其在建模24 h時最為明顯。見表2。
2.3 兩組腎小管Tec激酶蛋白水平及自噬體膜標志蛋白比較 與正常組比較,模型組各個時間點Tec、LC3-Ⅱ及 Beclin-1水平均呈現先升高,后降低變化趨勢,但均顯著高于正常組(P<0.05)。見表3。
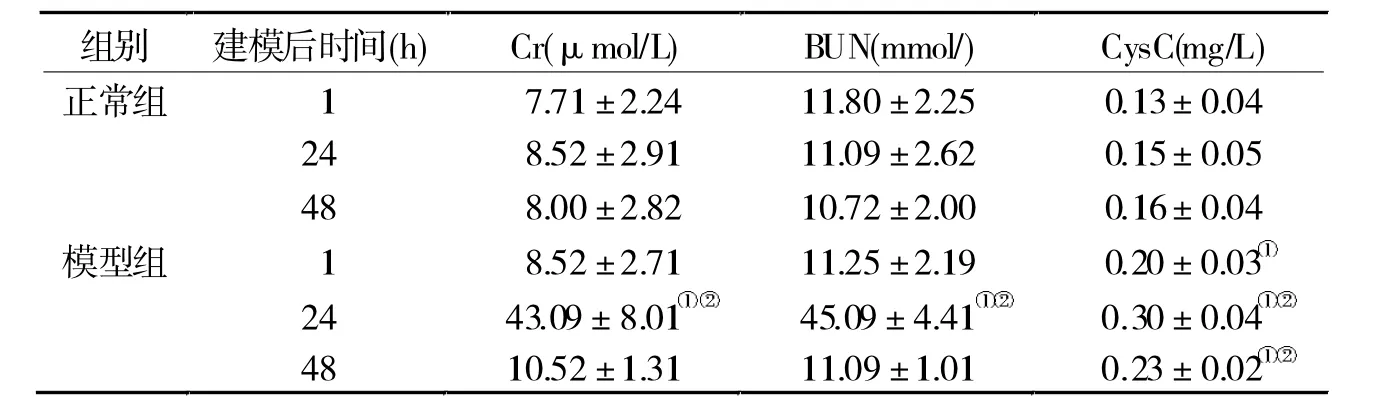
表1 兩組不同時間腎功能變化(n=16)
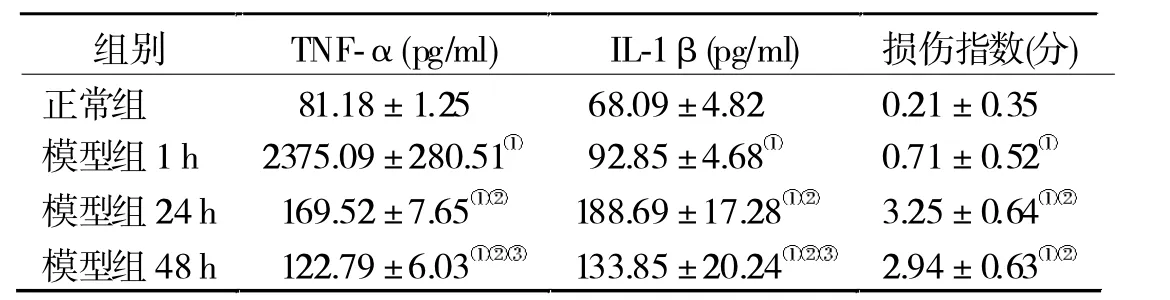
表2 兩組炎癥因子水平及腎小管間質損傷程度變化(n=16)
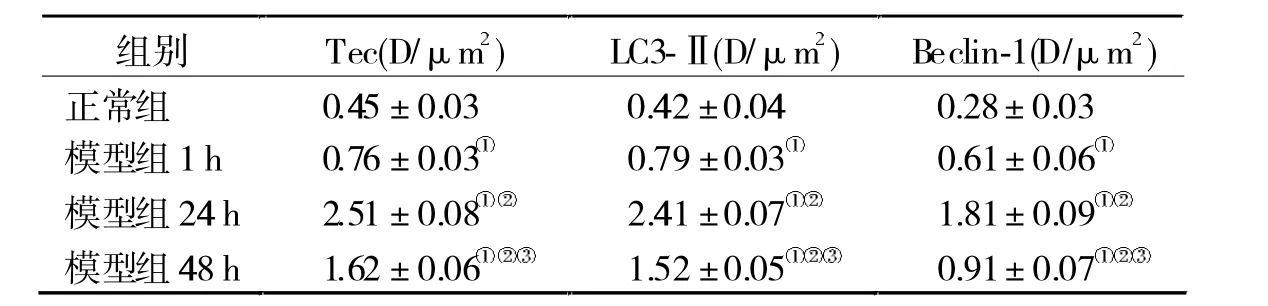
表4 兩組腎小管Tec激酶蛋白水平及自噬體膜標志蛋白比較(n=16)
3 討論
膿毒血癥是一種臨床上十分常見的能夠導致患者全身多個臟器發生損傷的病理過程[7],是由于感染而導致的全身性炎癥反應綜合征,嚴重者可導致患者死亡[8]。AKI是膿毒血癥的常見并發癥之一。TNF-α及IL-1β均是炎癥因子,能夠引發細胞因子風暴的發生,并放大機體的炎癥級聯反應。本研究發現,模型組在建模后 1、24、48 h 各時間點,TNF-α、IL-1β水平均明顯升高,說明膿毒血癥早期就可引起大量釋放炎性因子,TNF-α及IL-1β參與了膿毒血癥性AKI的發生、發展過程。
CysC是一類非糖基化的堿性小分子蛋白[9-10],是反映腎臟功能的重要指標,CysC在腎功能正常時,由腎小球濾過,在近曲小管重吸收而被清除。本研究發現,與正常組比較,建模后1 h,模型組血BUN及Cr水平無明顯變化,而血CysC已明顯升高;建模后24 h,模型組血Cr、BUN及CysC水平均明顯升高;建模后48 h,血Cr及BUN水平下降到接近正常范圍,而血CysC水平仍明顯高于正常組,表明建模后大鼠腎小球過濾功能及腎小管重吸收及分泌功能均損傷,且在膿毒血癥的早期就存在腎臟損傷。
Tec激酶家族屬于目前研究較多的熱點蛋白。Tec非受體激酶與受體型蛋白酪氨酸不一樣,其參與了信號轉導,能夠對多種關鍵信號傳導路徑進行調節[11]。國外研究發現,Tec家族在單核巨噬細胞的功能中具有十分關鍵的作用[12],并可能與Toll樣受體蛋白相互作用,通過免疫途徑調節細胞的自噬和凋亡。膿毒血癥性AKI的發病機制與腎小管上皮細胞的凋亡密切相關,而Tec非受體激酶是否通過免疫途徑調節腎小管上皮細胞的自噬和凋亡,目前研究較少。本研究發現,與正常組相比,建模后各個時間點模型組腎小管細胞Tec非受體激酶蛋白水平明顯升高,尤其24 h更為明顯,48 h較前有所降低,但較正常組升高明顯。這些結果與大鼠建模后腎功能相關指標的變化趨勢大體一致,由此推測,Tec非受體激酶可能參與了膿毒血癥性AKI的發生、發展,但具體的作用機制還需要更進一步研究分析。
LC3-Ⅱ及 Beclin-1均為自噬體膜標志蛋白,與細胞間自噬或凋亡相關。自噬與凋亡之間是一種十分復雜的交互調控,二者可以被很多應激刺激共同激活,甚至能夠相互協調轉化等。在本研究中,建模后各個時間點模型組自噬體膜標志蛋白表達LC3-Ⅱ及Beclin-1的蛋白表達均明顯升高,尤其24 h時最為明顯,48 h時雖有所降低,但較正常組仍升高明顯,表明膿毒血癥大鼠的自噬體膜標記蛋白水平上升,機體內自噬體數量上升,并有可能誘發細胞凋亡,這一現象與膿毒血癥AKI的發病具有密不可分的關系[13]。
綜上所述,Tec非受體激酶可能參與膿毒血癥AKI的早期發病,并可能通過參與免疫途徑調節細胞自噬和凋亡的機制而發揮作用。

