轉染CXCR4的MSCs對放射性肺損傷組織中細胞因子的影響
張春陽,祝 艷,馮華松
目前針對放射性肺損傷(RILI),仍缺少有效的治療手段。研究發現,間充質干細胞(MSCs)具有減輕放射性肺損傷、肺纖維化的作用[1],且目前已開展臨床試驗研究探索[2],但具體的作用機制仍不完全清楚。研究發現,通過提高MSCs上CXCR4基因的表達后,可增強其向受損傷組織部位的歸巢,提升治療效果[3]。前期研究中[4],筆者已證實通過慢病毒轉染,使來源于臍帶的MSCs過表達CXCR4基因后,MSCs的趨化、遷移能力提高。目前國內尚無關于病毒轉染CXCR4的MSCs對RILI中細胞因子影響的報道。本研究通過觀察慢病毒轉染CXCR4的MSCs對參與放射性肺損傷的10 kDa干擾素γ誘導蛋白(IP-10)、轉化生長因子 β1(TGF-β1)、血小板源生長因子 (PDGF)、腫瘤壞死因子 -α(TNF-α)和基質金屬蛋白酶(MMPs)-2的影響,探討轉染CXCR4的MSCs治療RILI可能的機制,為MSCs在臨床中的應用提供新的理論基礎。
1 材料與方法
1.1 實驗材料
1.1.1 細胞來源與準備 新生兒臍帶來源于醫院婦產科,經醫院倫理委員會批準,與產婦及家屬簽署知情同意書后,無菌條件下留取剖宮產的足月健康新生兒臍帶,經組織塊法貼壁培養[5],實驗采用第3代細胞。MSCs已進行多向分化和免疫表型鑒定[5]。通過慢病毒轉染第3代MSCs,治療組細胞采用攜帶 CXCR4和 EGFP的慢病毒載體(LV-CXCR4-EGFP),對照組細胞采用僅攜帶EGFP的慢病毒載體(LV-EGFP)進行轉染,具體方法見參考文獻[4]。
1.1.2 主要試劑及設備 CXCR4基因設定來源于人類,GENE ID為 7852,Genebank編號為 NM_001008540。CXCR4慢病毒載體,由上海吉凱基因化學技術有限公司協助構建,載體為GV287,分子量為 10.4 kb,元件順序為:Ubi-MCS-3FLAG-SV40-EGFP,克隆位點為AgeI/AgeI。C57雌性小鼠,購自軍事醫學科學院,動物合格證號:SCXK-(軍)2012-0004。DMEM/F12培養基、青霉素、鏈霉素(Hyclone公司,美國),胰蛋白酶(Trypsin)(Invitrogen 公司,美國),胎牛血清(FBS)(Gibco 公司,美國),羥脯胺酸(HYP)、丙二醛(MDA)ELISA試劑盒(華美生物有限公司),PDGF、TGF-β1 ELISA 試劑盒(Abcam 公司,美國),TNF-α ELISA試劑盒(Abcam公司,美國)。熒光倒置顯微 鏡 (Olympus 公司,CKX-41,日本),酶標儀(Thermo 公司,美國)。
1.2 實驗方法
1.2.1 構建放射性肺損傷小鼠模型 將24只雌性出生后2個月左右的C57小鼠,隨機分為4組:正常組、照射組、對照組和治療組,每組各6只。照射組、對照組和治療組小鼠腹腔注射5%水合氯醛(每只0.006 ml/g)麻醉后,呈俯臥位固定鼠板上。調整直線加速器照射野,設定照射參數(13 Gy,6 MV,3.68 Gy/min),窗寬 20 cm×2.5 cm,源距 1 m,給予全肺一次性X線照射。照射之后,將小鼠放置動物房繼續飼養。
1.2.2 各組干預措施 對照組和治療組于放射線照射后第1 d,分別自小鼠尾靜脈注射LV-EGFP和LV-CXCR4-EGFP轉染后的MSCs,每只細胞數量5×105/0.2 ml。正常組和照射組,分別經尾靜脈注射約0.2 ml的0.9%生理鹽水。
1.3 熒光顯微鏡觀察 放射線照射后的第7 d,處死小鼠后留取肺組織檢測。取小鼠右肺下葉肺組織標本,進行冰凍切片,厚度5 μm;用含DAPI的甘油封片劑封片,熒光倒置顯微鏡下觀察EGFP標記的MSCs在肺組織的分布情況。
1.4 病理組織學觀察 左肺下葉標本進行石蠟包埋、切片,厚5 μm,行HE染色,光鏡下觀察病理組織學的變化。
1.5 ELISA檢測 取小鼠右肺上葉標本,組織勻漿后,采用相應的ELISA試劑盒檢測HYP、MDA、IP-10、TGF-β1、PDGF、TNF-α 和 MMP-2 的含量。
1.6 統計學方法 應用SPSS16.0統計軟件分析數據,實驗數據以±s表示,多組間比較采用單因素方差分析,P<0.05為差異有統計學意義。
2 結果
2.1 MSCs在肺組織中分布 熒光顯微鏡觀察發現,對照組和治療組肺組織內有綠色熒光表達的細胞,且治療組表達綠色熒光的細胞數量多于對照組;而照射組肺組織內未見明顯的綠色熒光表達(圖1)。

圖1 熒光顯微鏡檢測小鼠肺組織內EGFP標記的MSCs分布
2.2 病理組織學觀察 HE染色可見,正常組肺組織肺泡壁完整,肺間質無增厚,無明顯的炎性細胞滲出、浸潤,結構組織清晰(圖2a);照射組肺組織可見肺泡間隔增厚,伴有大量炎性細胞浸潤,部分肺泡腔逐漸變小,部分萎陷,肺泡正常結構破壞(圖2b);治療組和對照組肺組織內,亦可見局部肺泡間隔增厚,炎性細胞浸潤,但肺泡間隔增厚程度明顯較照射組減輕,肺泡組織結構破壞也較照射組明顯減輕(圖 2c、d)。
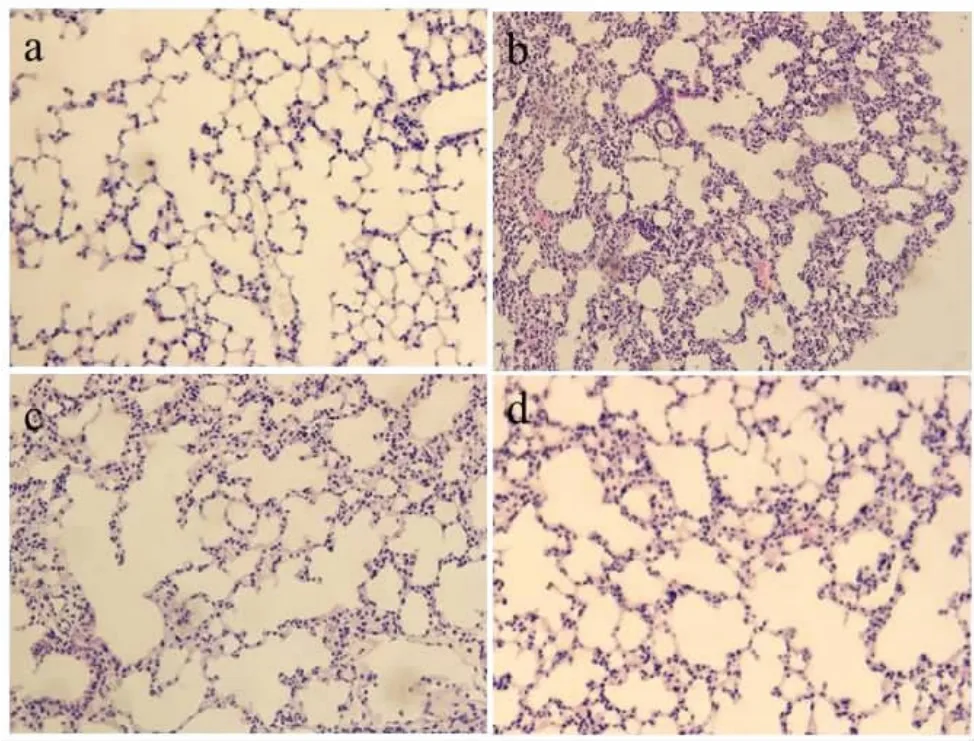
圖2 小鼠肺組織病理組織學HE染色
2.3 ELISA檢測結果 與正常組比較,照射組肺組 織 內 HYP、MDA、IP-10、TGF-β1、PDGF、TNF-α 和MMP-2表達明顯升高(P<0.01),而治療組和對照組較照射組明顯下降(P<0.01)。與對照組比較,除TNF外,治療組其他指標下降的更加明顯(P<0.01)。見表1。
3 討論
本研究發現,治療組肺組織內EGFP標記的MSCs數量比對照組增多,提示轉染CXCR4后MSCs歸巢能力提高,與前期體外研究的結果相符合[4]。同時,組織病理學結果和反映組織氧化應激損傷的MDA和纖維化程度的HYP含量檢測發現,轉染CXCR4的MSCs較對照組MSCs,更明顯地減輕放射線導致的氧化應激反應,并減少HYP的升高,提示其具有更好的減輕RILI作用。
RILI發生、發展過程中,涉及多種細胞因子和靶細胞相互作用,有促進和修復作用的細胞因子是影響 RILI發展趨勢的主要因素[6]。IP-10、TGF-β1、PDGF、TNF-α和MMPs被認為具有參與損傷、介導炎癥反應、促進纖維化形成的作用[6]。IP-10是屬于CXC趨化因子家族的促炎細胞因子,在免疫系統不同的細胞系中起到誘導趨化性作用[7],被認為參與介導RILI免疫反應[6]。TGF-β1是致纖維化細胞因子,被認為是放射性肺損傷重要的標志物之一[8],給予輸注MSCs后,可降低RILI小鼠體內TGF-β1的水平[9]。PDGF具有趨化炎癥細胞、成纖維細胞的作用,使肺內成纖維細胞分裂和增殖增加,促進纖維化的形成[10]。TNF-α是促炎性反應的細胞因子[10],在RILI的發生和維持過程中具有重要作用。MSCs通過拮抗TNF-α阻斷纖維化信號通路[11]。研究發現[12],肺纖維化早期階段,MMPs的水平升高,降解細胞外基質的作用增強,從而損傷肺組織。本研究發現,上述細胞因子在放射線照射后小鼠肺組織內表達均明顯升高,與文獻報道相一致。而在給予MSCs后,其表達水平均顯著下降,其中轉染CXCR4的MSCs相對于對照組,其抑制作用更加明顯,提示轉染CXCR4的MSCs具有更好的抑制放射線照射致細胞因子異常表達作用,從而減輕RILI。這有可能與提升MSCs趨化歸巢能力后,使進入局部損傷組織的MSCs增多有關,但不能排除局部由于過表達CXCR4后,影響了RILI組織內其他的信號通路機制導致有關,還需要進一步研究明確。
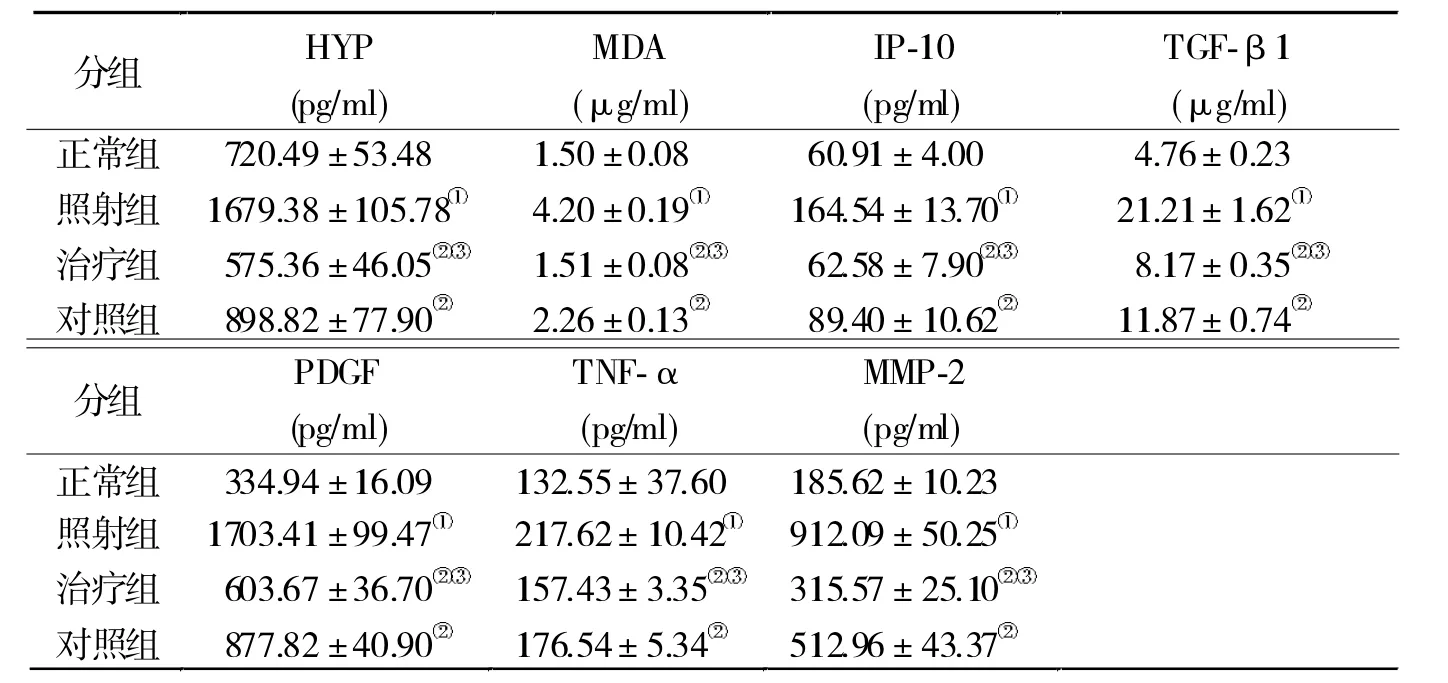
表1 各組ELISA檢測結果比較(n=6)
綜上所述,通過輸注轉染CXCR4的MSCs可更好地減輕RILI,更有效地抑制參與RILI細胞因子的異常升高,為今后利用基因修飾的MSCs治療RILI提供有力的理論依據。

