外源NO及反向調控PEG脅迫下苜蓿萌發種子抗氧化酶及其同工酶動態的研究
辛夏青,魏小紅,韓廳,岳凱,趙穎
(甘肅農業大學生命科學技術學院,甘肅 蘭州 730070)
紫花苜蓿(Medicagosativa)是一種多年生優質豆科草本植物,被譽為“牧草之王”,也是我國北方等地種植面積最大的人工牧草,其營養價值高、適口性好,是牛羊等牲畜的重要飼料[1]。在我國苜蓿產區水資源緊缺已成為苜蓿高產的主要限制性因素之一,西北地區種植的很多苜蓿品種抗旱能力普遍不高,在灌溉不足的條件下難獲高產[2]。逆境脅迫使植物細胞質中活性氧(ROS)分子包括過氧化氫(H2O2)、超氧陰離子(O2-·)和羥自由基(·OH)等大量累積,使植物受到次級氧化脅迫,最終作用到細胞核的組氨酸激酶受體蛋白(HKT)上,導致膜脂、蛋白質和核酸等氧化損傷,改變細胞代謝,造成對植物的傷害[3-4]。為了降低和消除氧化脅迫,植物細胞內出現了抗氧化防御系統,包括由POD、SOD及CAT等組成的抗氧化酶系統[5]。已有研究表明較低濃度的NO對植物細胞具有保護作用,而較高濃度卻表現為毒害效應[6-7]。研究發現0.1 mmol·L-1硝普鈉(SNP)能有效緩解鹽脅迫下紫花苜蓿的氧化損傷[8];外源NO能提高干旱脅迫下小麥(Triticumaestivum)幼苗葉片中SOD、POD 和CAT活性,降低超氧陰離子(O2-·)和過氧化氫(H2O2)水平,緩解膜脂過氧化,穩定生物膜的結構和功能[9]。同工酶是植物體內最活躍的酶之一,其合成和活性始終受到遺傳基因的控制和調節。不良環境可能會引起基因變異使酶組分及其活性發生改變,而導致同工酶酶譜變化,這種改變反映在同工酶的譜帶上,出現了不同數量及不同遷移率的譜帶[10]。酶活性和同工酶結構從生理和分子2個水平上反映了紫花苜蓿抗氧化酶系統對干旱脅迫的響應機制。
目前關于外源NO及反向調控PEG(聚乙二醇6000)脅迫下苜蓿萌發種子抗氧化酶及其同工酶動態的研究未見報道。因此本試驗用NO及其抑制劑c-PTIO[(2-(4-羧苯基)-4,4,5,5-四甲基咪唑啉-1-烴氧基-3-氧化鈉鹽)]處理PEG脅迫下紫花苜蓿種子,通過對抗氧化酶活性及同工酶組分的研究,探討NO在干旱逆境中紫花苜蓿的抗旱性,旨在為紫花苜蓿的耐旱生理研究機制提供一定的科學依據。
1 材料與方法
1.1 實驗材料與方法
供試材料為紫花苜蓿,品種為“三得利”,購買于甘肅省蘭州永豐種子公司。千粒重2.0223 g。本試驗于2016年11月至2017年6月在甘肅農業大學生命科學技術學院植物生理實驗室進行。
種子萌發處理:本試驗設6個處理,T1:CK(蒸餾水);T2:PEG(15% PEG);T3:SNP(0.1 mmol·L-1硝普鈉);T4:PEG+SNP(15% PEG+0.1 mmol·L-1SNP);T5:c-PTIO(200 μmol·L-1c-PTIO);T6:PEG+c-PTIO (15% PEG+200 μmol·L-1c-PTIO)。挑選大小一致、飽滿的紫花苜蓿種子用0.1%氯化汞溶液消毒5 min,蒸餾水沖洗5~6次。分別用蒸餾水、PEG、SNP、PEG+SNP、c-PTIO、PEG+c-PTIO浸泡苜蓿種子48 h,將種子置于墊有雙層濾紙的培養皿(φ=9 cm)中,每皿50粒種子,每個處理重復3次,每個培養皿加處理液4 mL,24 h更換一次處理液。培養在(25±1) ℃,12 h光照/12 h黑暗條件下,分別在處理后的2、4、6、8 d取樣,用于抗氧化酶及同工酶活性測定。
1.2 種子萌發中抗氧化酶活性的測定
酶液提取:稱取不同處理的樣品0.5 g,在冰浴條件下置于預冷過的研缽中,加入50 mmol·L-1pH 7.8的磷酸緩沖液(內含1%聚乙烯吡咯烷酮)5 mL研磨至勻漿,轉入10 mL離心管,在4 ℃、10000 r·min-1條件下離心15 min,上清液即為酶液[11]。
過氧化物酶(POD)活性采用愈創木酚氧化法測定[11];超氧化物歧化酶(SOD)活性采用NBT顯色法測定[12];過氧化氫酶(CAT)活性采用紫外吸收法測定[12]。
1.3 POD、SOD、CAT同工酶電泳
1.3.1酶液的制備 待種子處理第2、4、6、8天時分別稱取紫花苜蓿0.5 g,放入研缽中加入提前預冷的樣品提取液[含EDTA(乙二胺四乙酸)、PVP(聚乙烯吡咯烷酮)、pH 7.8磷酸緩沖液]5 mL,充分研磨,將研磨好的混合物進行低溫高速離心(15000 r·min-1)15 min,保留上清液即為所需酶液,-20 ℃冰箱貯藏備用。
1.3.2聚丙烯酰胺凝膠電泳 1)樣品處理。將酶液與樣品處理液(蔗糖5 g+蒸餾水14.5 mL+0.1%溴酚藍0.5 mL)1∶1混合,搖勻后靜置備用。
2)聚丙烯酰胺凝膠電泳。采用垂直不連續聚丙烯酰胺凝膠電泳,略做優化[13-14],用核黃素為聚合引發劑替代過硫酸銨,在光照條件下30 min,凝膠即聚合。POD和CAT同工酶分離膠質量分數為7.5%,SOD同工酶分離膠質量分數為10%,濃縮膠質量分數均為3.75%。POD、SOD、CAT的上樣量分別為15、20、35 μL,在4 ℃下進行電泳。濃縮膠時電壓為80 V,電流為30 mA, 分離膠時電壓為200 V,電流為45 mA,當溴酚藍指示劑移至前沿時,停止電泳。
3)POD、SOD、CAT同工酶染色。POD同工酶染色:采用改良聯苯胺法進行染色[14-15]。染色液:聯苯胺溶液(0.8 g聯苯胺,6 mL冰醋酸,加熱至60 ℃溶解后加入34 mL蒸餾水),4% NH4Cl溶液,5% EDTA-Na2溶液,0.3% H2O2溶液,蒸餾水,按1∶1∶1∶1∶8比例混合。將蒸餾水漂洗過的凝膠放入POD染色液中,震蕩5 min待酶帶顯出后,立即倒去染色液,用蒸餾水沖洗,7%醋酸中保存。
SOD同工酶染色:采用氮藍四唑(NBT)法[13]。電泳結束后取出膠片,將膠片浸泡于染色液2.45 mmol·L-1NBT中,黑暗下浸泡20 min,再放入0.036 mol·L-1(pH值7.8)磷酸緩沖液(含0.028 mol·L-1TMEDA,28 μmol·L-1核黃素),避光浸泡20 min,蒸餾水漂洗,放入0.05 mol·L-1PBS (pH值7.8含0.1 mmol·L-1EDTA),日光燈下光照10~15 min,直至出現透明譜帶,拍照。
CAT同工酶染色:參照胡能書等[13]的方法,用改良的FeCl3染色法。用重蒸水沖洗膠片1~2次,0.05% H2O2溶液浸泡10~15 min 后用重蒸水沖洗幾次,再加入染色液(含有1%的氯化鐵和1%的鐵氰化鉀),直到顯帶為止,照相。
1.4 數據分析
采用Excel 2007軟件處理數據和繪圖,SPSS 15.0軟件進行統計分析,Photoshop軟件剪輯電泳圖,凝膠成像系統計算遷移率(Rf)。
2 結果與分析
2.1 外源NO及反向調控PEG脅迫下紫花苜蓿種子萌發中POD活性及其同工酶動態的研究
如圖1所示,紫花苜蓿在萌發期POD活性呈逐漸上升趨勢,第4天時增長明顯,第6、8天增長趨于平緩。隨PEG脅迫時間的延長,PEG處理POD活性逐漸增高,而PEG+SNP處理較PEG處理POD活性先升高后降低,第6天時PEG+SNP處理較PEG處理POD活性降低了32.72%,差異顯著(P<0.05)。單獨添加NO清除劑c-PTIO在第4天時作用最明顯,c-PTIO比CK處理活性高了40.22%(P<0.05);而PEG脅迫下添加 c-PTIO在第8天時才抑制內源NO作用,PEG+c-PTIO處理較PEG相比POD活性提高了4.6%。圖2所示,紫花苜蓿POD同工酶譜帶在不同處理和處理時間上存在著明顯的差異,其活性大小在表達量上也體現出差異。POD同工酶酶譜中共檢測出11條酶帶,隨處理時間的延長POD酶帶增多,第2天時只誘導1條P4酶帶表達;第4天時酶帶增加為9條。隨處理時間延長酶帶表達加強,第6、8天酶帶顏色逐漸加深,表達量增多,活力明顯加強。在第8、14、20泳道為PEG處理,10、16、22為PEG+SNP處理,PEG+SNP比PEG處理條帶顏色淺。第6、8天分別有新酶帶P10和P11產生。POD同工酶活性變化與其抗氧化酶活性相對應。
2.2 外源NO及反向調控PEG脅迫下紫花苜蓿種子萌發中SOD活性及其同工酶動態的研究
由圖3可知,紫花苜蓿在萌發期SOD活性呈現逐漸增長變化趨勢,在第4天時SOD活性增長明顯,第6、8天時增長趨于平緩。第4天時PEG+SNP處理較15% PEG處理SOD活性升高了10.48%。NO抑制劑c-PTIO在第4天時抑制NO作用最顯著, c-PTIO處理較CK相比SOD活性下降了16.71%(P<0.05); PEG脅迫下添加c-PTIO較PEG相比,SOD活性下降了8.34%,但在整個處理中差異不顯著。由圖4可知,在整個處理過程中紫花苜蓿SOD同工酶譜帶呈現3條。遷移率為0.266的S3酶帶隨處理時間的延長顏色逐漸變淺直到消失。S1,S2酶帶無明顯變化,但顏色存在深淺差異,說明其酶活性表達量有差異。從電泳圖譜可以看出第8天酶帶表達量最弱,則表達量與處理時間呈負相關,隨著處理時間的延長,表達量越來越少。

圖1 外源NO及反向調控對PEG脅迫下紫花苜蓿萌發期POD活性變化的影響Fig.1 Effect of exogenous NO and reverse regulation on changes of POD activity in alfalfa during germination period under PEG stress 相同處理天數不同字母表示差異顯著(P<0.05),下同。The different letters in the same treatment time mean significant differences at P<0.05, the same below.
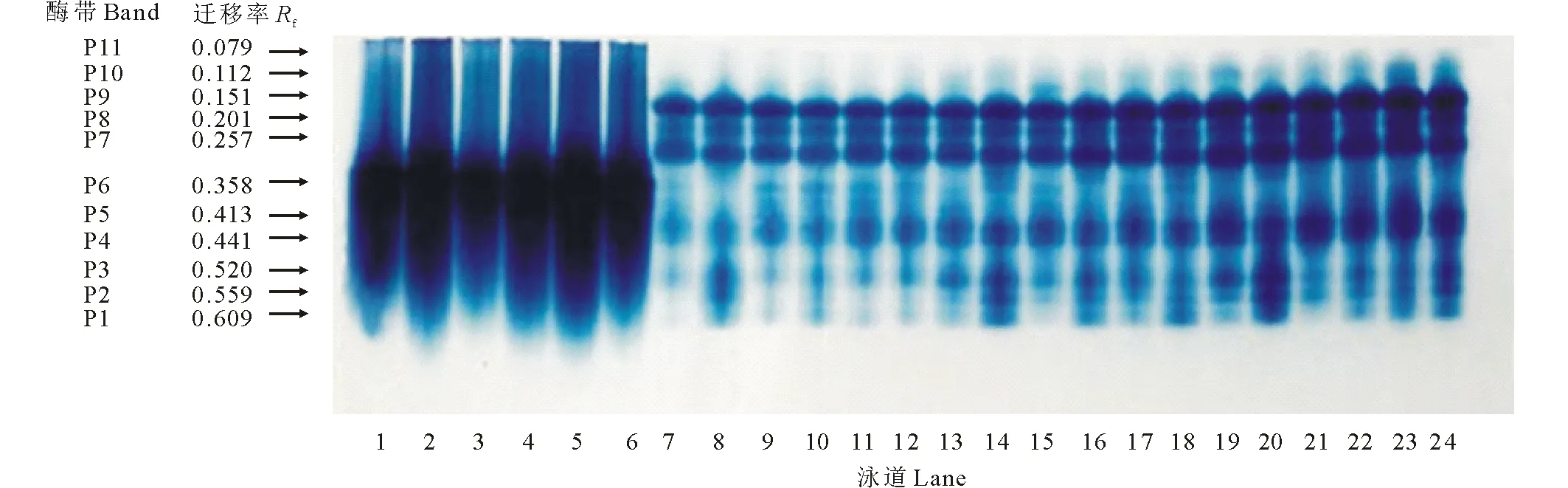
圖2 外源NO及反向調控PEG脅迫下紫花苜蓿種子萌發過程中POD同工酶的電泳圖譜Fig.2 Effects of exogenous NO and reverse regulation on the POD isoenzyme electrophoresis atlas of alfalfa germinating seeds under PEG stress 泳道1~6:處理2 d;泳道7~12:處理4 d;泳道13~18:處理6 d;泳道19~24:處理8 d。1、7、13、19為CK(蒸餾水)處理;2、8、14、20為15%PEG處理;3、9、15、21為SNP處理;4、10、16、22為PEG+SNP處理;5、11、17、23為c-PTIO處理;6、12、18、24為PEG+c-PTIO處理。按相對遷移率由大到小,酶帶排序為P1,P2,P3,P4,P5,P6,P7,P8,P9,P10,P11。Lane 1-6: Treatment 2 d; Lane 7-12: Treatment 4 d; Lane 13-18: Treatment 6 d; Lane 19-24: Treatment 8 d. 1, 7, 13, 19 for CK (distilled water) treatment; 2, 8, 14, 20 for 15% PEG treatment; 3, 9, 15, 21 for SNP treatment; 4, 10, 16, 22 for PEG+SNP treatment; 5, 11, 17, 23 for c-PTIO treatment; 6, 12, 18, 24 for PEG+c-PTIO treatment. According to the relative mobility from big to small, the enzyme bands were ranked as P1, P2, P3, P4, P5, P6, P7, P8, P9, P10, P11.
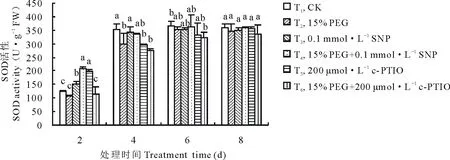
圖3 外源NO及反向調控對干旱脅迫下紫花苜蓿萌發期SOD活性變化的影響Fig.3 Effect of exogenous NO and reverse regulation on changes of SOD activity in alfalfa during germination period under PEG stress
2.3 外源NO及反向調控PEG脅迫下紫花苜蓿種子萌發中CAT活性及其同工酶動態的研究
從圖5可以看出,紫花苜蓿在萌發期CAT活性隨PEG脅迫時間的延長呈現先增高后降低的變化趨勢,各處理在第4天時CAT活性迅速上升并分別達到最大值,且各處理間差異最顯著。第4天時PEG+SNP處理較PEG處理CAT活性增加了23.60%(P<0.05)。單獨添加c-PTIO在第8天時抑制內源NO且較CK相比CAT活性降低了3.29%,但差異不顯著。第6天時,PEG+c-PTIO處理與PEG處理相比,CAT活性降低了23.19%(P<0.05)。圖6顯示,通過CAT同工酶活性染色得到了2條不同的CAT同工酶條帶,其相對遷移率分別為0.315和0.374。紫花苜蓿CAT同工酶在處理時間內不誘導新酶帶產生,從第2天到第8天始終保持2條酶帶,即C1和C2。各處理間酶帶表達量基本相同。
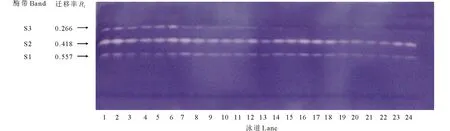
圖4 外源NO及反向調控PEG脅迫下紫花苜蓿種子萌發過程中SOD同工酶的電泳圖譜Fig.4 Effects of exogenous NO and reverse regulation on the SOD isoenzymeelectrophoresis atlas of alfalfa germinating seeds under PEG stress 泳道1~6:處理2 d;泳道7~12:處理4 d;泳道13~18:處理6 d;泳道19~24:處理8 d。1、7、13、19為CK(蒸餾水)處理;2、8、14、20為15%PEG處理;3、9、15、21為SNP處理;4、10、16、22為PEG+SNP處理;5、11、17、23為c-PTIO處理;6、12、18、24為PEG+c-PTIO處理。按相對遷移率由大到小,酶帶排序為S1,S2,S3。Lane 1-6: Treatment 2 d; Lane 7-12: Treatment 4 d; Lane 13-18: Treatment 6 d; Lane 19-24: Treatment 8 d. 1, 7, 13, 19 for CK (distilled water) treatment; 2, 8, 14, 20 for 15% PEG treatment; 3, 9, 15, 21 for SNP treatment; 4, 10, 16, 22 for PEG+SNP treatment; 5, 11, 17, 23 for c-PTIO treatment; 6, 12, 18, 24 for PEG+c-PTIO treatment. According to the relative mobility from big to small, the enzyme bands were ranked as S1, S2, S3.
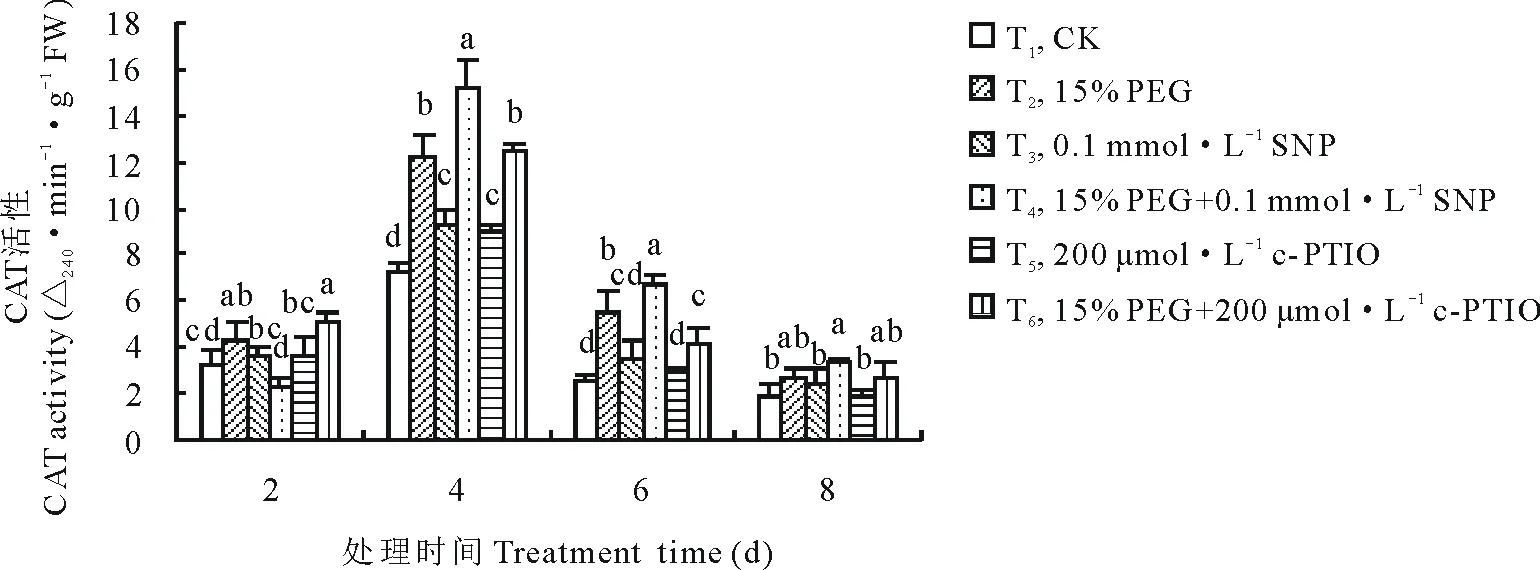
圖5 外源NO及反向調控對PEG脅迫下紫花苜蓿萌發期CAT活性變化的影響Fig.5 Effect of exogenous NO and reverse regulation on changes of CAT activity in alfalfa during germination period under PEG stress

圖6 外源NO對PEG脅迫下紫花苜蓿萌發過程中CAT同工酶電泳圖譜Fig.6 Effects of exogenous NO and reverse regulation on the CAT isoenzyme electrophoresis atlas of alfalfa germinating seeds under PEG stress 泳道1~6:處理2 d;泳道7~12:處理4 d;泳道13~18:處理6 d;泳道19~24:處理8 d。1、7、13、19為CK(蒸餾水)處理;2、8、14、20為15%PEG處理;3、9、15、21為SNP處理;4、10、16、22為PEG+SNP處理;5、11、17、23為c-PTIO處理;6、12、18、24為PEG+c-PTIO處理。按相對遷移率由大到小,酶帶排序為C1,C2。Lane 1-6: Treatment 2 d; Lane 7-12: Treatment 4 d; Lane 13-18: Treatment 6 d; Lane 19-24: Treatment 8 d. 1, 7, 13, 19 for CK (distilled water) treatment; 2, 8, 14, 20 for 15% PEG treatment; 3, 9, 15, 21 for SNP treatment; 4, 10, 16, 22 for PEG+SNP treatment; 5, 11, 17, 23 for c-PTIO treatment; 6, 12, 18, 24 for PEG+c-PTIO treatment. According to the relative mobility from big to small, the enzyme bands were ranked as C1, C2.
3 討論
3.1 外源NO及反向調控對PEG脅迫下紫花苜蓿萌發中種子抗氧化酶活性的影響
種子萌發期是植物生活史中的重要階段,也是進行植物抗旱性研究的重要時期[16]。NO作為一種信號分子和活性氧清除劑,能調節植物對生物和非生物脅迫的適應及反應[17]。植物的保護酶體系在緩解脅迫方面起著重要作用,它可以清除體內的活性氧,以避免過量活性氧對植物的傷害[18]。一般來講,干旱脅迫下植物體內POD等酶的活性與植物抗氧化脅迫能力呈正相關。姜義寶等[19]研究發現,NO能明顯緩解干旱脅迫造成的氧化損傷,提高了苜蓿葉片葉綠素含量和光合能力,增強了苜蓿的抗旱性。本試驗結果表明,外施SNP可提高抗氧化酶POD、SOD、CAT活性和緩解PEG脅迫下紫花苜蓿的氧化損傷。在干旱條件下外源添加0.1 mmol·L-1SNP時,紫花苜蓿的POD活性降低,第6天時最顯著;而SOD、CAT活性都表現為增加,在第4天時,SOD和CAT活性增加較顯著。NOS(nitric oxide synthase)和NR(nitrate reductase)是植物體內源NO的最主要來源,但仍存在爭議[20]。為明確苜蓿根系內源NO的來源和其對苜蓿根系耐旱性的影響,本試驗用NO 特異清除劑c-PTIO處理紫花苜蓿種子。結果表明,在PEG脅迫下添加NO特異清除劑較PEG處理相比,可提高POD活性,降低了SOD及CAT活性,說明c-PTIO可抑制紫花苜蓿種子萌發的內源NO。表明依賴于NOS活性或NR活性產生的內源NO也參與干旱脅迫下苜蓿萌發耐旱性的調節。
3.2 外源NO及反向調控對PEG脅迫下紫花苜蓿萌發中種子抗氧化酶同工酶活性的影響
同工酶是具有催化相同的化學反應,但其理化性質、蛋白質分子結構等有明顯差異的一組酶。植物隨自身生長和外界環境的改變,同工酶譜帶會發生相應的變化。逆境脅迫可導致抗氧化同工酶的改變[21],本試驗結果表明,PEG脅迫下紫花苜蓿種子萌發期的POD同工酶表達在譜帶數及表達量上都發生了明顯的變化,具體表現為處理第4天時酶帶明顯增多至9條,第6、8天仍有新酶帶產生,且隨著處理時間的延長POD酶帶表達量逐漸增多。PEG處理較PEG+SNP處理同工酶表達量多,這說明植物受到脅迫后酶組分及其活性發生改變以適應不良環境,但由于防御措施的加強,最終導致POD酶帶數及其表達量相應增加[22]。SOD在控制脂質過氧化和防止膜系統受傷等方面有一定的保護作用,與植物的抗旱性有關[23]。PEG脅迫下不影響SOD同工酶帶數但影響其活性,隨著處理時間的延長,SOD同工酶S3表達量逐漸減弱,直到第8天時幾乎消失,這與莫饒等[24]的研究一致。栗淑媛等[25]的研究發現,CAT等抗氧化酶的同工酶表達與植物的脅迫適應和進化水平有密切的關系。不同的同工酶基因對不同程度逆境脅迫的表達響應不同[26]。與酶活性變化對應,紫花苜蓿CAT同工酶在PEG脅迫下表達量微弱,可能是由于干旱脅迫對紫花苜蓿萌發期CAT同工酶表達嚴重脅迫,無法通過CAT同工酶表達量增加來抵御,這與魯振強[27]的研究相一致。

