酸、鋁和鹽脅迫對夏季豆科綠肥作物種子萌發及根瘤菌抗氧化酶活性的影響
王登科,于翔宇,張學風,黃蕾,李曉婷,賀治斌,康林,王黨軍,姚露花,郭彥軍
(西南大學農學與生物科技學院,重慶 400716)
豆科綠肥作物是一種養分全面的優質生物肥源,也是我國農作物種植制度中重要的輪作倒茬作物,在提供作物養分、改善農田生態環境和防止土壤侵蝕及污染等方面起到積極的作用[1]。如,作物休閑期種植綠肥有利于改善土壤質量、提高后茬作物產量[2-3];種植綠肥后,后茬玉米(Zeamays)氮素利用效率有所提高[4],并可降低后茬小麥(Triticumaestivum)氮肥施用量[5]。然而,對于豆科綠肥作物而言,全球氣候變化及人類不合理的土地利用方式所引起的土壤質量退化,包括鹽堿化、酸化等[6],嚴重限制了豆科作物的生長及其根瘤的生物固氮能力,影響其在生產中的推廣種植[7-8]。
鹽堿脅迫可引起植物生理干旱,使植物根系及種子發芽時不能從土壤中吸收足夠的水分[9];減少植物對鉀、磷和其他營養元素的吸收[10];影響植物的氣孔關閉,植物容易干旱枯萎[11]。隨著土壤pH值的降低,礦物結構和有機絡合態錳、鋁等易被活化,活性鋁的溶出量增加[12],抑制植物根系生長[13],影響營養元素的吸收[14]。豆科與根瘤菌形成的共生系統對逆境脅迫尤為敏感。根瘤菌適宜的pH值為6.5~7.5[15],過低的土壤pH值影響根瘤菌存活,抑制宿主與根瘤菌的親和力,降低生物固氮能力[16]。如鋁脅迫下,根瘤菌的細胞結構、細胞分裂、酶系統等受到毒害影響,對結瘤和固氮產生抑制作用[17-18]。在鹽脅迫下,高滲透環境抑制細胞分裂、降低根瘤菌密度及細胞高精脒含量,使固氮能力顯著下降[19-20]。在逆境脅迫下,根瘤菌自身會形成一些抗性機制,如細胞外排、胞外沉淀、主動輸出、酶類解毒及降低細胞對鋁、酸和鹽敏感性等[21-22]。隨著pH水平的下降,天藍苜蓿(Medicagolupulina)根瘤菌抗氧化酶活性顯著高于紫花苜蓿(Medicagosativa)根瘤菌,表現出較強的耐酸、耐鋁性[23]。說明豆科植物根瘤菌對酸、鋁、鹽等脅迫存在明顯的基因型差異[24-25],可針對不同的土壤環境選擇適宜的豆科作物進行種植。
竹豆(Phaseoluscalcaratns)、田菁(Sesbaniacannabina)、綠豆(Vignaradiata)、豇豆(Vignaunguiculata)等為夏季主要的豆科填閑植物。有關這些植物逆境脅迫方面的研究多集中在植物養分吸收上[26],鮮有研究比較它們根瘤菌的抗氧化酶活性差異。鑒于此,本研究通過設置不同水平pH、活性鋁含量和氯化鈉含量,研究了不同根瘤菌的抗氧化酶活性,包括SOD(超氧化物歧化酶)、POD(過氧化物酶)、CAT(過氧化氫酶)及GR(谷胱甘肽還原酶)。同時,考慮到早期種子萌發階段對逆境脅迫較為敏感,分析了上述逆境脅迫下豆科綠肥作物種子的萌發特性。旨在通過選擇適宜的豆科綠肥作物品種,為改良和利用鹽漬地和酸性土壤提供理論依據與實際指導。
1 材料與方法
1.1 植物材料
本試驗選擇的豆科綠肥作物品種有4個,包括竹豆、綠豆、普通田菁和豇豆。其中竹豆2015年購自江西進賢芽苗菜公司;田菁為普通田菁,2015年購自鄭州世紀天緣公司;綠豆為冀綠7號,豇豆為重慶二巴豇,均為2015年購自重慶市北碚區種子公司。
1.2 種子萌發實驗
種子萌發實驗于2017年6-7月在西南大學農學與生物科技學院飼料作物研究所進行。實驗設4個NaCl脅迫水平,即0、40、120和200 mmol·L-1;4個活性鋁(Al3+)水平,即0、50、100和200 mg·L-1,利用Al2SO4·18H2O配制;4個pH水平,即4、5、6和7。選取大小均勻、無蟲眼的竹豆、綠豆、田菁和豇豆種子,消毒后(3%H2O2溶液消毒3 min),用清水清洗3次,然后采用紙上發芽法,按每個培養皿30粒種子分別放在加入5 mL各個處理溶液的濾紙(直徑12 cm的培養皿雙層濾紙)床中進行發芽,清水做對照,每個處理設3個重復。在(24±2) ℃恒溫培養箱中進行發芽,光照變幅12 h/12 h。每日用約5 mL處理液淋洗種子,防止種子發霉,并保持培養皿有一定的處理溶液。從每個品種開始發芽的第1天,每隔24 h觀察并記錄種子的發芽數,直至無萌發種子出現為止[27],共記錄7次。
1.3 供試根瘤菌菌株的分離、純化
于2015年8月在重慶市合川區西南大學試驗田采集竹豆、綠豆、田菁和豇豆4種綠肥作物的根瘤,分離純化竹豆根瘤菌、綠豆根瘤菌、田菁根瘤菌和豇豆根瘤菌。西南大學合川試驗基地,年平均氣溫18.4 ℃,年日照時數1342.6 h,年降水量1552.7 mm,年相對濕度84%,平均風速0.7 m·s-1,土壤呈弱酸性(pH值6.5)。
1.3.1菌株純化 分別對采集的根瘤經95%的酒精殺菌處理10 s后,再用3% H2O2消毒3~5 min,用無菌水沖洗3~5次后,加1滴無菌水,把根瘤菌搗碎,用接種環挑取一環根瘤的汁液接種到醇母甘露醇培養基(YMA)上,劃線分離,在28 ℃黑暗條件下培養,待菌落長成,選取單菌落,劃線分離培養,連續2次,得到純的根瘤菌菌株。
純化培養采用YMA固體培養基(甘露醇10 g·L-1,酵母提取物1 g·L-1,蒸餾水800 mL·L-1,土壤提取液200 mL·L-1,瓊脂30 g·L-1)。
1.3.2擴大培養 將純化后的菌種用5 mL無菌水洗脫于裝有液體培養基(YMB)的錐形瓶(150 mL)中,至于搖床(150 r·min-1)恒溫(28 ℃)培養至指數期,備用。
YMB液體培養基:甘露醇10 g·L-1、酵母提取物1 g·L-1、蒸餾水800 mL·L-1和土壤提取液200 mL·L-1,用 0.1 mol·L-1NaOH或HCl調pH值至6.8。
1.4 根瘤菌脅迫處理
于2017年1月開展根瘤菌脅迫處理。實驗設5個NaCl脅迫水平,即0、10、20、30和40 g·L-1;5個活性鋁(Al3+)水平,即0、25、50、75和100 μmol·L-1;4個pH水平,即4、5、6和7。通過在培養基(YMB)中加入分析純NaCl試劑調節NaCl水平;加入分析純AlCl3調節活性鋁含量。通過在培養基(YMB)加入HCl調節pH水平。
各綠肥作物根瘤菌菌種于超凈工作臺接種至裝有處理溶液的液體培養基中,于35 ℃、150 r·min-1的條件下搖床培養。24 h后每日測定溶液OD值(600 nm,吸光值),于對數生長期停止培養,置于4 ℃冰箱備用。以不接種為對照,各處理重復3次。
1.5 根瘤菌抗氧化酶活性測定
1.5.1細胞破碎和粗酶液提取 各處理菌液于4 ℃、8000 r·min-1離心5 min,收集菌體。將收集的菌體用磷酸緩沖液(0.05 mmol·L-1, pH 7.8,4 ℃預冷)混勻洗滌3次,置于無菌濾紙上,洗去表面余液。然后置于10 mL離心管中,記錄菌體質量,加4 mL磷酸鹽提取液[0.05 mmol·L-1, pH 7.8,含1% 聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP),4 ℃]混勻,置于冰上超聲波破壁,離心15 min(4 ℃,1500 r·min-1),上清液為抗氧化酶粗提液,保存于-20 ℃冰箱以備用。
1.5.2抗氧化性酶活性測定 超氧化物歧化酶(superoxide dsmutase,SOD)活性的測定采用氮藍四唑(nitro-blue tetrazolium, NBT)光化還原法[28],將NBT光化還原反應抑制到50%為一個酶活性單位(U)。過氧化氫酶(catalase,CAT)活性采用紫外吸收法測定[29],以每分鐘減少0.1個OD值所需的酶量為1個酶活力單位(U)。過氧化物酶(peroxidase,POD)活性的測定采用愈創木酚法[30],在H2O2存在下POD催化愈創木酚生成棕色聚合物,在470 nm有特征吸收峰,以每分鐘內A470變化為1個過氧化物酶活性單位(U)。谷胱甘肽還原酶(glutathione reductase,GR)的活性采用還原型輔酶Ⅱ(triphosphopyridine nucleotide,NADPH)法[31-32],以每分鐘每毫克蛋白氧化1 nmol NADPH為一個活性單位(U)。
1.6 數據處理
采用二因素方差分析法分析品種與不同處理(酸、活性鋁、鹽脅迫)對種子萌發、根瘤菌抗氧化酶(SOD、CAT、POD、GR)活性的影響,顯著水平為P<0.05(l.s.d)。數據為3個重復的平均值±標準誤。
2 結果與分析
2.1 酸、鋁、鹽脅迫及品種影響發芽率及根瘤菌抗氧化酶活性的方差分析
酸、鋁、鹽脅迫顯著影響幾種豆科綠肥作物的種子發芽率及其根瘤菌的抗氧化酶活性,其中根瘤菌抗氧化酶活性較綠肥種子發芽率對脅迫更敏感(表1)。整體上,隨活性鋁濃度和NaCl濃度的增加及pH水平的下降,綠肥作物根瘤菌各抗氧化酶活性呈下降趨勢。在脅迫條件下,不同綠肥作物的發芽率及其根瘤菌抗氧化酶活性也存在顯著品種差異,且整體表現出品種與脅迫的交互作用。
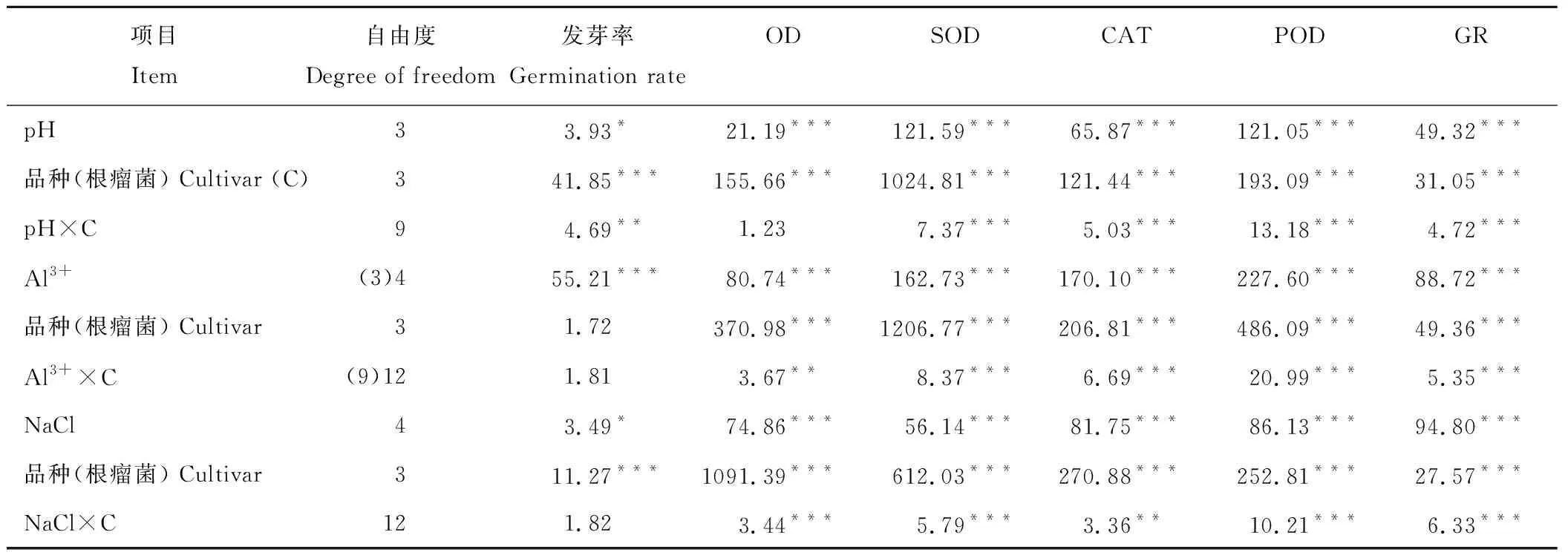
表1 酸、鋁、鹽脅迫及品種影響豆科綠肥作物發芽率及根瘤菌抗氧化酶活性的方差分析(F值)Table 1 Analysis of the effects of acid, aluminum, salt stress and cultivars on the germination rate and the activities of the rhizobia antioxidant enzymes in legume green manures (F value)
*,P<0.05; **,P<0.01; ***,P<0.001.
2.2 竹豆、綠豆、田菁和豇豆種子發芽率
豆科綠肥作物種子發芽率對環境pH水平、活性鋁濃度及鹽濃度的敏感性不同,且存在顯著的品種差異(表2)。在4個pH水平下,田菁種子在pH值為4時不發芽,pH值為5時發芽率只有36.67%,而pH值為6和pH值為7時保持在60%左右;其余品種發芽率對4個pH水平無顯著響應。在4個不同活性鋁濃度下,所有品種均表現為發芽率隨濃度增加而顯著下降的趨勢,且Al3+含量為0 mg·L-1時發芽率最高,至100 mg·L-1時發芽率分別下降82%(綠豆)、76%(竹豆)、65%(田菁)和54%(豇豆),至200 mg·L-1時,所有品種均無發芽。各品種發芽率對鹽濃度的反應不一致,其中竹豆和綠豆在NaCl 達到40 mmol·L-1時最高,顯著高于120和200 mmol·L-1時;田菁在120 mmol·L-1時達到最大值,顯著高于其他鹽濃度時的發芽率;而豇豆在各鹽濃度下均無顯著差異。
2.3 酸脅迫對根瘤菌生長及抗氧化酶活性的影響
豆科綠肥作物根瘤菌的生長及抗氧化酶活性對環境pH水平的變化較為敏感(表3)。隨著pH水平的提高,各根瘤菌菌液的OD值呈增加趨勢。竹豆和豇豆根瘤菌pH值為6和pH值為7時的OD顯著高于pH值為4和pH值為5時;田菁根瘤菌pH值為7時的OD值顯著高于pH值為5和pH值為6時,而pH值為4時的OD值最低;綠豆根瘤菌OD值處理間差異不顯著。不同品種根瘤菌間比較,pH值為4時的OD值,豇豆根瘤菌為1.67,顯著高于竹豆根瘤菌(1.35);而綠豆根瘤菌和田菁根瘤菌均低于1.2。
各根瘤菌抗氧化酶活性,整體隨pH水平的增加呈增加趨勢,且pH值為7時的SOD、CAT、POD及GR酶活性顯著高于pH值為4時的(表3)。根瘤菌SOD酶活性對pH最敏感的是田菁根瘤菌,其pH值為5、6和7時的SOD酶活性較pH值為4時分別增加122%、266%和625%;竹豆和綠豆根瘤菌SOD酶活性較pH值為4時提高32%~116%;而豇豆根瘤菌SOD酶活性較pH值為4提高不足50%。CAT酶活性對pH最敏感的是綠豆根瘤菌,其pH值為5、6和7時的CAT酶活性較pH值為4時分別增加96%、216%和315%;竹豆、田菁和豇豆根瘤菌pH值為7時的CAT酶活性較pH值為4分別提高185%、224%和167%。POD酶活性對pH最敏感的是竹豆根瘤菌, 其pH值為5、6和7時的POD酶活性較對照分別增加113%、229%和248%;綠豆、田菁和豇豆根瘤菌pH值為7時的POD酶活性較pH值為4分別提高114%、83%和153%。GR酶活性對pH最敏感的是豇豆根瘤菌,其pH值為5、6和7時的GR酶活性較pH值為4時分別增加185%、270%和390%;竹豆、綠豆和田菁根瘤菌pH值為7時的GR酶活性較pH值為4分別提高225%、181%和193%。
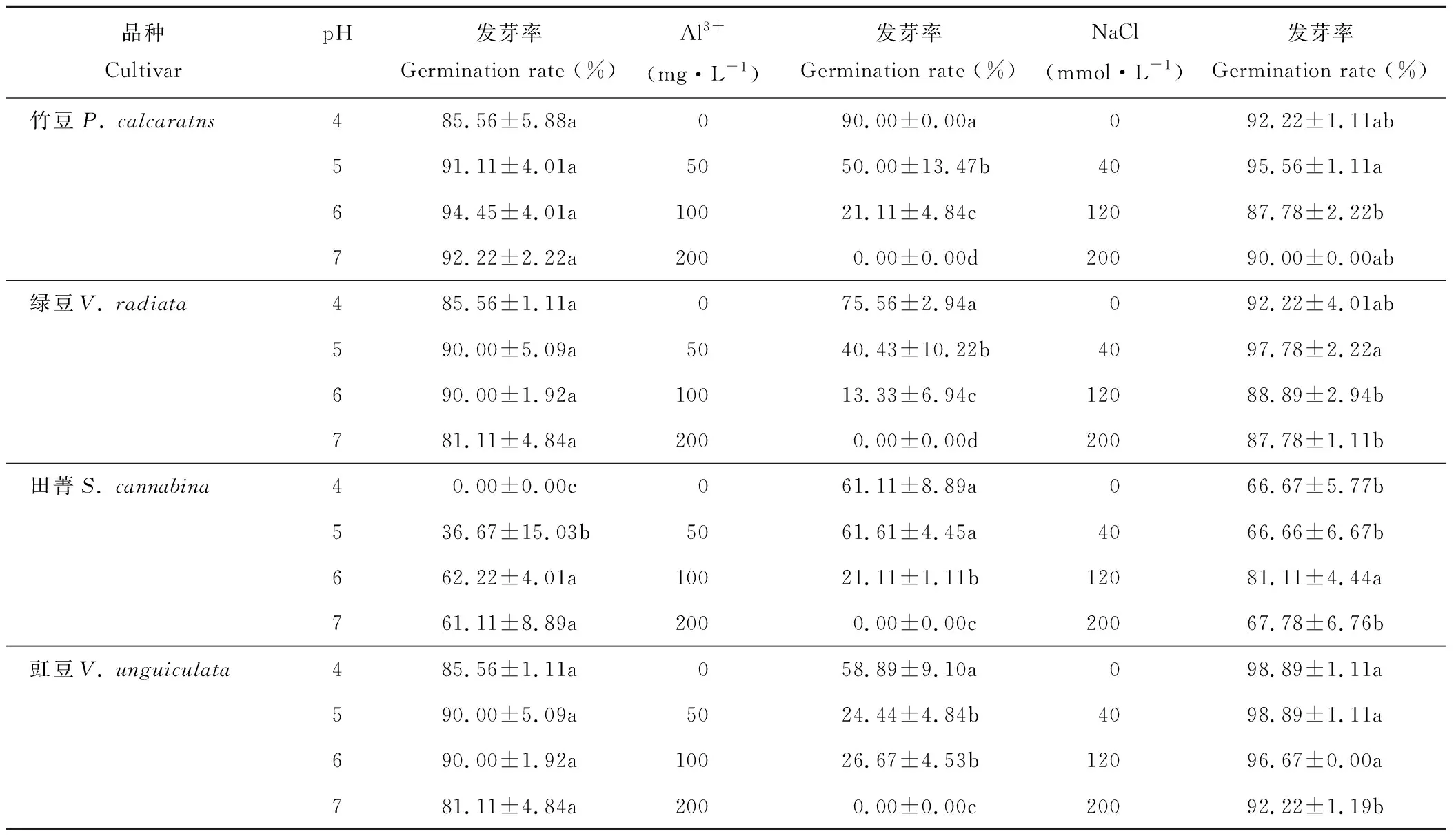
表2 鹽、鋁和酸脅迫對竹豆、綠豆、田菁和豇豆種子萌發的影響Table 2 Effects of salt, aluminum and acid stresses on seed germination of P. calcaratns, V.radiata, S. cannabina and V. unguiculata
注:同品種不同處理數值后小寫字母不同表示顯著(P<0.05)。下同。
Note: Different lower case letters after the value for same cultivar represented significance difference atP<0.05 (l.s.d). The same below.
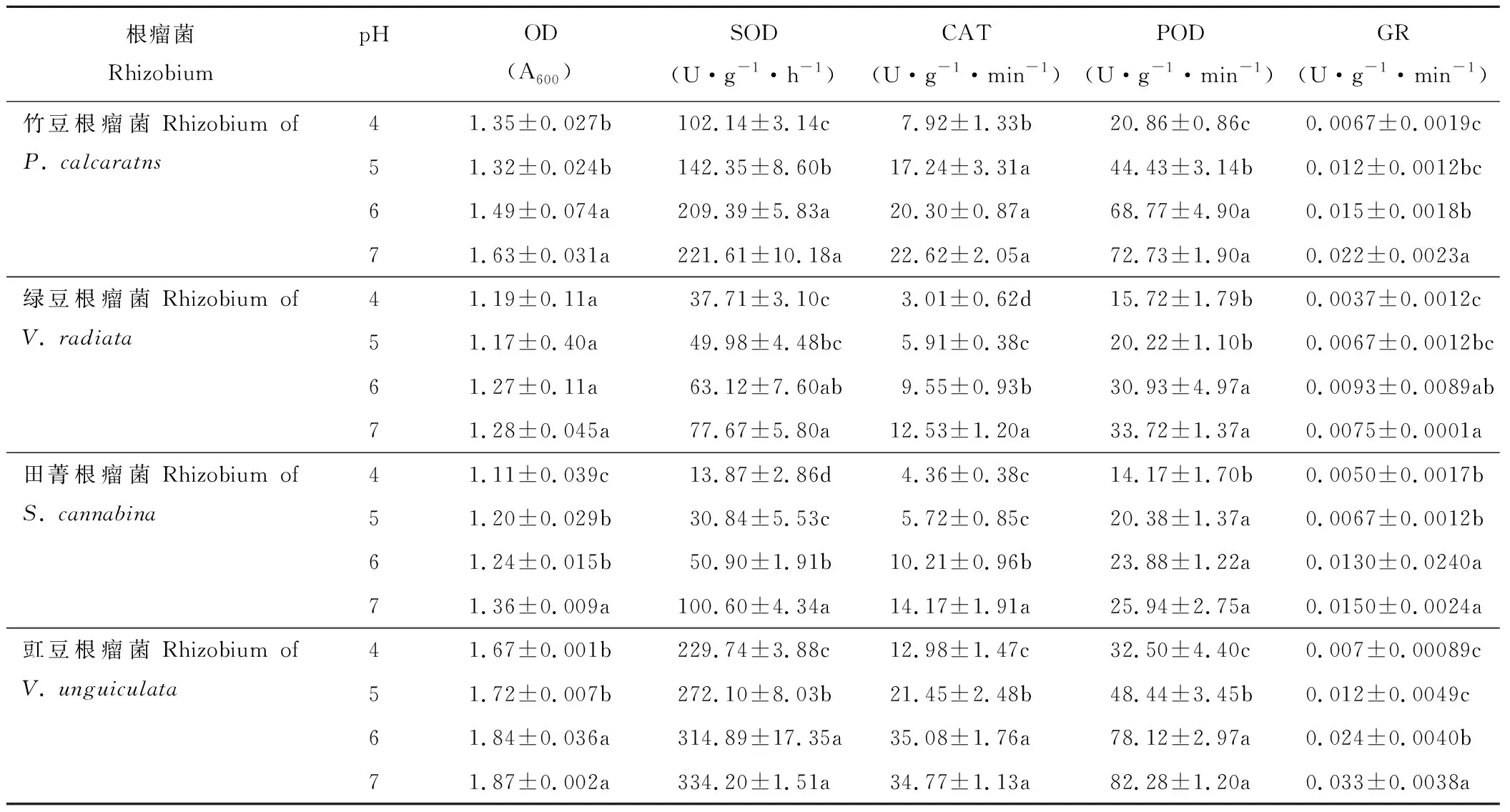
表3 酸脅迫對竹豆、綠豆、田菁和豇豆根瘤菌生長及抗氧化酶活性的影響Table 3 Effects of acid stress on the growth and antioxidant enzymes activities of rhizobia of P. calcaratns, V. radiata, S. cannabina and V. unguiculata
2.4 鋁脅迫對根瘤菌生長及抗氧化酶活性的影響
鋁脅迫顯著影響豆科綠肥作物根瘤菌的生長及抗氧化酶活性(表4)。整體上,隨著活性鋁濃度的增加,各根瘤菌菌液OD值呈下降趨勢。活性鋁濃度低于50 μmol·L-1時,各豆科根瘤菌OD值較對照無顯著變化;當活性鋁濃度增加至75和100 μmol·L-1時,OD值較對照顯著下降。品種根瘤菌間比較,100 μmol·L-1時的OD值,豇豆根瘤菌為1.65,顯著高于竹豆根瘤菌(1.26);而綠豆和田菁根瘤菌分別為1.08和0.84。
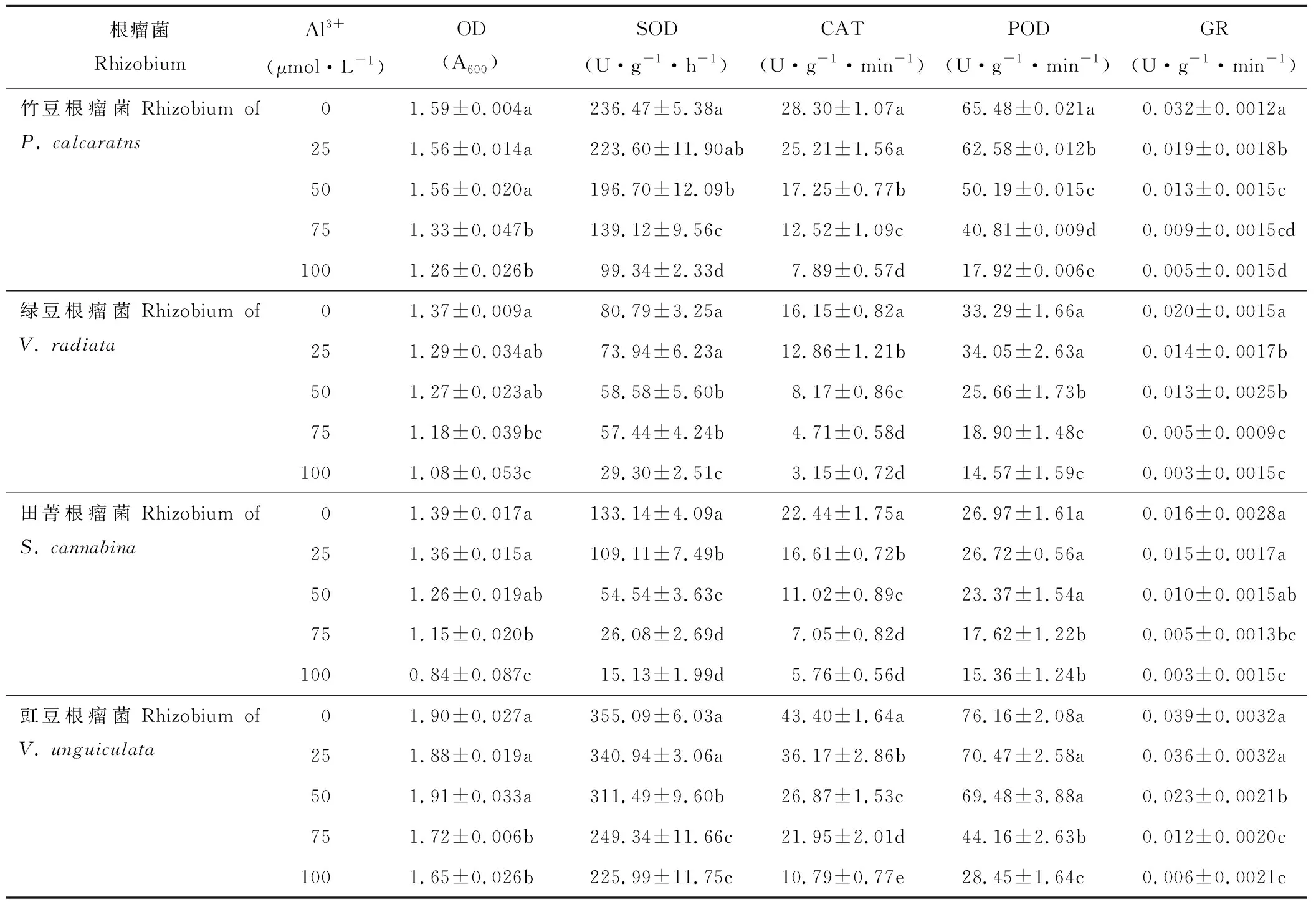
表4 鋁脅迫對竹豆、綠豆、田菁和豇豆根瘤菌生長及抗氧化酶活性的影響Table 4 Effects of aluminum stress on the growth and antioxidant enzymes activities of rhizobia of P. calcaratns, V. radiata, S. cannabina and V. unguiculata
各根瘤菌抗氧化酶活性隨活性鋁濃度的增加呈下降趨勢。根瘤菌SOD酶活性對活性鋁最敏感的是田菁根瘤菌,其0、25、50和75 μmol·L-1時的SOD酶活性較100 μmol·L-1分別增加779%、621%、260%和72%;竹豆和綠豆根瘤菌SOD酶活性較100 μmol·L-1增加40%~175%;而豇豆根瘤菌SOD酶活性較100 μmol·L-1升幅不足60%。CAT酶活性對活性鋁最敏感的是綠豆根瘤菌,其0、25、50和75 μmol·L-1Al3+時的CAT酶活性較100 μmol·L-1時分別增加412%、307%、159%和49%;竹豆、田菁和豇豆根瘤菌0 μmol·L-1時的CAT酶活性較100 μmol·L-1分別提高258%、289%和302%。POD酶活性對活性鋁最敏感的是竹豆根瘤菌,其0、25、50和75 μmol·L-1時的POD酶活性較對照分別增加265%、249%、180%和127%;綠豆、田菁和豇豆根瘤菌0 μmol·L-1時的POD酶活性較100 μmol·L-1分別提高128%、75%和167%。各菌液GR酶活性100 μmol·L-1時較0 μmol·L-1下降422%~555%,品種根瘤菌間GR酶活性差異較其他酶活性小。
2.5 鹽脅迫對根瘤菌生長及抗氧化酶活性的影響
隨著NaCl濃度的增加,各根瘤菌菌液OD值呈下降趨勢,且存在品種差異(表5)。當NaCl濃度由0 g·L-1增加至10 g·L-1時,綠豆根瘤菌OD值顯著下降,而其他品種無顯著變化;當濃度繼續增加至20 g·L-1時,除竹豆根瘤菌外,其余根瘤菌OD均顯著下降;當濃度達到40 g·L-1時,竹豆、綠豆、田菁和豇豆根瘤菌OD值較對照顯著下降分別為11%、14%、12%和9%。
各根瘤菌抗氧化酶活性隨NaCl濃度的增加也整體呈下降趨勢(表5)。當NaCl濃度由0 g·L-1增加至20 g·L-1時,竹豆和綠豆根瘤菌SOD酶活性無顯著變化;田菁和豇豆根瘤菌SOD酶活性顯著下降;當濃度達到40 g·L-1時,竹豆、綠豆、田菁和豇豆根瘤菌SOD酶活性較對照顯著下降53%、38%、45%和33%。田菁和綠豆根瘤菌CAT酶活性對較低濃度NaCl(20 g·L-1)無顯著響應,而竹豆和綠豆根瘤菌顯著下降;當NaCl 濃度達到40 g·L-1時,竹豆、綠豆、田菁和豇豆根瘤菌CAT酶活性較對照下降45%左右。竹豆和綠豆根瘤菌POD酶活性對低濃度NaCl(20 g·L-1)無顯著響應,而田菁和豇豆根瘤菌顯著下降;當NaCl 濃度達到40 g·L-1時,竹豆、綠豆、田菁和豇豆根瘤菌POD酶活性較對照下降62%、36%、52%和58%。綠豆和田菁根瘤菌GR酶活性對較低濃度NaCl(20 g·L-1)無顯著響應,而竹豆和豇豆根瘤菌較對照顯著下降;當NaCl濃度達到40 g·L-1時,竹豆、綠豆、田菁和豇豆根瘤菌GR活性較對照分別顯著下降84%、73%、67%和87%。
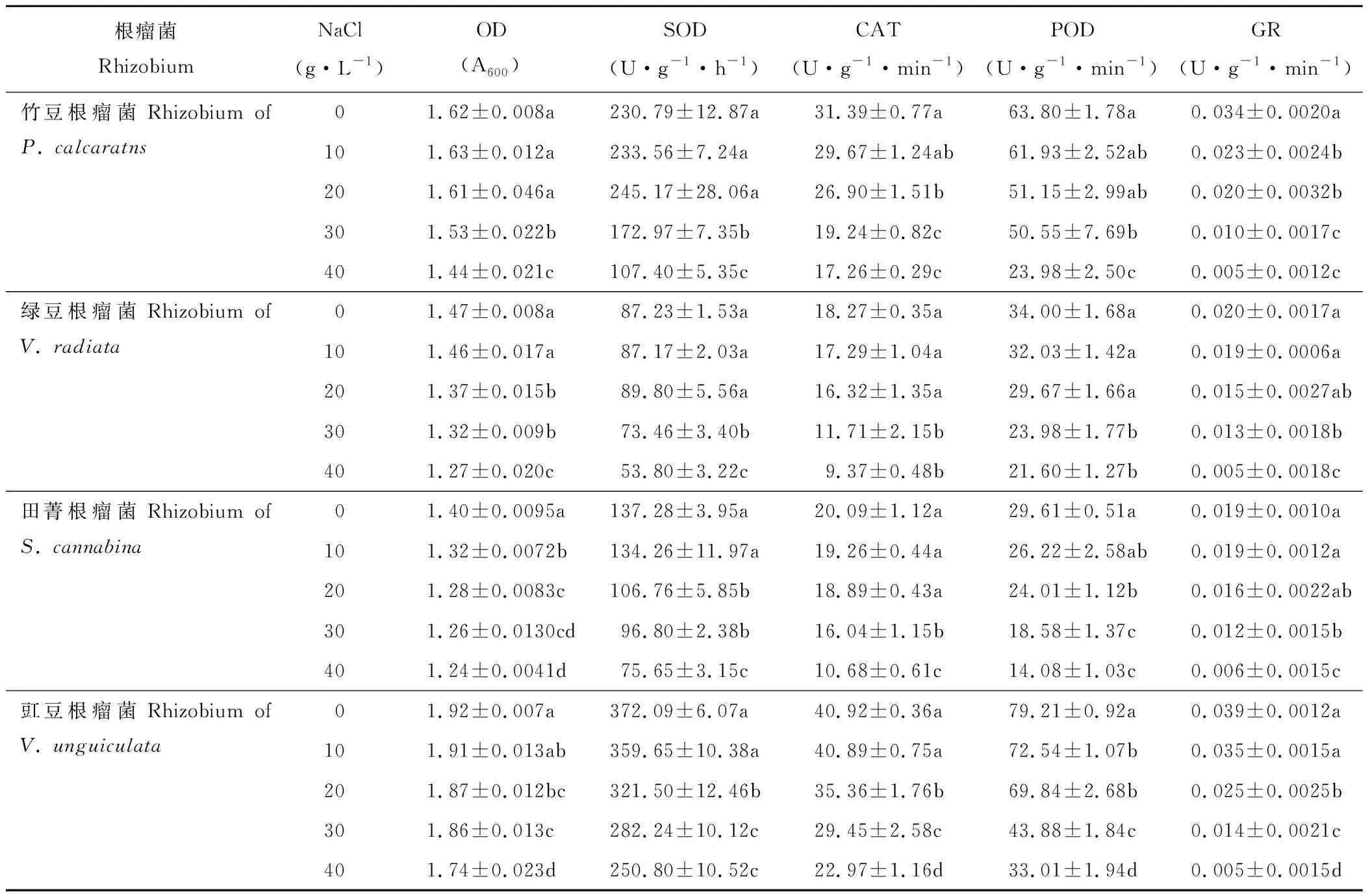
表5 鹽脅迫對竹豆、綠豆、田菁和豇豆根瘤菌生長及抗氧化酶活性的影響Table 5 Effects of salt stress on the growth and antioxidant enzymes activities of rhizobia of P. calcaratns, V. radiata, S. cannabina and V. unguiculata
3 討論
在逆境土壤,種子的成功萌發與根瘤的形成是確保豆科作物正常生長的關鍵[33]。本試驗中,土壤鹽堿化、酸化和活性鋁含量增加均顯著抑制豆科作物種子萌發及根瘤菌抗氧化酶活性,說明這些土壤環境不利于豆科作物種子的萌發和共生固氮體系的建立,制約著豆科作物在生產中的推廣種植。然而,豆科作物品種對逆境脅迫的響應存在品種差異[34]。如田菁種子發芽率對pH較敏感,pH值為4時不發芽,pH值為5時發芽率只有36.67%,顯著低于弱酸性至中性環境;而竹豆、綠豆和豇豆種子對pH變化無顯著響應。因此,在酸性土壤選擇豆科綠肥作物時可不考慮田菁。活性鋁含量增加是酸性土壤引起植物生長不良主要原因之一[35]。本試驗中,當活性鋁濃度達到100 mg·L-1時,所有品種發芽率降幅均超過50%,其中綠豆降幅高達82%,表現最為敏感;至200 mg·L-1時,所有品種均無發芽。因此,在活性鋁含量較高的酸性土壤,種植豆科作物之前需要通過調節土壤酸堿性[36],降低活性鋁含量[37],以提高豆科作物的種子萌發。如施用石灰被廣泛用于改良酸性土壤,提高作物生產[38]。幾種豆科綠肥作物的發芽率對鹽濃度的反應不一致,且一定的NaCl濃度有利于種子萌發。如竹豆和綠豆的發芽率在NaCl 達到40 mmol·L-1時最高,田菁在120 mmol·L-1時達到最大值,而豇豆在不同NaCl濃度下無顯著差異。品種間存在的耐鹽性差異可能與不同作物對鹽分離子的吸收和累計具有不同的特點有關[39],其中豇豆和田菁萌發期可能通過吸收較多鈉離子提高細胞束縛水的能力,以抵御鹽害。
相對于種子萌發,豆科綠肥作物根瘤菌對酸、活性鋁及鹽的敏感性較高。整體上,隨著pH水平的下降、活性鋁濃度增加和鹽濃度的增加,根瘤菌的生長及抗氧化酶活性均受到不同程度的抑制。一方面,不利的土壤環境條件可通過影響根瘤菌的繁殖,降低其與宿主植物之間的親和性[40]。另一方面,根瘤菌抗氧化酶參與其對逆境的適應性調節過程[41],以保證其在逆境中的存活。如SOD能消除根瘤菌在新陳代謝過程中產生的有害物質[42],POD(CAT)能水解去除H2O2、氫化有毒化合物等[43],而GR能保護細胞免受氧化劑和抗生素的影響[44]。這些酶活性在逆境中的下降可能也是導致根瘤菌生長受阻的直接原因。在Cu2+濃度≤0.8 mmol·L-1脅迫下,苜蓿中華根瘤菌抗性菌株可通過提高SOD、CAT、GPX、GR的活性以降低Cu2+的毒害效應[21]。
本試驗中,酸脅迫下竹豆、豇豆和田菁根瘤菌OD值顯著降低,而綠豆根瘤菌變化較小;當NaCl濃度增加至20 g·L-1時,竹豆根瘤菌OD無顯著變化,而其余根瘤菌OD均顯著下降。說明不同豆科綠肥作物根瘤菌對不同逆境脅迫的響應存在明顯的品種差異,如綠豆根瘤菌相對耐酸,而竹豆根瘤菌相對耐鹽。這種差異可能與不同品種根瘤菌抗氧化酶的調節能力不同有關[41]。如根瘤菌SOD酶活性對pH和活性鋁最敏感的是田菁根瘤菌,CAT酶活性對pH和活性鋁最敏感的是綠豆根瘤菌,POD酶活性對pH和活性鋁最敏感的是竹豆。在苜蓿根瘤菌的研究中,李智燕等[23]發現天藍苜蓿根瘤菌的CAT、POD和GR酶活性隨活性鋁濃度增大顯著下降,而紫花苜蓿根瘤菌的SOD、CAT及GR酶活在低鋁脅迫下無顯著變化,在高鋁脅迫下顯著下降。這些結果說明,不同根瘤菌中參與抵御逆境的抗氧化酶存在差異。品種間根瘤菌抗氧化酶活性調節能力的差異可能與各自遺傳背景有關,而且這種對能力是相對穩定的[45]。
綜合分析認為,不同夏季豆科綠肥品種中,田菁不耐酸、鋁脅迫,但對鹽脅迫有一定耐受性;竹豆、綠豆和豇豆對低濃度的鹽和弱酸性環境有一定耐受性;但是所有品種對活性鋁濃度增加較為敏感。在酸性和鹽堿化土壤,較高濃度的H+、活性鋁或NaCl抑制種子萌發,減緩根瘤菌的生長,降低根瘤菌對有害物質的抗氧化能力,最終限制豆科綠肥作物的早期生長。整體而言,根瘤菌抗氧化酶活性較發芽率對脅迫敏感。

