基于MR模板的PET/MRI衰減校正方法
胡 彬,胡海勇
(1.浙江醫藥高等專科學校醫療器械學院,浙江 寧波 315100;2.寧波市第二醫院設備科,浙江 寧波 315010)
PET/MR是繼PET/CT之后的又一種功能分子影像成像設備,進一步增強了多模態成像的優勢,在醫學分子成像領域頗受關注[1]。相比CT,MRI可為PET提供細節對比度更佳的軟組織影像,在功能顯像方面形成優勢互補;而影響PET顯像定量分析精度的諸多因素,如噪聲、部分容積效應(partial volume effect, PVE)和運動偽影等均可通過MRI提供的解剖學和運動跟蹤信息加以改善[2],且MRI無輻射。因人體各部分組織密度存在差異,其中骨骼致PET光子衰減效果尤為顯著[3],故需對組織衰減進行補償;實現PET/MRI準確定量分析的關鍵在于解決衰減校正的問題[4]。PET/MRI一體機無法使用68Ge/68Ga或CT透射掃描獲取衰減數據,只能從MRI中導出組織衰減信息,故需要應用基于MRI的衰減校正(MR based attenuation correction, MRAC)技術[5],其目標是將與組織質子密度和弛豫時間相關的MR信號轉換為與PET能級電子密度相關的線性衰減系數(linear attenuation coefficient, LAC)[4]。目前PET/MRI衰減校正方法主要有3類。第1類是圖譜配準法[5],根據圖像模板來源不同,又可分為模板法和地圖集法。模板法對采集到的組織圖像進行整合處理,以取平均值得到的圖像作為衰減校正模板;地圖集法需要建立一個數據圖庫,其中包含大量的患者CT和MRI信息,通過查地圖集,將患者的MRI轉化為偽CT圖像,以匹配各種組織的衰減系數而用于衰減校正[5-7]。第2類是分割法,使用不同的MR脈沖序列,如Dixon序列[8]或超短回波時間(ultrashort echo time, UTE)序列[7],將組織成分(例如空氣、腦組織和骨)進行分割,并賦予相應的LAC。第3類方法是基于PET發射數據重建法,使用PET發射數據中同時包含的組織衰減信息進行衰減校正,再利用MRI提供的高分辨力組織結構解剖圖和TOF技術的精確定位功能,可以準確獲取衰減圖[9]。最新的PET/MRI設計允許同時發射和采集,但需額外增加輻射劑量和飛行時間檢測器功能[10]。
本研究將每名受試者的T1WI與SPM 12(Statistic Parametric Mapping, version 12)T1WI MR模板進行空間歸一化,再與PET透射模板配準,形成個體化衰減圖,并將最終衰減校正結果與直接行PET透射掃描獲得的衰減校正結果進行對比和分析。
1 資料與方法
1.1 一般資料 2017年1月—12月于寧波市第二醫院招募30名志愿者,男、女各15名,年齡32~55歲,平均(42.6±6.0)歲。
1.2儀器與方法 在注射示蹤劑之前,使用68Ge棒源進行10 min透射掃描。隨后對受試者經靜脈注射18F-FDG(200 MBq),采用Siemens ECAT HR+PET掃描儀以三維采集模式獲取PET放射數據。將所得數據匯合成單幀圖像后,采用傅里葉濾波反投影法重建圖像,每幀圖像采集時間為30~60 min。采用Siemens Sonata 1.5T MR儀進行MR掃描,以磁化準備快速梯度回波(magnetization prepared rapid gradient echo, MP-RAGE)序列采集T1WI,TR 163 ms,TE 2.4 ms,矩陣256×256,層厚7.5 mm,層間距2.5 mm。
將受試者的PET透射模板與SPM 12提供的T1WI MR模板進行空間歸一化,并將歸一化后的圖像與PET透射模板配準,即獲得每名受試者的個體化衰減圖。為驗證不同模板之間衰減校正效果的差異,以所有受試者為基礎組(general mean group, gmg;n=30),并根據性別、頭部尺寸不同分為女性組(female mean group, fmg;n=15)、男性組(male mean group, mmg;n=15)和小尺寸頭部組(small mean group, smg,最大頭寬<159 mm,高度<207 mm,n=16)、大尺寸頭部組(big mean group, bmg,最小頭寬≥159 mm,高度≥207 mm,n=14),對應生成各自的模板。
1.3 創建個體化衰減模板 ①制作SPM 12 T1WI MR衰減模板,采用SPM 12軟件中提供的衰減圖像模板,將30名受試者的PET衰減圖像分別與該模板進行非線性配準,實現空間歸一化;隨后將30個衰減圖像平均,獲得SPM 12 T1WI MR衰減模板(圖1A);②將SPM 12 T1WI MR衰減模板與每名受試者的T1WI(圖1B)進行非線性配準,使其空間歸一化;③將上一步取得的空間模型形變參數導入PET透射模板(圖1C),生成個體化的受試者衰減圖(圖1D),用于FDG PET圖像正向投影衰減校正(圖1E)。
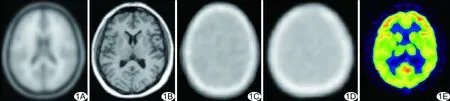
圖1 受試者個體化衰減圖制作流程 A.以SPM 12軟件獲得T1WI MR模板; B.受試者T1WI; C.PET透射模板; D.個體化衰減圖; E.通過個體化衰減圖正向投影重建的FDG PET圖像
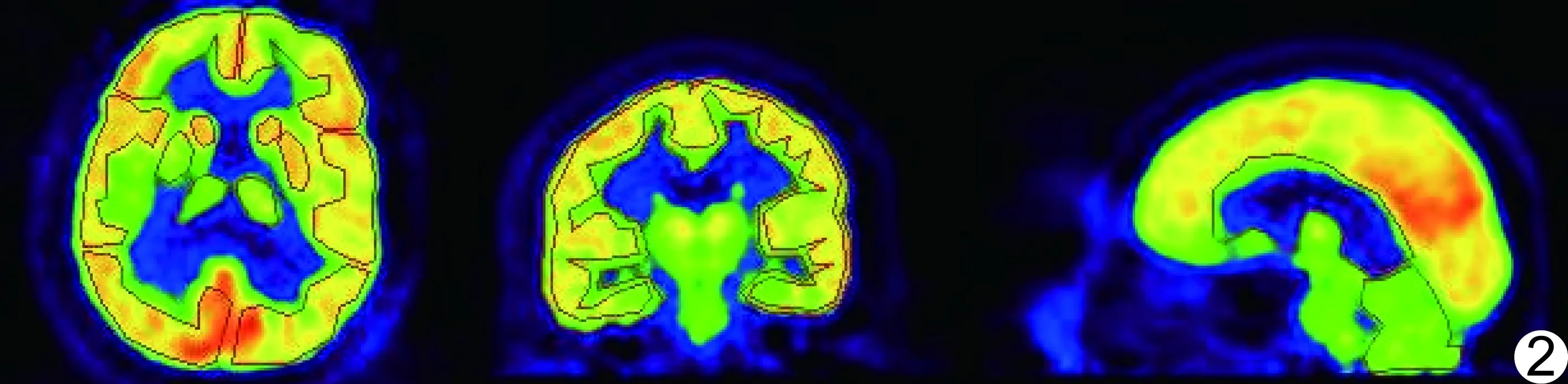
圖2 FDG PET圖像ROI設置示意圖
1.4 數據分析 對每名受試者分別采用5個模板進行衰減校正,獲得校正后的FDG PET圖像。采用MPItool軟件,于經過校正和原始FDG PET圖像上勾畫ROI,位置包括雙側前額葉、顳葉、枕葉、尾狀核、豆狀核、殼核、丘腦和小腦半球(圖2)。計算ROI內平均放射性活度值(公式1)、標準偏差(公式2),并計算經不同模板校正后PET圖像與原始FDG PET數據之間的相對偏差(公式3)。

(公式1)
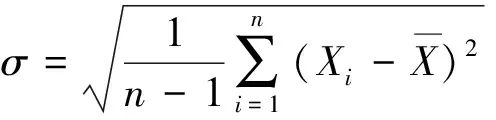
(公式2)
相對偏差=(校正后圖像放射性活度值-原始圖像放射性活度值)/原始圖像放射性活度值×100%
(公式3)

2 結果
以1名女性受試者為例,使用預設模板(bmg、fmg、mmg、smg和gmg)重建圖像數據,獲得ROI內放射性活度平均值、標準偏差值及與原始FDG數據相對偏差值(圖3),其中使用PET透射掃描衰減校正重建圖像所獲得的數據在圖例中標注為FDG。
2.1 單一模板間的對比 對單一受試者分別使用bmg、fmg、mmg、smg和gmg模板,并比較其衰減校正結果,結果顯示相對偏差值非常近似。女性受試者使用不同模板校正后得到的放射性活度最大差值源于smg與mmg模板間,為908 Bq/ml;最小差值源于fmg與gmg模板,為4 Bq/ml。對于男性受試者,使用不同模板校正后得到的放射性活度最大差值源于mmg與gmg模板間,為715 Bq/ml,最小差值源于mmg與fmg模板間,為1 Bq/ml。fmg模板與mmg模板在統計數據上無明顯差異。
2.2原始圖像與經5個不同模板校正后圖像的對比 5個特異性分組模板與原始FDG PET衰減值之間的相對偏差值變化范圍為-6.31%~6.32%(圖3C)。與其他組相比,smg組的相對偏差數值波動相對較小(-2.36%~4.26%)。5個特異性分組模板相對偏差值總體差異均較大,其變化范圍從mmg組的-6.31%到gmg組的6.31%,相對偏差絕對值在mmg組中最小,為-9.13%,在fmg組中最大,為9.97%,因此難以判斷哪個模板最好。
2.3gmg模板與其他4個分組模板對比 gmg模板與其他4個模板的相對偏差值的差異范圍為-3.44%~5.34%,相比于fmg和bmg模板,mmg和smg模板的相對偏差值與gmg模板更為接近(-3.44%~2.37%)。
3 討論

圖3 對1名女性受試者采用不同重建方法獲得的PET圖像參數 A.放射性活度; B.放射性活度標準偏差值; C.相對偏差值
衰減校正是PET/MRI中不可或缺的部分,對PET顯像定量分析的精確性影響巨大[11]。PET/MRI一體機的衰減校正包括硬件和人體組織兩部分,其中硬件是指位置固定和形態不變的設備部件以及體線圈和體表線圈。在PET/MRI中如不使用系統配套的硬件,所采集的PET圖像可能無法獲得徹底的衰減校正圖[11]。在人體組織的衰減校正方面,有多種衰減校正方法。目前已經提出結合機器學習技術的地圖集法[12]、基于UTE序列[13]和零回波(zero echo time, ZTE)序列[14]的MRAC法等。最近出現的一體化同步掃描TOF-PET/MR設備具有超高的PET空間分辨力和更快的掃描速度[15],但成本顯著增加,限制了其應用[16]。
近年來,MRAC方法也越來越多地被應用于PET/MR圖像處理。有學者[17]采用MRAC方法在PET/MR一體機頭部掃描成像中進行衰減校正,取得了良好效果。MRAC準確性的提高依賴于MR模板的創建和方法改進;通過應用患者骨數據代替圖集骨進行衰減校正,可獲得近似于CT衰減校正的準確性[18],但所使用圖集中個體性解剖結構差異所導致的骨衰減差異和竇腔識別誤差均有可能影響MRAC的準確性。
本研究使用MRAC方法,通過T1WI MR模板和PET透射模板與受試者個體化參數進行配準,并形成最終的衰減圖,用于PET衰減校正;結果表明,性別差異性模板對衰減校正效果無明顯影響;在5個不同的分組模板中,gmg模板包含了所有患者數據的一般信息,其衰減校正的結果與其他4個特定模板的差異為-3.44%~5.34%,差異并不明顯。在所有以MR為基礎的衰減校正模板中,gmg模板通用性最佳,與其他特異性模板之間的差異可以接受。相比于PET透射衰減校正法,此法的適用性和精確性有待進一步提高。

