內鏡食道靜脈瘤套扎器治療直腸神經內分泌腫瘤的療效分析
孟明明,魏南,趙書博,王洋,劉紅,吳靜
(首都醫科大學附屬北京世紀壇醫院 消化內科,北京 100038)
神經內分泌腫瘤(neuroendocrine neoplasms,NENs)是一類起源于干細胞且具有神經內分泌標記物、能夠產生生物活性胺和/或多肽激素的腫瘤,生長相對緩慢,具有惡變潛能,主要發生在消化道或胰腺,消化道常見于直腸。直腸NENs在內鏡下表現為黏膜下隆起型病變,既往傳統治療多采用外科手術切除。隨著消化內鏡器械的更新及內鏡技術的發展,對于≤1.0 cm的腫瘤行超聲內鏡檢查,如侵犯深度局限于黏膜肌層或黏膜下層,無遠處轉移,則可經內鏡下行局部切除,術后隨訪[1]。本研究通過回顧性總結分析2015年11月-2017年11月在本院應用內鏡食道靜脈瘤套扎器行內鏡下圈套器法黏膜切除術(endoscopic mucosal resection with ligator device,EMR-L)治療直腸NENs的價值。現報道如下:
1 資料與方法
1.1 一般資料
本研究收集首都醫科大學附屬北京世紀壇醫院消化內鏡中心2015年11月-2017年11月行內鏡下治療的直腸NENs患者共13例,均為術后病理確診。其中,男女比例為1.00∶2.25(女4例,男9例),年齡27~70歲,平均(53.0±12.4)歲。所有患者行常規結腸鏡時均提示隆起性病變,進一步行超聲內鏡提示為黏膜下腫瘤(submucosal tumor,SMT)。患者符合內鏡下治療適應證且無禁忌證,術前簽署知情同意書,告知患者手術的必要性、優勢及風險。
納入標準:①經超聲內鏡診斷直腸SMT,病變未侵及固有肌層;②腫瘤大小≤1.0 cm;③無類癌綜合征的表現,胸腹部增強CT/MRI未提示浸潤生長、淋巴結及遠處轉移等征象。排除標準:嚴重心肺疾病、血液病、凝血功能障礙者。
1.2 器械與材料
電子超聲結腸鏡(PCF-Q260AI,Olympus公司),內鏡食道靜脈瘤套扎器(MD-48710,秋田住友電木株式會社,圖1),一次性圈套器(NOE342217-G,德國ENDO-FLEX),肽夾(HX-610-135L,Olympus公司),和諧夾(ROCC-D-26-195,南京微創公司)。
1.3 方法
1.3.1 術前準備 手術前3 d少渣半流飲食,檢查前1 d晚上及當日早晨口服聚乙二醇電解質溶液(福靜清)4 000 ml+西甲硅油(柏西)30 ml清潔腸道,排便至清水樣大便。

圖1 內鏡食道靜脈瘤套扎器Fig.1 Endoscopic esophagus variceal ligation
1.3.2 手術操作 患者行結腸鏡發現直腸隆起型病變后,進一步行超聲內鏡檢查,明確病變來源及大小。內鏡前端安裝注氣式食道靜脈瘤套扎器,用透明帽抵住病灶,將病灶負壓吸引至透明帽內,予氣囊內快速注入2 ml的空氣,注氣氣囊膨脹后順勢將橡皮膠圈套入吸引的病灶根部,有明顯落空感,退鏡可見病灶被橡皮膠圈套扎呈蒂狀,用透明帽在病灶四周輕輕撥動,使用一次性圈套器圈置于皮圈根部,提拉圈套部位盡可能遠離直腸壁以防損傷肌層,圈套后行高頻電切除病灶。創面若少許滲血,予去甲腎上腺素冰鹽水或巴曲亭沖洗;若為明顯出血,清理創面后予鈦夾夾閉出血點。清潔創面后,鈦夾閉合創面以預防遲發性穿孔發生。病變標本取出后送病理檢查。
1.3.3 術后處理及隨訪 術后禁飲食24~48 h,術后第3天常規應用二代頭孢抗生素預防感染,同時營養支持補液等對癥處理;若出現并發癥則予相應處理。出院后囑患者定期隨訪,術后3個月復查結腸鏡,觀察創面愈合情況、病變有無殘留及復發,如檢查未見明顯異常則每6~12個月復查結腸鏡。
2 結果
2.1 臨床表現
無癥狀體檢者占61.5%(8/13);以大便性狀及習慣改變占30.8%(4/13),包括腹瀉、大便不成形或變細、排便不盡感等;便血占7.7%(1/13)。所有患者均無發作性皮膚潮紅、分泌性腹瀉、低血壓、心率增快、呼吸困難和惡心嘔吐等類癌綜合征表現。
2.2 內鏡下表現
13例患者結腸鏡下表現:病變呈廣基或半球形、黏膜層或黏膜下隆起,黏膜表面光滑,部分表面可見毛細血管,色呈淡黃色或蒼白。超聲內鏡下表現:病變呈均質或不均質低回聲,邊界清,管壁五層結構完整。病變起源于黏膜肌層病變共7例,起源于黏膜下層病變共5例,起源于黏膜肌層和黏膜下層病變1例。超聲鏡下測量病變直徑為2~8 mm,平均(5.2±1.3)mm。
2.3 內鏡下治療
13例患者均順利完成EMR-L術,直腸NENs EMR-L切除過程見圖2。耗時為10 min 36 s~52 min 21 s,平均(21.9±10.6)min。術中發生急性出血1例,予藥物噴灑治療后出血停止。所有患者無直腸遲發性出血及穿孔等并發癥發生。
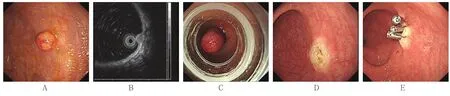
圖2 直腸神經內分泌腫瘤EMR-L切除圖像Fig.2 Images of EMR-L for rectal neuroendocrine neoplasms
2.4 病理結果
13例標本送檢病理結果均顯示為直腸類癌或NENs,鏡下表現可見排列呈實性小巢狀、結節狀或島嶼狀構型,小管狀或菊形團樣構型,或者幾種結構共存。瘤細胞呈圓形、卵圓形,大小較一致,核圓或卵圓形,核染色質粉染,核仁不明顯,核分裂象罕見切緣均未見異型細胞[2]。免疫組織化學結果:突觸素(synaptophysin,Syn)陽性率為92.3%(12/13),嗜鉻粒蛋白A(chromogranin A,CgA)陽性率為69.2%(9/13),CD56陽性率為92.3%(12/13),細胞角蛋白(cytokeratin,CK8/18)陽性率為100.0%(3/3),CAM5.2陽性率為100.0%(6/6),神經元特異性烯醇酶(neuronspecificenolase,NSE)陽性率為50.0%(1/2);核分裂象數0~1/10 HPF,Ki-67標記率均小于5.0%,分級G1~G2。
2.5 隨訪結果
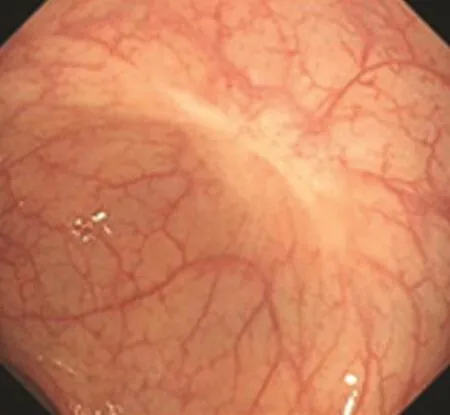
圖3 術后復查所見Fig.3 Postoperation review
13例患者術后隨訪,其中9例(69.2%)術后定期復查結腸鏡。如圖3所示,鏡下可見創面愈合良好,呈白色瘢痕樣改變。隨訪1個月~2年,未發現復發或遠處轉移,其余4例術后未復查腸鏡。通過查閱患者復查資料及電話隨訪,患者術后無腹痛、腹脹和排便困難等不適感,術后隨訪終點為2017年11月。
3 討論
胃腸道神經內分泌腫瘤(gastrointestinal neuroendocrine neoplasms,GI-NENs) 最 初 在1907年 由OBERNDORFER命名為“類癌”且沿用至今,因其起源于彌散神經內分泌系統中的神經內分泌細胞的腫瘤,2010年世界衛生組織(WHO)采用了NENs來泛指所有來源于神經內分泌細胞的腫瘤。消化道胃腸胰腺是NENs最常發生的部位,直腸NENs的發病率約占消化道NENs發病率的1/3[3-5]。
直腸NENs是一種低度惡性腫瘤,多見于40~60歲中老年人,男女發病無明顯差異性,病變常為單發病灶,臨床上通常缺乏典型的癥狀及體征,極少出現類癌綜合征,易漏診或誤診,尤其對于小病灶(<1.0 cm)[6-7]。本研究結果顯示,發病平均年齡是(53.0±12.4)歲,臨床表現以無癥狀體檢者居多,大便習慣改變次之,發病年齡、臨床癥狀均符合文獻報道。結腸鏡是目前發現直腸NENs最好的檢查手段,本研究13例病例結腸鏡下表現為廣基或半球狀黏膜下隆起,黏膜表面完整光滑,淡黃色或蒼白,質地較硬,同多數研究鏡下表現相同。因腫瘤位于黏膜下,還需依靠超聲內鏡進一步評估腫瘤大小、腸壁起源、侵犯深度、周圍有無血管浸潤及淋巴結轉移[8]。文獻報道治療前通過超聲內鏡對直腸NENs浸潤深度及大小的判斷,與術后組織病理學獲得結果相符率可達100.0%[9]。本研究13例病例超聲內鏡顯示,病變直徑在0.3~0.8 cm,起源于黏膜肌層和黏膜下層,向腔內突出,管壁五層結構存在,無血管浸潤及淋巴結轉移。通過超聲內鏡對直腸NENs有了大體的判斷,下一步就是治療。
直腸NENs的治療,傳統治療方法為外科手術切除,但外科手術具有創傷大、并發癥多及費用高等缺點。近年來隨著消化內鏡技術的發展,內鏡器械的更新,對于≤1.0 cm的腫瘤僅限于黏膜層和/或黏膜下層,且沒有典型癥狀、沒有侵犯淋巴及血管時,可行內鏡下切除;而對于1.0~2.0 cm的腫瘤治療,超聲內鏡檢查顯示腫瘤未浸潤固有肌層,也無淋巴結轉移,則經肛門直視下局部切除或行直腸全系膜切除術(totalmesorectalexcision,TME)[10-11]。因此,超聲內鏡可很好地判斷內鏡下切除腫瘤的可行性及安全性,同時避免不必要的外科手術。目前內鏡治療黏膜下腫瘤的常用方法主要是內鏡下黏膜切除術(endoscopic mucosal resection,EMR)、內鏡黏膜下剝離 術(endoscopic submucosal dissection,ESD)。ESD近年來被廣泛應用于切除黏膜及黏膜下病變,其相比于EMR,更能完整切除病灶,可以獲得更準確的病理學結果[12]。但是,ESD在技術方面對內鏡醫生要求高,手術耗時較長[13],出血、穿孔等并發癥發生率較高。研究表明,EMR相較于ESD具有操作時間短、經濟負擔輕及并發癥少等優勢[14]。對于≤1.0 cm且不侵犯固有肌層的病變,EMR足以一次性完整切除病變[13]。EMR分類為非吸引法(直接圈套切除)和吸引法(包括透明帽法,Cap-EMR和套扎器法,EMR-L)[15]。直接圈套切除病變時,圈套器易滑脫導致圈套病變深度淺,難以一次性完整切除病灶,腫瘤殘留發生率高。借助透明帽吸引和連環套扎器均可以進一步提高完整切除的概率,但是透明帽吸引時黏膜遮擋視野,圈套器在透明帽內不易操作,而連環套扎器多為6或7連環,直腸NENs多為單發病灶,容易造成手術器械的浪費。
最初套扎器用于治療食管胃底靜脈曲張或食管靜脈瘤[16],目前已廣泛應用于消化道息肉、黏膜下腫瘤和消化道早癌等多種消化道疾病的治療。本研究中,筆者應用注氣式食道靜脈瘤套扎器和EMR-L切除直腸NENs,13例病變均達到完整切除的目的,僅1例在術中出現滲血,經藥物噴灑后出血停止,無1例出現穿孔、大出血等嚴重并發癥,術后愈合良好。隨著此項技術操作越來越熟練,從安裝套扎器到創面封閉良好,整個操作時間從原來的30 min內縮短至15 min內,減少了患者不適時間,也減少了術中感染的概率。筆者在治療這13例直腸NENs過程中的經驗體會是:①治療前后超聲內鏡檢查用于診斷及隨訪,超聲內鏡對直腸NENs的診斷、治療方案的選擇及隨訪具有重要意義,對于病變直徑大于1.0 cm,超聲內鏡檢查懷疑有惡性腫瘤可能者,不適合行EMR-L,可行外科手術。術后超聲內鏡檢查可以判斷是否有殘留或復發;②套扎前不進行黏膜下注射,避免因注射后周邊黏膜隆起,造成套扎困難;③根據病灶的大小控制吸引的力度,大的病灶吸引力度大些,讓病灶組織充滿透明帽,而小的病灶吸引力度小一些,防止吸引過多的正常組織,減少并發癥的發生;④橡皮圈套扎使其病灶底部血流中斷,病灶黏膜顏色變為紫紅色再行切除,切除前予透明帽在病灶四周輕輕推動,并于切除時反復提拉病變,避免直腸全層套入橡皮圈內,從而將出血、穿孔等嚴重并發癥的可能性降至最低。從本研究可以看出,單發食道靜脈瘤套扎器可隨意按需選用皮圈結扎,從而降低了費用;該方法容易將病變套住,圈套及切割過程視野清晰,并發癥少,操作時間短,完整切除病變成功率高。
本研究所有患者均行EMR-L切除瘤體并送病理檢查,術后病理提示基底切緣干凈,瘤體病理為NENs,與術前超聲內鏡判斷相符。直腸NENs有時與直腸低分化腺癌不易區別,病理檢查是鑒別直腸NENs的金標準,確診有賴于免疫組化檢查,如Syn、CgA、CD56和Ki-67等。本研究認為對于NENs來說最敏感的免疫組化標記物中為Syn(92.3%)、CD56(92.3%),其次為CgA(69.2%),與研究報道相符[17]。患者自覺術中無明顯不適,術后恢復良好,無排便困難等不適。因直腸NENs為低度惡性腫瘤,治療后應注意隨訪,建議術后第3個月復查腹部增強CT/MRI及結腸鏡,無復發則可延長隨訪時間(術后第6和12個月),一旦發現復發應再次切除[1,18]。本組所有患者復查均未見復發及轉移。
本研究證實在超聲內鏡的指導下,單發食道靜脈瘤套扎器聯合圈套器行EMR-L治療小于1.0 cm的直腸NENs,操作方法易于掌握,不但可以完整切除腫瘤,而且出血、穿孔等并發癥少,花費少,耗時短。隨著內鏡技術的發展,EMR-L對于治療小于1.0 cm直腸NENs來說是一種簡單、快速、有效、安全、經濟的方法,值得臨床進一步推廣應用。

