基于常規T2WI灰度共生矩陣紋理參數鑒別診斷卵巢實性腫瘤良惡性
董天發,麥 慧,魏慧慧,毛義菲,唐文艷,陳展航
(廣州醫科大學附屬第三醫院放射科,廣東 廣州 510150)
卵巢惡性腫瘤為女性生殖系統常見腫瘤,致死率居婦科腫瘤之首[1],術前準確判斷腫瘤的性質對制定治療決策及評估預后具有重要臨床意義。原發卵巢實性腫瘤發病率較囊性、囊實性腫瘤低,良性與惡性腫瘤間影像學表現存在重疊,常規MRI難以鑒別。不同研究[2-3]對DWI定量參數ADC值鑒別良惡性卵巢實性腫瘤的價值存在分歧,但傾向于ADC值不能作為鑒別診斷的可靠指標。作為新興的圖像后處理技術,紋理分析可通過軟件定量提取圖像中肉眼無法識別的紋理特征來揭示病變的內在異質性;良惡性腫瘤具有不同的異質性,使得紋理分析鑒別診斷良惡性腫瘤成為近年來的研究熱點[4]。灰度共生矩陣(gray-level co-occurrence matrix, GLCM)是最常用的二階紋理分類方法,反映灰度的空間相關特性。Haralick[5]最初定義了28個GLCM的紋理參數,其中能量、對比、相關、逆差距和熵在鑒別診斷腫瘤良惡性和療效評估中具有較高效能[6-8]。本研究探討基于常規T2WI GLCM紋理分析鑒別診斷良惡性卵巢實性腫瘤的價值。
1 資料與方法
1.1一般資料 收集2014年1月—2017年12月我院收治的經手術病理證實的93例原發性卵巢腫瘤患者,排除囊性為主的腫瘤34例(囊腺瘤16例、囊腺癌18例)和成熟型畸胎瘤13例,最終納入46例實性卵巢腫瘤;患者年齡25~77歲,中位年齡53歲。其中良性腫瘤19例(良性組),年齡29~61歲,中位年齡52歲,腫瘤長徑2.51~18.42 cm,平均(10.51±5.70)cm,包括卵泡膜纖維瘤15例、卵泡膜細胞瘤2例和硬化性間質瘤2例;惡性腫瘤27例(惡性組),年齡25~77歲,中位年齡54歲,腫瘤長徑3.43~20.54 cm,平均(13.63±7.67)cm,包括上皮源性腫瘤11例(卵巢子宮內膜樣腺癌3例、透明細胞癌4例、癌肉瘤3例、淋巴瘤1例)、性索間質來源腫瘤6例(均為顆粒細胞瘤)及生殖細胞來源腫瘤10例(無性細胞瘤4例、卵黃囊瘤3例、惡性畸胎瘤3例)。
1.2儀器與方法 采用Philips Gyroscan Achieva 3.0T MR掃描儀,腹部相控線圈。主要參數:軸位FSE序列T2WI,TR 3 896 ms,TE 71.7 ms,FOV 300 mm×225 mm;矢狀位脂肪抑制FSE序列T2WI,TR 3 516 ms,TE 69 ms,FOV 215 mm×270 mm;軸位脂肪抑制FSE序列T1WI,TR 637 ms,TE 9.1 ms,FOV 280 mm×210 mm;層厚均為5 mm,層間距 6 mm。對比劑采用Gd-DTPA,劑量0.1~0.2 mmol/kg體質量,流率2.5~3 ml/s,采用e-THRIVE脂肪抑制序列行軸位動態增強掃描及冠狀位、矢狀位延遲增強掃描。
1.3紋理分析方法 由2名具有婦科腫瘤MRI診斷經驗的醫師協商選擇T2WI中病灶最大層面,采用Image J (https://imagej.nih.gov/ij/download.html)軟件,由其中1名醫師沿病灶邊緣手動勾畫ROI,紋理分析插件均設置為默認值,像素間距(d)為1,兩點之間連線與軸的夾角(θ)為0°,軟件自動計算GLCM的紋理特征參數,包括能量、對比、相關、逆差距和熵(表1、圖1)。

表1 GLCM紋理參數及其意義
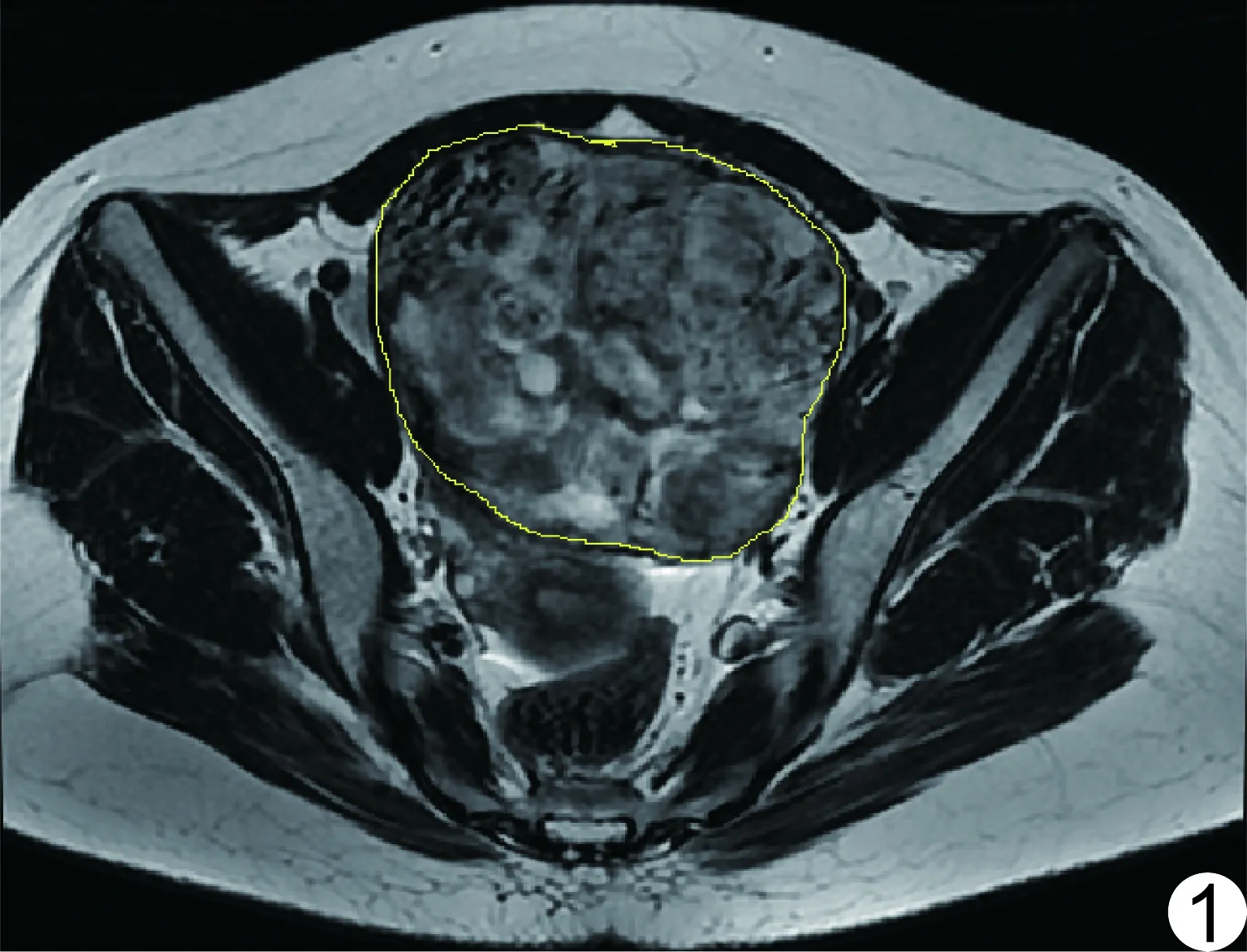
圖1 顆粒細胞瘤的T2WI紋理分析示意圖
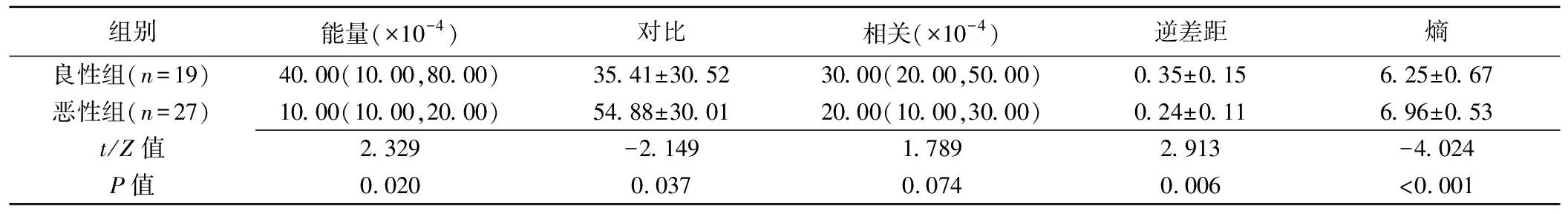
表2 良性組與惡性組GLCM參數比較
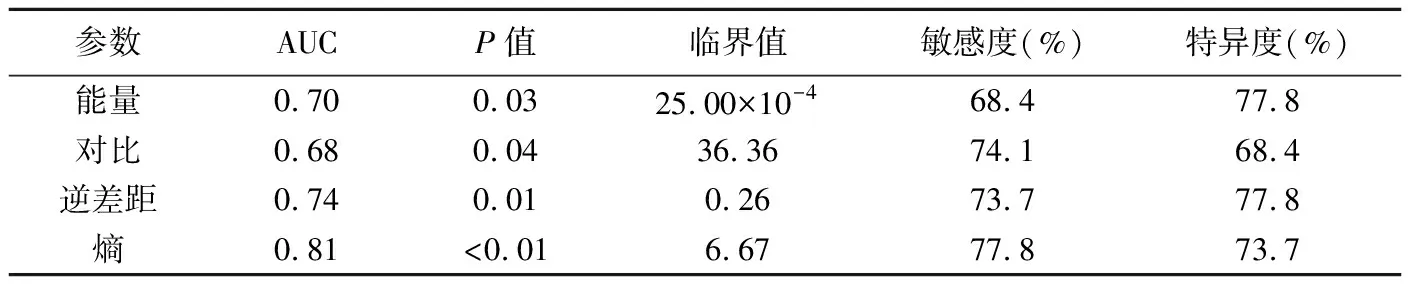
表3 基于T2WI的GLCM各參數對良惡性卵巢實性腫瘤的診斷效能
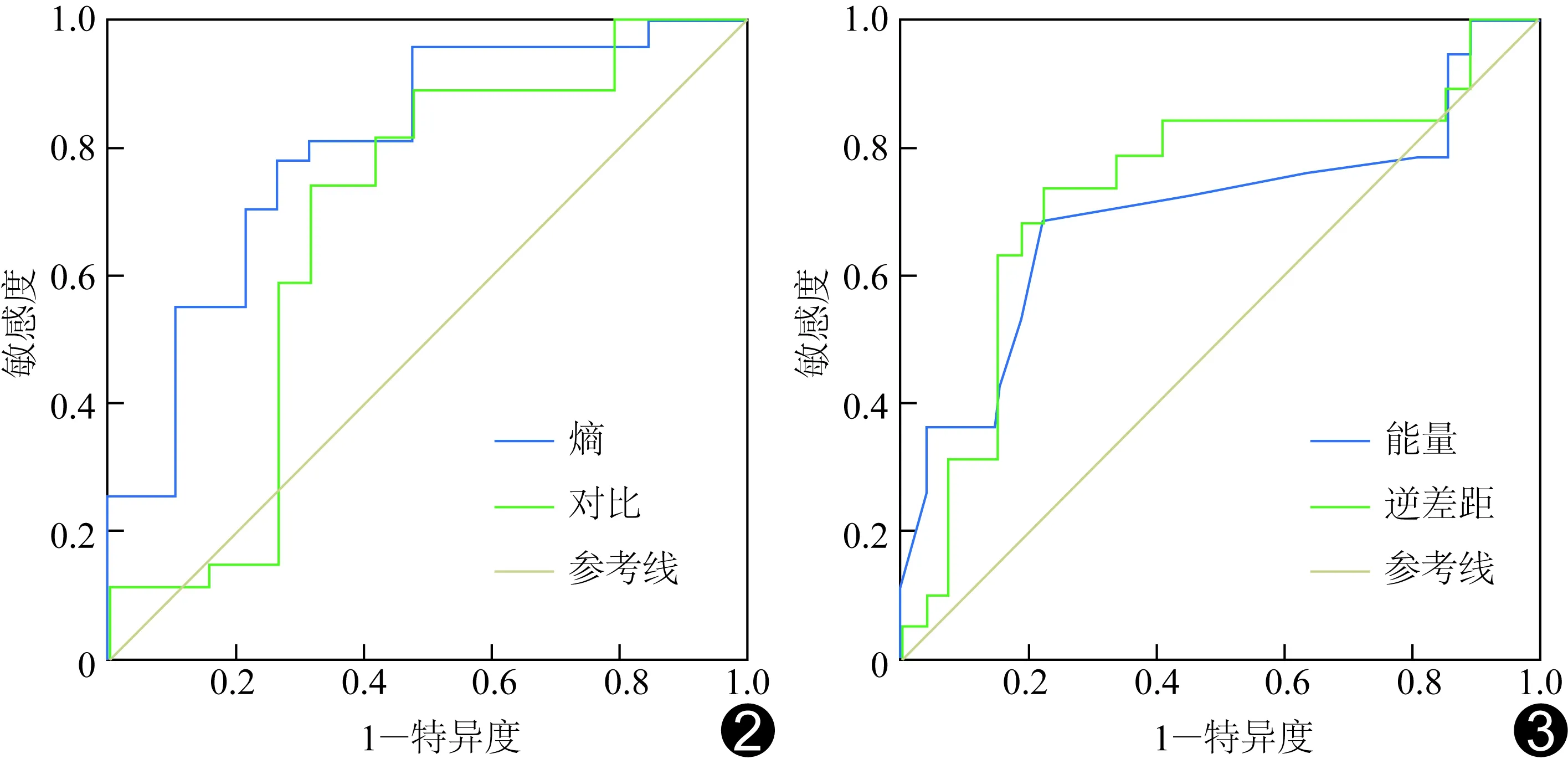
圖2 熵和對比的ROC曲線 圖3 能量和逆差距的ROC曲線
1.4統計學分析 采用SPSS 17.0統計分析軟件。對計量資料進行正態分布檢驗,服從正態分布的計量資料以±s表示,良、惡性組間比較采用獨立樣本t檢驗;不服從正態分布的計量資料以中位數(上下四分位數)表示,良、惡性組間比較采用Mann-WhitneyU檢驗。對有統計學差異的參數行進行ROC曲線分析,以評價其鑒別診斷卵巢實性良惡性腫瘤的效能。P<0.05為差異有統計學意義。
2 結果
2.1GLCM紋理參數比較 惡性組的熵、對比均高于良性組(P均<0.05),逆差距和能量均低于良性腫瘤組(P均<0.05);2組間相關差異無統計學意義(P=0.074);見表2。
2.3GLCM紋理參數診斷效能 能量、對比、逆差距和熵鑒別診斷卵巢實性腫瘤良惡性的效能見表3,ROC曲線見圖2、3,其中熵的診斷效能最佳,其AUC為0.81(P<0.01),以6.67為臨界值,鑒別良惡性卵巢實性腫瘤的敏感度為77.8%,特異度為73.7%。
3 討論
術前準確評估卵巢腫瘤的良惡性具有重要臨床意義。卵巢實性腫瘤發病率較低,目前國內外關于卵巢實質性腫瘤的MRI診斷多集中于分析單一病種的影像學特征,如對卵泡膜纖維瘤、顆粒細胞瘤、卵黃囊瘤等的分析。不同疾病具有各自的MRI特征。在臨床實踐中,影像學醫師多通過腫瘤大小、邊界、信號特征、強化方式和盆腔淋巴結情況等來評估卵巢實性腫瘤的良惡性,缺乏客觀的量化指標,對醫師的診斷經驗依賴性強,易造成漏診或誤診。即使是經驗豐富的影像學醫師,常規MRI術前準確鑒別腫瘤的良惡性也具有一定難度。如卵泡膜纖維瘤合并腹腔或胸積液時(Meigs綜合征),易被誤診為惡性腫瘤。DWI廣泛用于鑒別良惡性腫瘤,其定量參數ADC值對定性診斷腫瘤有一定價值,但對于鑒別良惡性卵巢腫瘤的價值有限,原因可能為在于卵巢良性實質性腫瘤多富含纖維組織,腫瘤結構致密含水較少,導致ADC值下降,難以與惡性病變的水分子擴散受限相鑒別。田曉梅等[2,9]認為ADC值對鑒別良惡性卵巢實性腫瘤并無幫助。
與常規影像學相比,紋理分析不依賴于影像醫師的主觀判斷和臨床經驗,可提供病變圖像的客觀信息[10]。許多紋理參數可反映腫瘤的異質性,腫瘤惡性程度越高,其異質性越強。目前用于鑒別腫瘤性質的紋理特征多來源于T2WI,原因可能是T2WI的TE相對較長,增加了組織間對比度,使圖像中蘊含更多具有鑒別診斷意義的紋理特征。常規MRI紋理分析鑒別腦膠質母細胞瘤與單發轉移瘤[11]以及良惡性乳腺病變[12]的紋理差異均主要基于T2WI,誤診率較低。有研究[13]認為脂肪抑制T2WI紋理分析可以鑒別肝癌、肝血管瘤與轉移瘤。
紋理分析的計算方法有多種,GLCM是最常用的二階特征紋理方法,反映灰度的空間相關特性,由于計算和理解方便而應用廣泛。GLCM參數可較完整地描述圖像的紋理特征,其中能量、對比、相關、逆差距、熵是最為常用的5個GLCM紋理參數[14-15]。Wibmer等[8]認為該組參數能鑒別前列腺結節良惡性及預測結節的Gleason評分。郭冬梅等[16]認為基于MRI超順磁性氧化鐵增強圖像的GLCM參數可以鑒別大鼠肝細胞癌和肝硬化結節,肝細胞癌的相關及熵值高于肝硬化結節,能量及逆差距均低于肝硬化結節。本組選取這5個GLCM紋理參數對卵巢實性腫瘤的T2WI圖像進行紋理分析,發現惡性卵巢實性腫瘤的能量、逆差距低于良性腫瘤,對比和熵高于良性腫瘤(P均<0.05),提示卵巢惡性腫瘤的紋理細致程度較低、紋理不規則、復雜,腫瘤的異質性更強;其中以熵的ROC曲線的AUC最大,以6.67為臨界值,鑒別良惡性卵巢實性腫瘤的敏感度為77.8%,特異度為73.7%,與其他學者對于鑒別良惡性乳腺、前列腺、肝臟病變的研究結果相似[8,12,16]。
本研究不足:①未比較MRI紋理分析參數與常規MRI診斷效能的差異;②本組僅依據文獻經驗選取T2WI紋理分析,未比較MRI功能成像的紋理分析對卵巢實性腫瘤良惡性鑒別的診斷效能;③為單中心回顧性研究,樣本量和包含的病種均較少,且僅提取了GLCM的5個定量參數,未能建立預測模型,缺乏外部數據的驗證,結果有待多中心、大樣本影像組學研究進一步驗證。
總之,本研究結果提示基于T2WI的GLCM紋理分析對鑒別良惡性卵巢實性腫瘤有一定臨床應用價值,為卵巢腫瘤的鑒別診斷提供了新的思路和方法。

