HBV相關肝癌代謝共生初步探討
楊婧 孟慶華
100069北京,首都醫科大學附屬北京佑安醫院肝病重癥醫學科
全球約有20億人曾感染過HBV,其中2.48億為慢乙肝感染者,每年大約有100萬人死于HBV相關性肝硬化和肝癌。我國在2006年一項HBV血清流行病學調查結果顯示1~59歲的HBsAg陽性率為7.18%,約有9 000萬人是HBV慢性感染者[1]。有研究證實,50% ~80%的肝癌病例與HBV密切相關[2]。2012年EASL臨床實踐指南提到當肝硬化明確時,肝癌年發病率為2% ~5%。HBV感染是我國肝癌的首要危險因素。
20世紀20年代Atto Warburg提出了代謝重編程理論,該理論認為腫瘤細胞生長在缺氧的微環境中,缺氧誘導因子-1α(hypoxia inducible factor-1α,HIF-1α)表達升高進而誘導葡萄糖轉運體 1(Glucose transporter 1,GLUT1)高表達,增加葡萄糖的攝入,上調丙酮酸激酶 2(pyruvate kinase M2,PKM2)等有氧糖酵解途徑的多個關鍵酶,從而產生大量終產物乳酸。
近年來有研究顯示,腫瘤細胞代謝存在著有氧糖酵解及代謝共生兩種方式[3]。“有氧糖酵解”產生的乳酸由缺氧區細胞經單羧酸轉運蛋白4(monocarboxylic acid transporter4, MCT4)外排,又經MCT1被富氧區細胞攝取,進而通過三羧酸循環產生能量。因此,MCT1/4共表達于腫瘤組織也被認為是腫瘤代謝共生的生物標志[4]。有文獻證實,眾多腫瘤均存在代謝共生現象[5-9]。
本研究對10例HBV相關的原發性肝癌患者的肝癌及癌旁組織進行免疫組化,檢測其組織代謝指標、臨床生化及病毒學指標;選取肝癌HLE細胞通過不同缺氧時間、不同環境氧濃度培養,模擬實體腫瘤內部缺氧環境,其目的是了解肝癌在缺氧環境中有氧糖酵解和代謝共生狀況,為臨床精準干預提供理論依據。
1 材料與方法
1.1 研究對象 研究對象入組標準10例標本均為2016—2017年間于首都醫科大學附屬北京佑安醫院肝膽外科接受肝占位性病變根治性切除,并經組織病理學證實的原發性肝癌;患者術前均未發現遠處轉移,未接受放化療,無手術史;標本均經4%多聚甲醛固定、石蠟包埋包括腫瘤組織及癌旁組織;10例患者有完整的臨床資料,包括性別、年齡、肝炎史、術前 AFP、ALT、TBil、ALB、PLT、PTA、Child分級等。
1.2 排除標準 非乙型肝炎病毒感染者;肝轉移癌;合并膽管癌、胃癌等其他腫瘤;妊娠女性。
1.3 材料與試劑 HRP山羊抗兔鼠通用二抗(DAKO,丹麥);組化試劑盒 DAB 顯色劑(DAKO,丹麥);無水乙醇(國藥,上海);二甲苯(國藥,上海);BSA(索萊寶公司,北京);肝癌細胞株(HLE細胞株)由北京市肝病研究所提供;正常肝細胞株(L02細胞株)由北京市肝病研究所提供;DMEM培養基(HyClone,美國);胎牛血清(四季青公司,杭州);青霉素、鏈霉素雙抗(索萊寶公司,北京);β-actin抗體(CST 公司,美國,4970S);HIF-1α(WB 工作濃度 1∶1000,購自 Abcam 公司,Ab187524)、GLUT1(WB 工作濃度 1∶1000,購自 Abcam 公司,Ab652)、PKM2(WB工作濃度 1∶1000,購自 Abcam公司,Ab150377)、抗MCT1兔抗人多抗抗體(IHC工作濃度1∶200,WB 工作濃度 1∶1000,購自 Abcam 公司,Ab85021)、抗MCT4兔抗人多抗抗體(IHC工作濃度1∶100,WB 工作濃度 1∶1000,購自 Abcam 公司,Ab180699);羊抗兔IgG抗體-辣根過氧化物酶(WB工作濃度 1∶1000,碧云天公司,A0208);PVDF 膜(Millipore公司,美國)。
1.3 方法
1.3.1 免疫組化:①石蠟切片脫蠟及水化。②抗原修復:EDTA抗原修復緩沖液(PH8.0)中微波修復。冷卻后PBS(PH7.4)洗滌3次,每次5 min。③阻斷內源性過氧化物酶:3%過氧化氫溶液,室溫避光孵育25 min,PBS(pH7.4)洗滌 3 次,每次 5 min。 ④BSA封閉:3%BSA,室溫封閉30 min。⑤加一抗:滴加一抗,4℃孵育過夜,PBS(pH7.4)洗滌3次,每次5 min。⑥加二抗:滴加二抗,室溫孵育50 min。PBS(pH7.4)洗滌3次,每次5 min。⑦DAB顯色:滴加新鮮配制的DAB顯色液,陽性為棕黃色。⑧復染細胞核:Harris蘇木素復染,1%的鹽酸酒精分化,氨水返藍。⑨脫水封片:脫水后中性樹膠封片。⑩顯微鏡鏡檢,圖像采集分析。
1.3.2 免疫組化結果判定:蘇木素染細胞核為藍色,DAB顯出的陽性表達為棕黃色。
1.3.3 細胞培養:使用10 cm的細胞培養皿,應用含有10%胎牛血清、100μg/ml青霉素和100μg/ml鏈霉素的高糖DMEM培養液,在37℃,5%CO2的培養箱中培養,每24 h~28 h傳代1次。
1.3.4 缺氧培養HLE細胞:將處于對數生長期的HLE細胞更換為無血清的基礎DMEM培養液,并同時放入Binder三氣培養箱內,分別培養6 h、12 h、24 h和48 h。正常對照組HLE細胞不作任何處理,相同條件培養。
1.3.5 環境氧濃度對HLE細胞代謝的影響:將處于對數生長期的HLE細胞更換為無血清的基礎DMEM培養液,并同時放入Binder三氣培養箱內,分別在0.2%、8%、19%氧濃度環境中培養12 h。正常對照組HLE細胞、L02細胞不作任何處理,在37℃,5%CO2的細胞培養箱中培養。
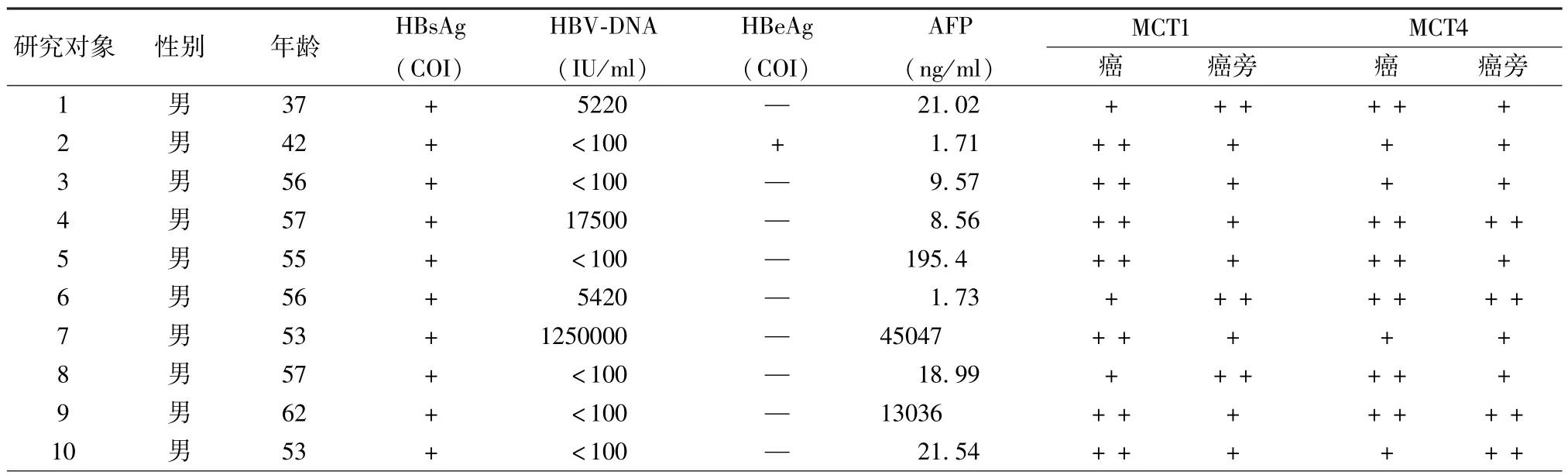
表1 10例HBV相關HCC患者基本資料Tab.1 Basic information of 10 patients with HBV-related HCC
1.3.6 Western blot檢測 HLE 細胞 HIF-1α、GLUT1、PKM2、MCT1、MCT4蛋白表達:收集正常對照組和上述不同缺氧處理組的培養細胞,分別用1 ml預冷的PBS清洗3次,立即收集細胞;冰上提取細胞總蛋白,BCA法測定蛋白濃度;取30μg的總蛋白進行SDS-PAGE電泳,轉膜;5%脫脂牛奶室溫封閉1 h;一抗(1∶1000)4℃過夜孵育,1xTBST洗膜3次,每次10 min;二抗(1∶2000)室溫孵育1 h,1xTBST 洗膜3次,每次20 min。曝光,顯影并定影。
1.4 統計學方法 用SPSS17.0統計軟件進行數據分析。計量資料用均數±標準差(ˉx±s)表示,兩兩比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 臨床資料分析 10例HBV相關肝癌患者均為男性,平均年齡52.8歲(37~62歲),其中Child A級患者7例,Child B級患者3例。10例患者AFP(5836.15 ± 13633.06 ng/ml)、ALT(52.58 ± 41.27 U/L)、TBil(17.81 ± 6.96 μmol/L)、ALB(37.87 ±5.01 g/L)、PLT (116.70 ± 63.10 × 109/L)、PTA(86.70±11.24%)。乙肝兩對半檢測結果顯示,編號2患者HBsAg陽性、e抗原陽性、e抗體陽性、核心抗體陽性。編號10患者HBsAg陽性、核心抗體陽性。其余8例患者均為HBsAg陽性、e抗體陽性、核心抗體陽性。HBV DNA定量見表1所示。免疫組化檢測結果顯示,肝癌較癌旁組織MCT1表達升高,但MCT4無明顯改變,見表1、圖1。
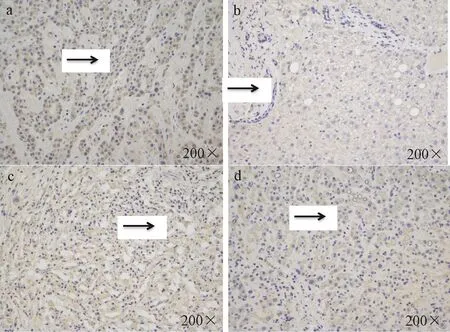
圖1 免疫組化檢測肝癌及癌旁組織中MCT1、MCT4表達Note: a.MCT1 expression n liver cancer tissues; b.MCT1 expression in adjacent tissues;c.MCT4 expression in liver cancer tissues;d.MCT4 expression in adjacent tissuesFig.1 Immunohistochemical detection of MCT1 and MCT4 expression in hepatocellular carcinoma and adjacent tissues
2.2 缺氧時間對HLE細胞HIF-1α的影響 在0.2%的氧濃度時,缺氧6 h,HLE細胞HIF-1α表達增加,在缺氧培養12 h時,HIF-1α達到表達高峰(P<0.05),之后表達量下降,見圖2。
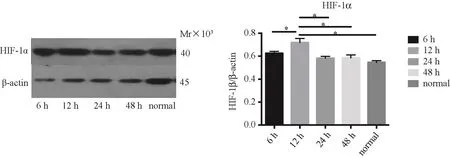
圖2 HLE細胞HIF-1α表達Fig.2 Expression of HIF-1αin HLE cells
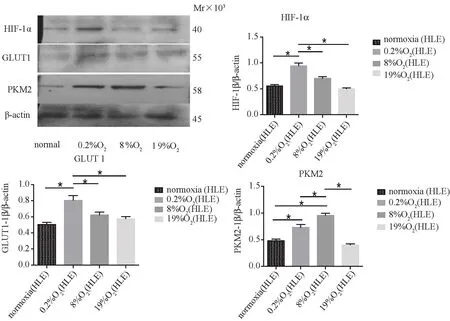
圖3 HLE 細胞 HIF-1α、GLUT1、PKM2 表達Fig.3 Expression of HIF-1α, GLUT1 and PKM2 in HLE cells
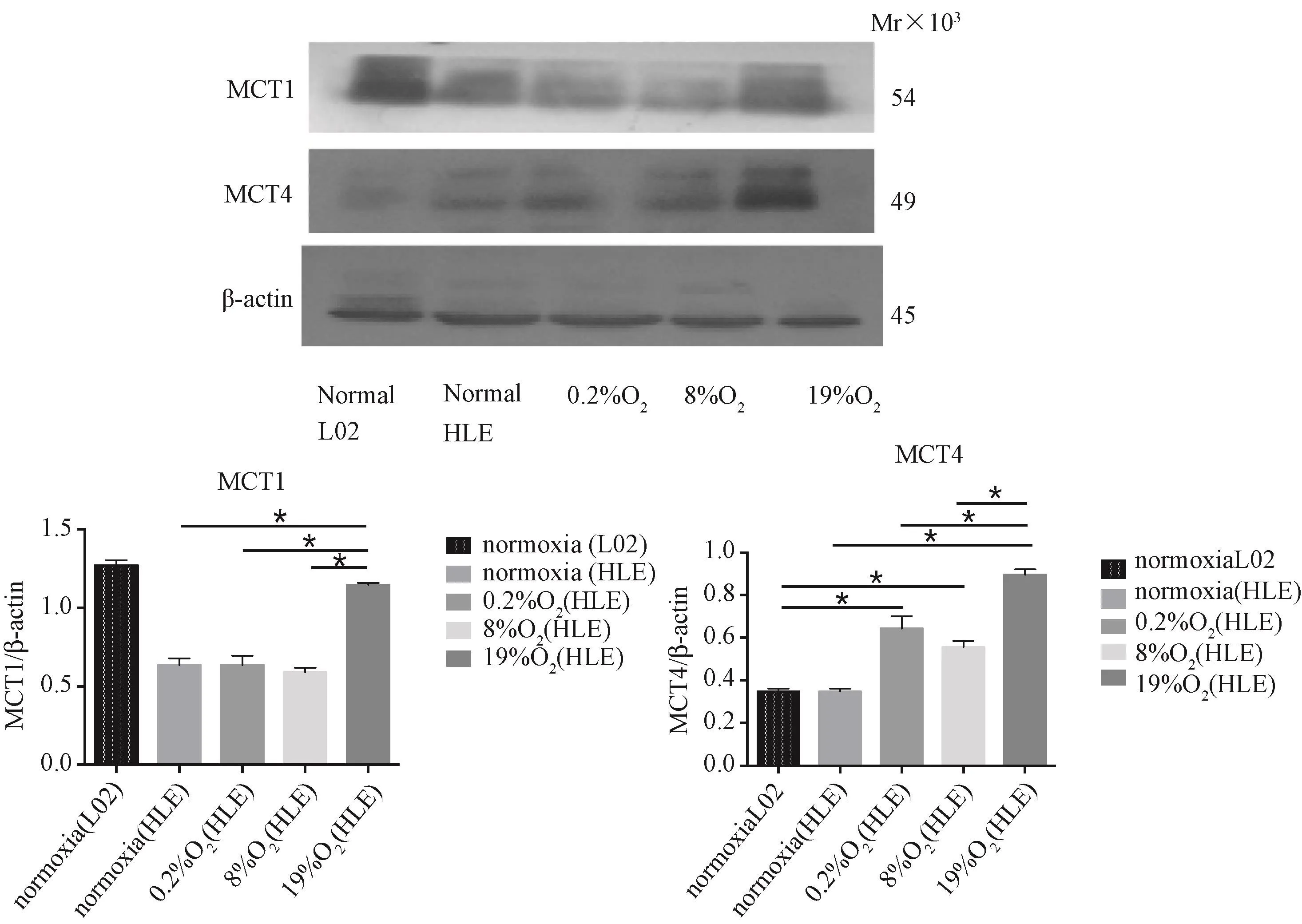
圖4 HLE細胞MCT1、MCT4表達Fig.4 Expression of MCT1、MCT4 in HLE cells
2.3 環境氧濃度梯度對HLE細胞HIF-1α及代謝的影響 如圖3所示,分別在0.2%、8%、19%氧濃度環境中,發現 HIF-1α、GLUT1在環境氧濃度為0.2%時表達較正常對照組以及其他氧濃度組顯著性升高(P<0.05),PKM2在環境氧濃度為8%時表達明顯高于正常對照組以及其他氧濃度組(P<0.05),差異具有統計學意義。
如圖4所示,代謝共生標志物MCT4在環境氧濃度為19%時,表達明顯高于正常對照組及其他氧濃度組(P<0.05),MCT1在環境氧濃度為19%時表達較正常對照組(L02)低,但明顯高于其他環境氧濃度下HLE細胞各組(P<0.05),差異均具有統計學意義。
3 討論
本研究發現MCT1主要在細胞膜上表達,HBV相關肝癌組織中MCT1表達明顯高于癌旁組織,但MCT4在癌及癌旁組織的細胞膜上表達并無明顯差異,這一結果與此前在乳腺癌、結直腸癌中的研究結果一致[10-11]。代謝共生理論認為,有氧糖酵解產生的乳酸可經MCT4排出后被MCT1攝取,在乳酸脫氫酶(lactate dehydrogenase,LDH)的作用下進一步轉化為丙酮酸,本課題中肝癌組織較癌旁組織MCT1高表達,盡管沒有統計學差異但提示肝癌組織存在著較高水平攝取乳酸的能力,它很可能將攝取的乳酸轉化為丙酮酸進入三羧酸循環,從而實現代謝共生。為此,本研究進一步在細胞水平對肝癌細胞的代謝進行研究。
本研究利用不同缺氧時間、不同環境氧濃度兩種處理,對肝癌HLE細胞進行培養,結果顯示,HIF-1α的表達在氧濃度為0.2%,缺氧培養12 h時顯著性升高。在0.2%氧濃度環境中培養12 h,HIF-1α、GLUT 1表達較其他組顯著性升高,說明缺氧刺激HLE細胞上調HIF-1α、GLUT1的表達,增加葡萄糖的攝取;PKM2的表達在氧濃度為0.2%時增加,氧濃度為8%時達高峰,表明近似無氧的條件下HLE細胞發生了有氧糖酵解,隨著氧濃度逐漸升高至8%,有氧糖酵解的發生也達到高峰。HIF-1α是細胞應對缺氧的感受器以及重要的轉錄因子,它可以上調GLUT1、己糖激酶、葡萄糖-6-磷酸脫氫酶、LDH和MCT4等,調節腫瘤細胞代謝。低氧環境和HRE/HIF-1α結合的復合物雙重調控可使GLUT1表達增高,增加葡萄糖的轉運。本研究中HIF-1α、GLUT 1與PKM2的表達在氧濃度為0.2%和8%時出現分離現象,可能由于有氧糖酵解的中間代謝產物可以通過磷酸戊糖、氨基酸及脂質合成等途徑進行生物合成代謝,為腫瘤提供蛋白質、脂肪及核酸,而脂肪酸和氨基酸的氧化代謝也可以在腫瘤細胞內產生ATP供能。因此,葡萄糖并非腫瘤細胞的唯一供能來源[12-13]。
以正常培養的L02細胞作為另一組對照,我們進一步檢測了腫瘤代謝共生標志物MCT1/4。HLE細胞在氧濃度為0.2%的缺氧條件下以及氧濃度為19%近似于常氧條件下高表達MCT4,在氧濃度為19%近似于常氧條件下高表達MCT1,這說明氧濃度水平對MCT1/4的表達存在調節作用,并進而影響肝癌細胞代謝。當環境氧濃度為19%時HLE細胞MCT1/4表達最高,此時有氧糖酵解關鍵酶PKM2并未隨著MCT1/4升高而表達增加。這從側面說明了PKM2在缺氧時參與了有氧糖酵解,而在近于常氧條件下乳酸轉運頻繁,肝癌HLE細胞優先進行代謝共生而不是有氧糖酵解。值得注意的是,HLE細胞MCT1在氧濃度為0.2%時與正常培養時表達量無明顯差異,這可能是由于正常培養時給予了HLE細胞充足的營養,供其抵抗能量消耗,因此MCT1沒有代償性升高,而氧濃度為0.2%時細胞處于幾乎無氧的條件下,不僅影響腫瘤細胞的功能,也影響其對異常代謝的代償能力。
本研究結果可以見到:HBV相關肝癌組織存在能量代謝異常;在近似于無氧環境或近似于常氧環境中,肝癌HLE細胞株并未優先選擇有氧糖酵解;在缺氧環境中,有氧糖酵解發生時并發代謝共生。提示我們不能僅僅局限于有氧糖酵解,代謝共生相關分子也可能存在著治療腫瘤的特異性靶點,通過阻斷腫瘤代謝促進腫瘤細胞凋亡,從而可以達到治療腫瘤的目的。

