胭脂紅褪色動力學實驗教學設計
林鄭忠, 歐光南, 王 力, 陳素艷
(集美大學 食品與生物工程學院, 福建 廈門 361021)
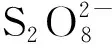
但該實驗也存在一些不足:反應物質混合后溶液渾濁,可能是K2S2O8和Ag+或Cr3+形成不溶物沉淀所致;吸光度變化范圍小,只有0.1~0.2;由于溶解有限,K2S2O8的濃度不是很高,只是Cr3+和Ag+濃度的5~10倍,而如果降低Cr3+的濃度又使吸光度降低,所以K2S2O8難以達到真正意義上的大大過量。這些不足降低了測量數據的準確性,而且Cr3+及其反應產物具有很強的毒性,Ag+價格昂貴,另外該實驗的化學特色過于明顯,與其他專業的相關性不大,難以調動學生的學習積極性。
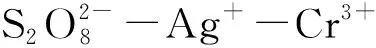
1 實驗部分
(1) 儀器和試劑。紫外可見分光光度計(UV 5500),1 cm比色皿,25 mL比色管,移液管(2 m,10 mL)、燒杯、計時器、滴管。胭脂紅,K2S2O8,FeSO4·7H2O,均為分析純,來自國藥集團化學試劑有限公司,所有用水均為普通蒸餾水。
(2) 溶液的配制。配制胭脂紅水溶液(1.118 mg·mL-1, 1.86×10-3mol·L-1),K2S2O8溶液(13.67 mg·mL-1, 0.051 mol·L-1),FeSO4溶液(3.269 mg·mL-1, 0.021 5 mol·L-1),為了保持Fe2+穩定性,配制時加入少量H2SO4。
(3) 色素吸收曲線的測定及工作波長的確定。在比色管中移入0.50 mL 胭脂紅溶液,加入蒸餾水定容至25 mL,充分搖勻混合,潤洗比色皿(厚度的選擇應盡量使所有吸光度讀數在0.1~0.7范圍內)3次,測定胭脂紅溶液在460—550 nm范圍內的吸收曲線,確定胭脂紅工作波長。
(4) 胭脂紅標準曲線和摩爾吸光系數的測定。在比色管中分別加入0.00,0.10,0.20,0.40,0.60,0.80 mL 胭脂紅溶液,定容到25 mL,在胭脂紅工作波長下測吸光度,繪制標準曲線,求出摩爾吸光系數。
(5) 動力學測試方法。往比色管中按順序加入一定量的K2S2O8溶液、FeSO4溶液和胭脂紅水溶液,用水定容到25 mL,快速搖勻,并立刻計時。在胭脂紅工作波長下,每隔一段時間測試吸光度,計算動力學參數。
2 結果和討論
2.1 胭脂紅的吸收曲線和標準曲線
胭脂紅的吸收曲線如圖1左所示。可知胭脂紅溶液的最大吸收波長為510 nm。后續實驗都固定在此波長下進行。摩爾消光系數為26.93 L·g-1·cm-1或1.63×104L·mol-1·cm-1。胭脂紅水溶液標準曲線如圖1右所示,擬合結果線性很好(r2=0.999 2)。
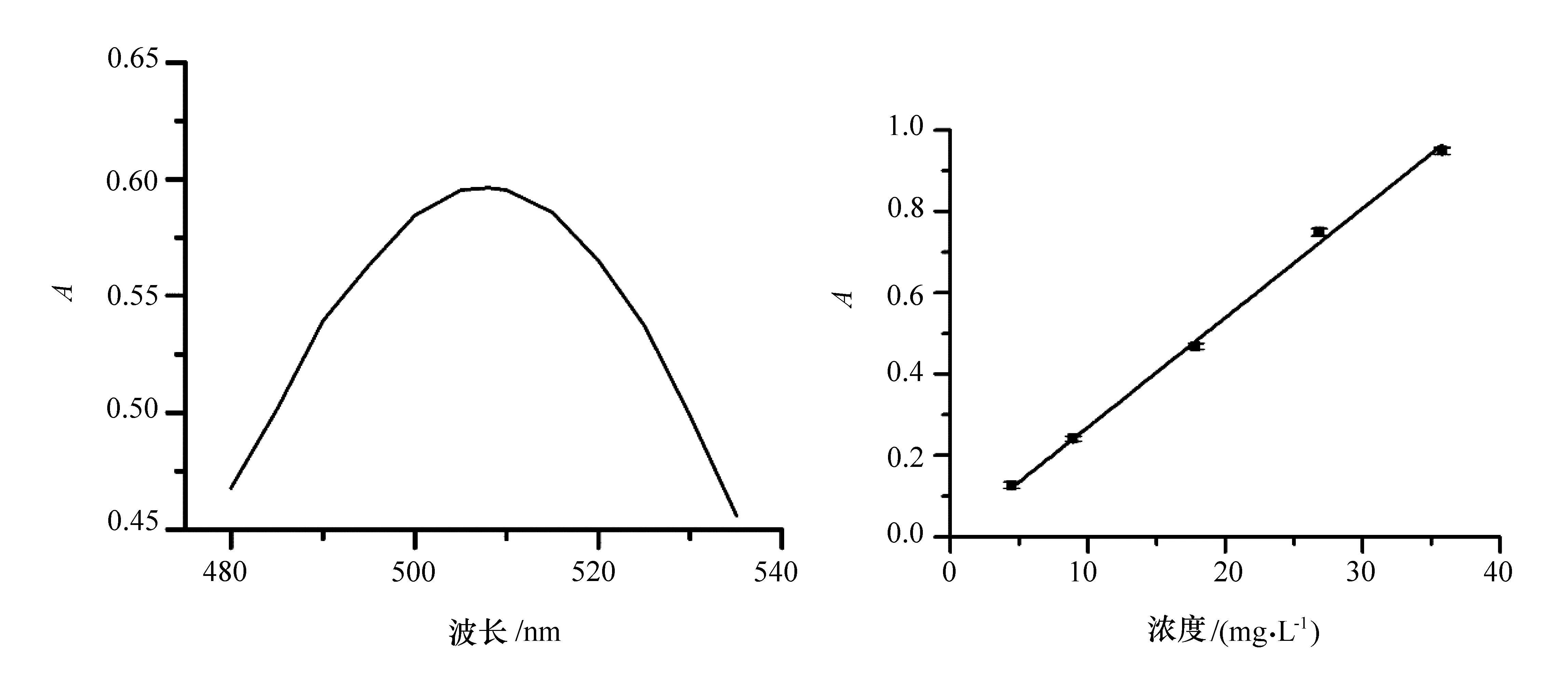
圖1 胭脂紅水溶液的吸收光譜(0.5 mL儲備液定容到25 mL)和線性關系
2.2 實驗原理
Fe2+在常溫常壓可活化過硫酸鹽,產生硫酸根自由基氧化分解有機物,在常溫下即可進行,不需外加光源[7-11]。反應如下:
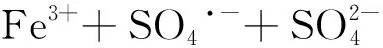
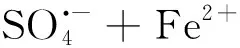
綜合可得二價鐵離子活化過硫酸鹽反應式為
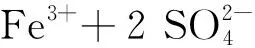
Fe3+離子經過一系列反應,又轉化成Fe2+離子。
胭脂紅的耐光性和耐氧化性較好,在自然條件下降解緩慢,因此可以排除這兩者的干擾,即胭脂紅都是在FeSO4催化作用下被K2S2O8降解的。催化降解反應符合以下動力學方程:
v=k[K2S2O8]n1[FeSO4]n2[L]n3
(1)
其中v為反應速率(mol·L-1·min-1);k為速率常數(單位根據級數變化,若是1級則為min-1);n1,n2, n3為各物質的級數(一般情況下為整數,無單位);L表示胭脂紅。
2.3 反應速率的測定
根據物理化學實驗教材[1-4],v=-d[L]/dt(本來還應除以L的反應計量數,但為了便于計算和討論,這里將其并入速率常數k中)。L的濃度可由Lambert-Beer定律計算,即A=εcl。A為吸光度(無單位),ε為摩爾消光系數(L·mol-1·cm-1),c為L的濃度(mol·L-1),l為比色池厚度(本實驗中l=1 cm)。代入定律則v=-d[L]/dt=-dA/dt(εl)-1。每隔一段時間測量A,根據A-t曲線的在t時刻的斜率(d[L]/dt)就能計算反應速率。
2.4 反應級數的確定
此反應體系中,K2S2O8相對胭脂紅大大過量,FeSO4是催化劑,所以它們的濃度在反應時不變,即
v=k[K2S2O8]n1[FeSO4]n2[L]n3=
k[K2S2O8]0n1[FeSO4]0n2[L]n3
(2)
下標0表示初始濃度,因此反應速率v只與胭脂紅的濃度和級數有關。根據這個性質,設計了如表1所示的4份溶液進行反應。根據表1配制溶液,繪制每份溶液的A-t曲線,如圖2所示。4份溶液的A-t曲線并非直線,說明反應過程不是以恒定速率進行,即反應的級數非零級。
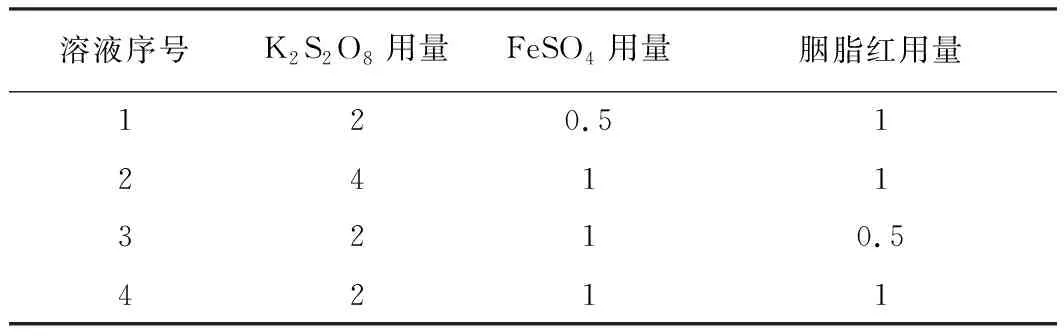
表1 反應溶液的配制 mL
注:每份溶液都用水定容到25 mL。
采取嘗試法求級數。假設反應的級數為1級,那么吸光度曲線滿足A=A0e-kt。將測得的A-t數據按照此曲線非線性擬合。其中A0為初始吸光度,應該等于等量胭脂紅定容到25 mL時的吸光度,因此擬合時固定溶液1,2,4的A0為1.20,溶液3的A0為0.60。擬合的結果如表2所示。4份溶液的A-t曲線與1級動力學方程的匹配程度很高(見圖2),r2都在0.99以上,說明反應的級數為1級。也嘗試了2級,2級反應的吸光度曲線滿足A=(kt+1/A0)-1。擬合時同樣按照以上方式固定A0,但擬合可信度很差,r2都在0.8以下。
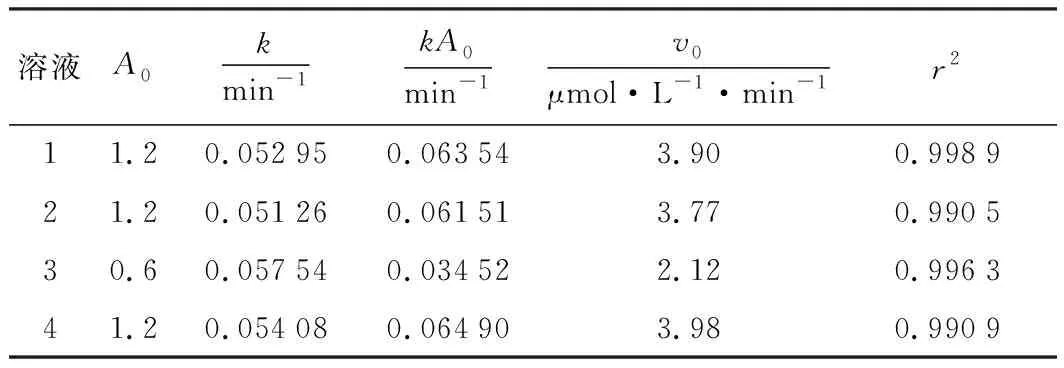
表2 反應溶液動力學數據的擬合結果
注:v0=-dA/dt(εl)-1=kA0(εl)-1
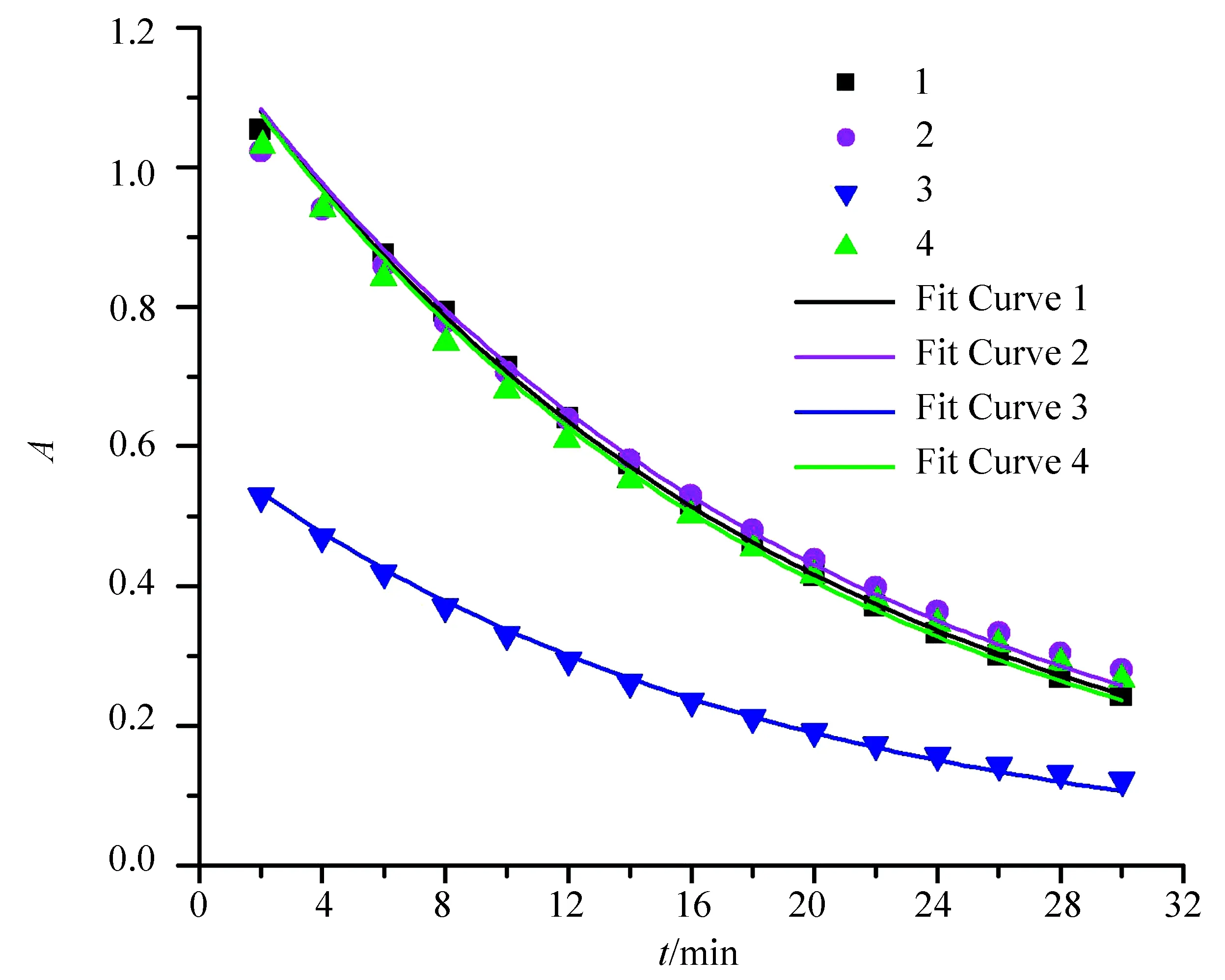
圖2 4份溶液的動力學散點圖和相應的1級速率方程擬合線
為了進一步測定每種反應物的級數,采用和傳統方案一樣的對消法,以測定K2S2O8的級數為例,保持2次實驗中FeSO4和胭脂紅的初始濃度相同,只改變K2S2O8的初始濃度,即表1中的溶液2和4,由式(2)可得:
v4/v2=(d[L]4/dt)/(d[L]2/dt)=
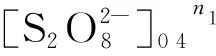
(3)
下標4和2表示第4和第2份溶液,將式(3)兩邊取對數并移項整理后得到:
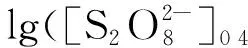
(4)
每份溶液的反應速率都是變化的,所以v4和v2在每個時刻都有不同的數值,為了便于計算,采用初速率法,即用t=0時的反應速率進行計算。對速率方程A=A0e-kt進行微分,得到dA/dt=-kA0e-kt。在t=0時,dA/dt=kA0。根據擬合結果計算kA0,并列于表2中。因此
v4/v2=(d[L]4/dt)/(d[L]2/dt)=
(dA4/dt)/(dA2/dt)=(kA0)4/(kA0)2
(5)
據此算出n1=0.030,即K2S2O8的級數為0級。
同理由溶液4和1可求出FeSO4級數,為-0.08,可看成0,由溶液4和3可求出胭脂紅級數,為0.91,可看成1。3個級數相加結果近似為1,再次印證了反應級數為1級,也說明了采用初速率法處理數據是可行的。
3 實驗方案設計和實際實施效果
根據以上結果,設計了實驗教學方案和數據處理方法:
(1) 在460—550 nm范圍內掃描胭脂紅溶液的吸收曲線,確定最大吸收波長。
(2) 分別加入0~0.8 mL的胭脂紅溶液,并定容到25 mL,測試標準曲線。
(3) 按照表1配制4份反應溶液,每隔一段時間,比如2 min,分別測試4份溶液的吸光度,測試時間約30 min。
(4) 用A=A0e-kt函數分別對4條A-t曲線擬合。由于每組學生用的比色皿和儀器不同,測得的結果不同,所以在擬合前應按照自己的標準曲線(1 mL時的吸光度)計算A0,擬合時固定A0求出k。并計算kA0和v0。
(5) 根據公式(4)計算n1,n2,n3。
制定了衡量學生實驗結果的標準:
(1) 最大吸收波長應在510 nm附近,正負不超過10 nm。
(2) 標準曲線r2應該在0.99以上。
(3)A-t曲線擬合后,r2應該在0.90以上。
(4)n1范圍在-0.3~0.3之間;n2范圍在-0.3~0.3之間;n3范圍在0.7~1.3之間。
(5)k和v0值不作為評判標準,因為k值影響因素較多,如溫度、比色皿不同等。
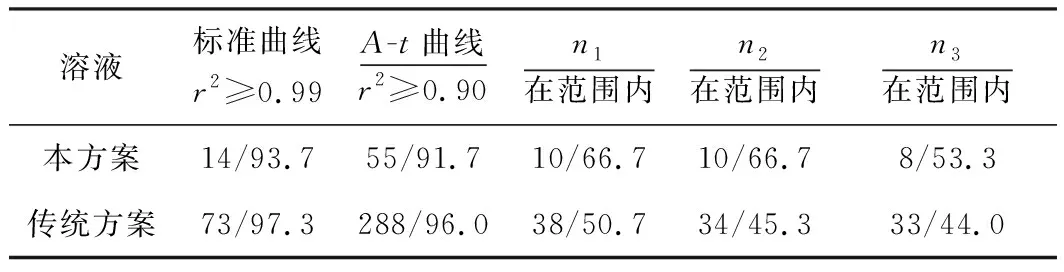
表3 學生完成兩種實驗的結果對比
2種實驗方案的特性如表4所示。本方案中每份溶液最多只需要測量30 min,溶液即基本褪色完全,而傳統方案需要40 min或更長時間才能使前后吸光度變動0.2以上,耗時長;本方案試劑和反應產物毒性很低,試劑的價格低,傳統方案用到高毒性的Cr3+和昂貴的AgNO3試劑,因此本方案更加環保經濟;2種方案都可以實現可視化,本方案在反應過程中溶液是澄清透明的,而傳統方案在反應時呈現渾濁,如圖3所示;本方案吸光度變化可達到0.6以上,測量結果較準確,傳統方案由于Cr3+的摩爾消光系數低,吸光度變化只能達到0.2左右;傳統方案反應速率近似恒定,所以數據處理過程比較簡單,而本方案反應速率非恒定,數據處理和分析過程比較復雜,需要學生掌握專業軟件如Origin的非線性擬合操作方法,這有利于擴寬學生的知識面、提高學生數據處理和分析的能力;該實驗與食品與生物工程環境專業有很強關聯性,容易激發學生的學習積極性和主動性;從傳統方案轉到本方案只需要更換2種試劑,不需要額外添加器材,容易轉型。綜上所述,本方案具有諸多優點,可以在教學中進一步推廣和普及。

表4 2種實驗方案特性對比

圖3 反應一段時間后,本方案(左)和傳統方案(右)的溶液外觀圖

