電感耦合等離子體發射光譜定量分析的節樣省時探索
孫曉玉, 宋曉紅, 劉雅瓊,2, 楊思宇, 李月琪, 趙倩倩, 王京宇,2
(1. 北京大學 公共衛生學院, 北京 100191; 2. 北京大學 醫藥衛生分析中心, 北京 100191; 3. 島津企業管理(中國)有限公司北京分析中心, 北京 100020)
如何高效利用血清進行多元素定量分析已成為分析檢測領域一個重要的課題[1]。生命科學的研究已進入多組學時代,金屬組學、基因組學、代謝組學等研究都需消耗較多血液樣品[2]。然而研究中收集的血清樣品量通常十分有限,若進行常規金屬組學元素分析就消耗較多的血清樣品,將會限制血清多組學同步研究。
微波消解已廣泛應用于樣品前處理,但血清樣品中元素含量較低,微波消解過程會引入外來元素污染及易揮發元素損失,且操作成本高,不適于大規模樣品檢測[3]。相關研究表明,采用直接稀釋法對血清樣品進行前處理可滿足檢測需求,但需選擇合適的稀釋倍數以減少基體干擾[4]。電感耦合等離子體發射光譜儀(ICP-OES)進行常規樣品分析時,較多的待測液浪費在浸潤管路,只有小部分待測液產生的信號真正被檢測器收集[5]。
本實驗通過優化ICP-OES血清多元素定量分析過程中前處理方法、信號采集延遲時間和采樣留置時間等,提高樣品使用效率。
1 實驗設備及試劑
主要設備:ICP-OES:日本島津公司(Shimadzu),ICPE 9800。
主要試劑:
單元素標準溶液有Na、S、P、K、Ca、Fe、Mg、Zn、Cu、Y。
質量控制標準物質:Trace Elements Serum L-1,挪威SERO公司,REF:201405,LOT:1309438。
2 實驗方法
2.1 ICP-OES工作條件
ICP-OES2工作條件見表1。
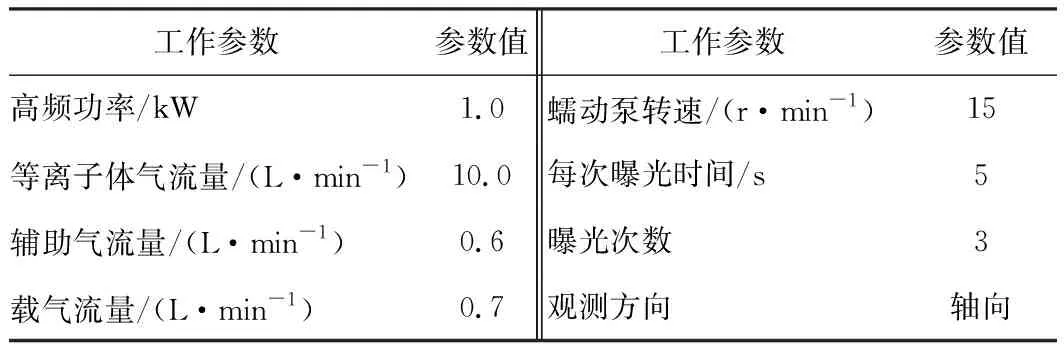
表1 ICP-OES工作條件
2.2 樣本
合作醫院體檢健康的成年人,空腹靜脈血離心所得血清,置-20 ℃冷藏備用。本實驗經過北京大學倫理委員會審核批準。
2.3 樣品前處理
用1% HNO3將血清直接稀釋10、20、40倍,制成不同濃度待測液,同時加入內標元素Y,內標質量濃度為200 μg/L。
2.4 確定最小進樣體積
(1) 確定信號采集延遲時間:將ICPE 9800信號采集延遲時間分別設置成14、16、18……32 s等,在不同信號采集延遲時間下分別檢測待測液。檢測過程中,儀器連續曝光3次,并分別報告3次曝光測定值。默認情況下,最終測定結果是3次曝光測定值的平均值。以K元素為參考元素,分析K元素3次曝光測定值隨信號采集延遲時間的變化趨勢,確定最佳信號采集延遲時間。
(2) 確定采樣留置時間:按照上一步結果設定信號采集延遲時間,進樣管置于待測液時開始測定。測定時將進樣管分別留置于待測液內10、12、14……28 s后取出置于清洗液中。以K元素為參考元素,分析K元素3次曝光測定值隨采樣留置時間的變化趨勢,確定最佳采樣留置時間。
(3) 確定最小取樣量:根據信號采集延遲時間和采樣留置時間確定血清最小取樣量。
2.5 建立標準曲線
根據血清中各待測元素的濃度,配制標準溶液,應用本研究所建方法測定標準溶液,建立各元素標準曲線。各元素標準溶液質量濃度見表2。
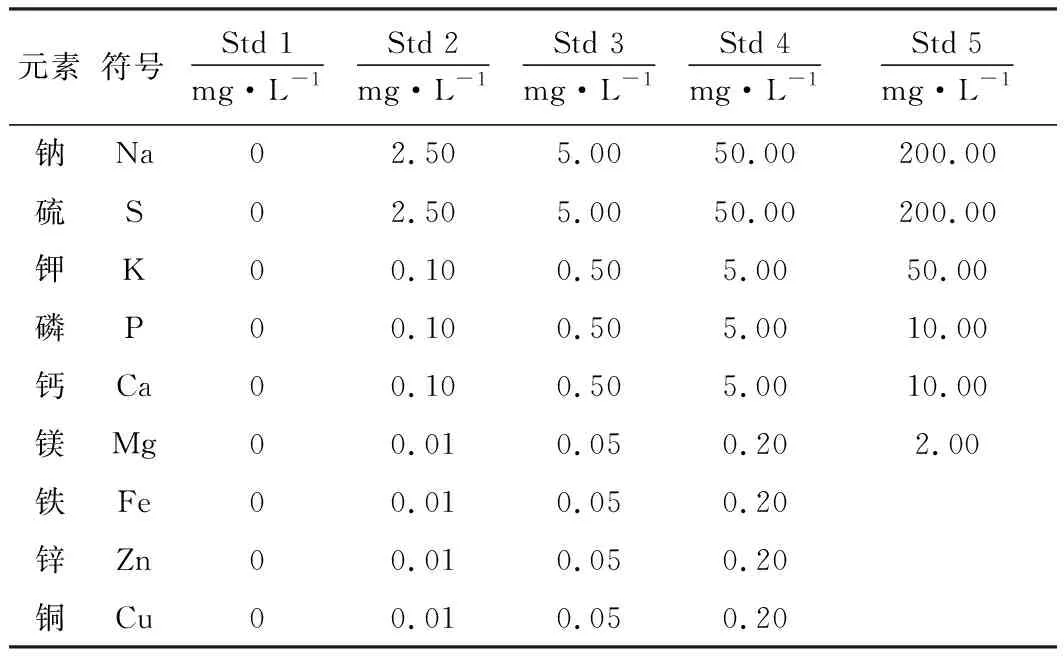
表2 標準曲線中各元素的質量濃度
3 實驗結果
3.1 血清前處理
測定不同稀釋倍數的血清樣品,結果表明血清樣品直接稀釋10倍和20倍時,精密度較差,稀釋40倍時精密度較好(見表3)。同時,稀釋10倍和20倍時易造成ICP-OES進樣系統堵塞及ICP火焰熄滅,稀釋40倍時則有效避免上述情況。因此,采用40倍直接稀釋進行血清樣品前處理。
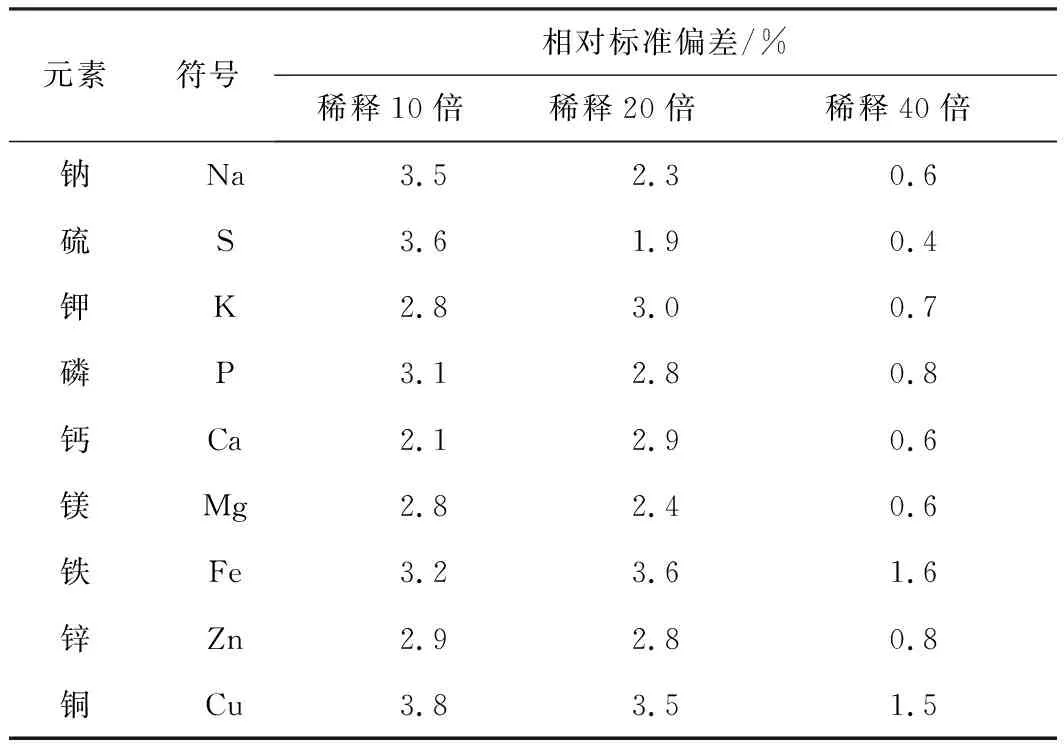
表3 不同稀釋倍數下各元素精密度(n=10)
3.2 信號采集延遲時間
不同信號采集延遲時間下K元素的信號強度見圖1。
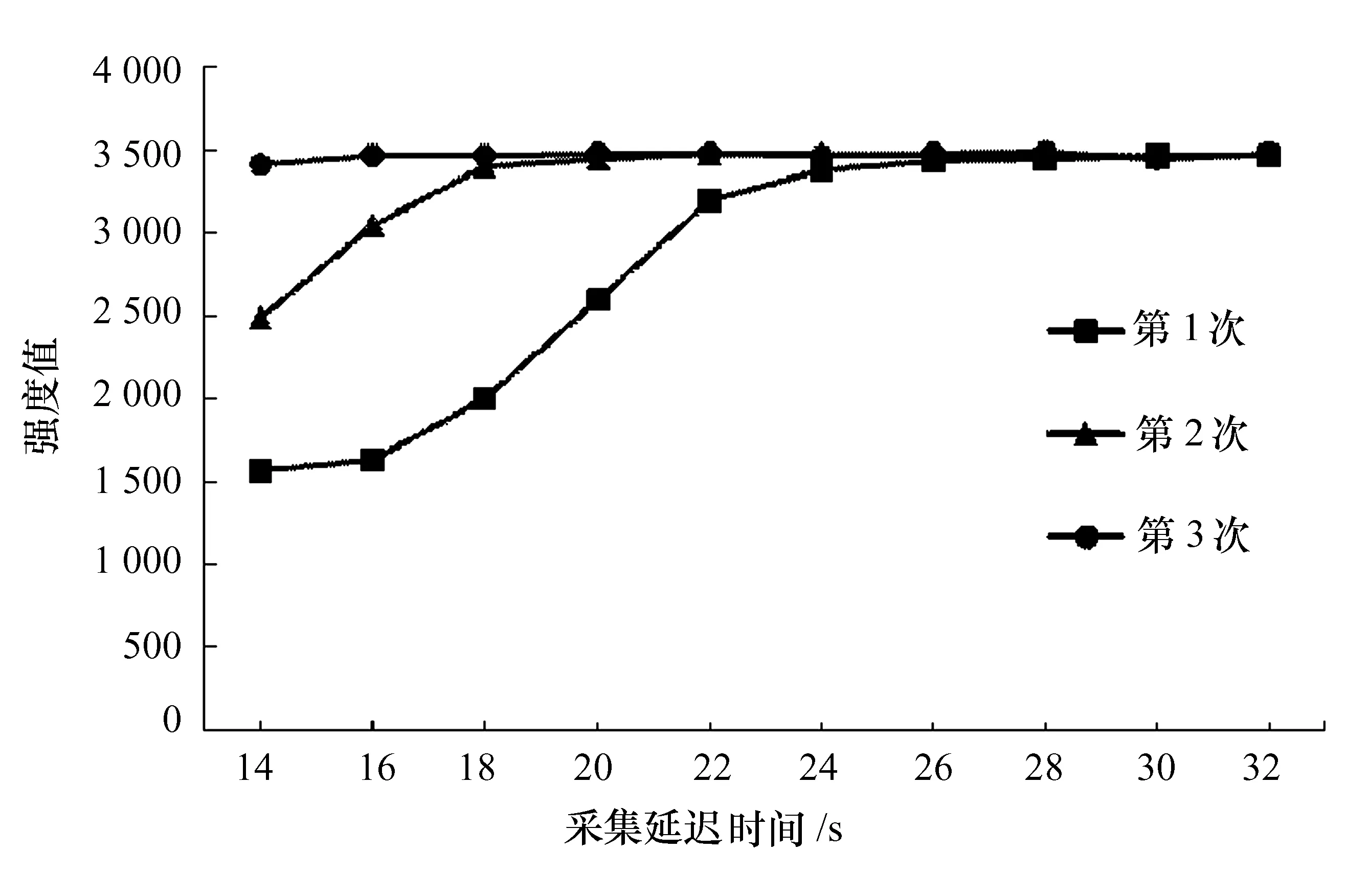
圖1 不同信號采集延遲時間下鉀元素的信號強度
由圖1可知:3次曝光測定值隨信號采集延長時間的增加變化不同,第1次曝光測定值在信號采集延遲時間為14~24 s內快速升高,26 s后達到穩定;第2次曝光測定值在信號采集延遲時間為14~18 s內快速升高,20 s后達到穩定;第3次曝光測定值在信號采集延遲時間為14~32 s內均保持穩定。
已知每次曝光時間為5 s,則3次曝光的信號采集時間為15 s。當信號采集延遲時間設置較短時,雖測定已開始,但血清待測液并未到達ICP火焰或其信號未達到平衡。因此,只有當血清待測液進入到ICP中且信號達到穩定時,檢測器才應采集信號。根據第1次曝光測定值的趨勢可知,信號采集延遲時間大于28 s時,3次曝光所采集的信號均為血清待測液的穩定信號。因此,將最佳信號采集延遲時間定為28 s。
3.3 采樣留置時間
不同采樣留置時間下K元素的信號強度見圖2。
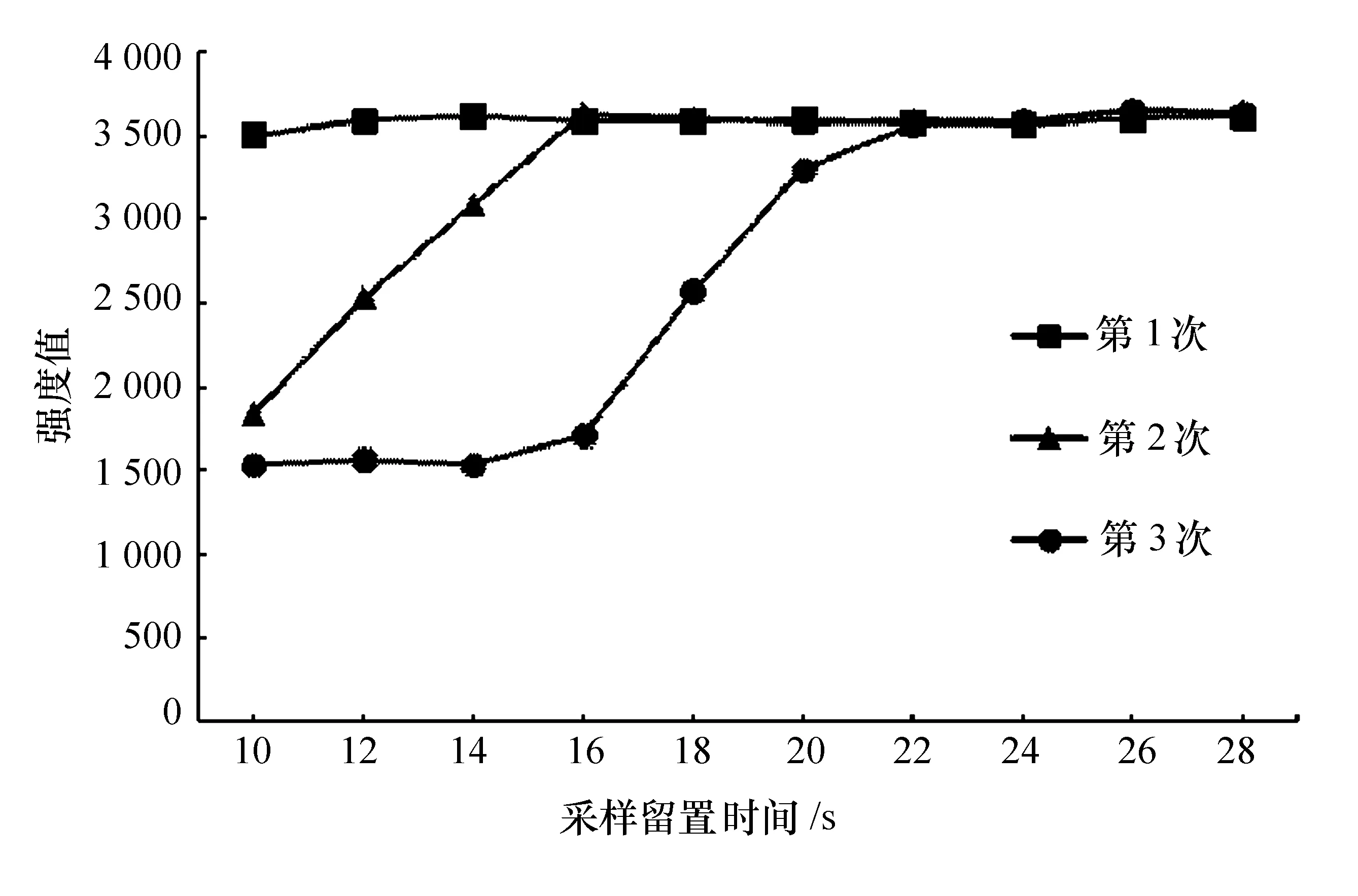
圖2 不同采樣留置時間下鉀元素的信號強度
由圖2可知:3次曝光測定值隨采樣留置時間的增加變化不同,第1次曝光測定值在10~28 s內均保持穩定;第2次曝光測定值在10~16 s內快速升高,之后達到穩定;第3次曝光測定值在10~14 s內保持在1 550左右,14~22 s內快速升高,之后達到穩定。
當采樣留置時間較短時,進入到儀器內的待測液無法滿足3次曝光所需體積。根據第3次曝光測定值的趨勢可知,當采樣留置時間大于24 s時,3次曝光所采集的信號均為血清待測液的穩定信號。因此,將最佳采樣留置時間定為24 s。
3.4 最小進樣量
將進樣管插入某一血清稀釋液內,記錄10 min內血清稀釋液消耗體積。結果可知,10 min約消耗11.8 mL血清稀釋液,則每秒消耗約20 μL血清稀釋液。由采樣留置時間為24 s可知,完成一次檢測約需0.48 mL血清稀釋液,即12μL血清原液。鑒于進樣過程中有部分待測液會殘留在進樣管或EP管中,故在實際操作中取15 μL血清于EP管中,用1% HNO3稀釋40倍至0.60 mL待測。
3.5 進樣系統清洗時間
采用本研究所建方法進行測定,調整清洗時間為10、15、20 s,觀察清洗效果發現,清洗15 s以上時,信號已回到基線水平。
3.6 標準曲線線性
各元素的標準曲線方程及相關系數見表4。
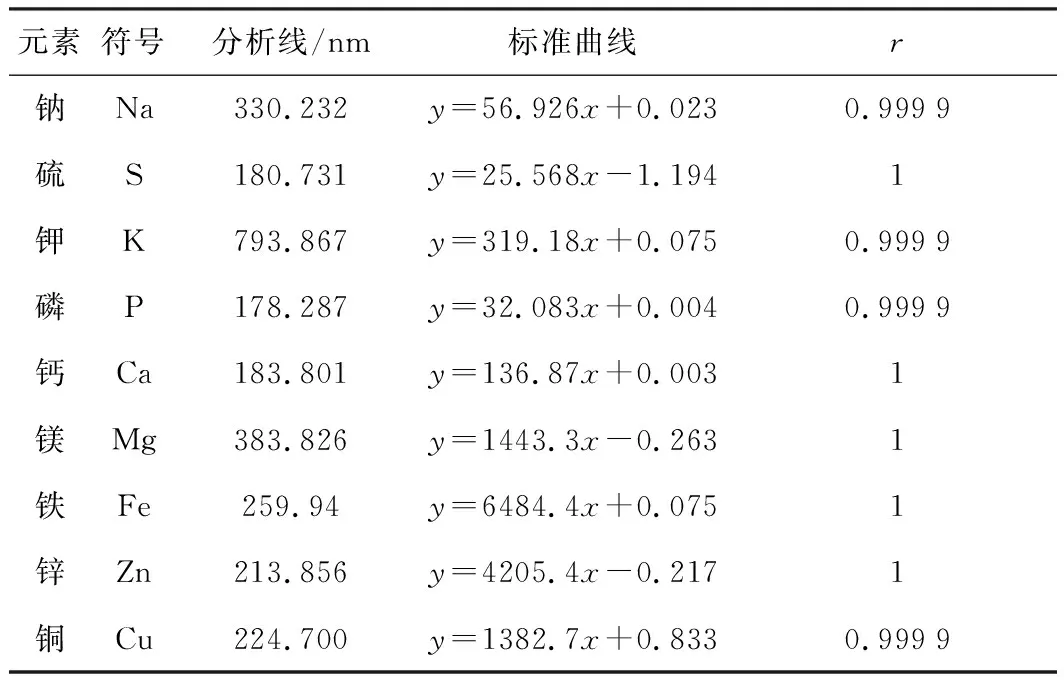
表4 各元素標準曲線方程及相關系數r
3.7 檢測限和方法精密度
在最佳實驗條件下連續測定11份空白溶液,以11次空白值的3倍標準偏差對應濃度為各元素的檢出限,10倍標準偏差對應濃度為定量下限(見表5)。

表5 各元素檢出限與定量下限
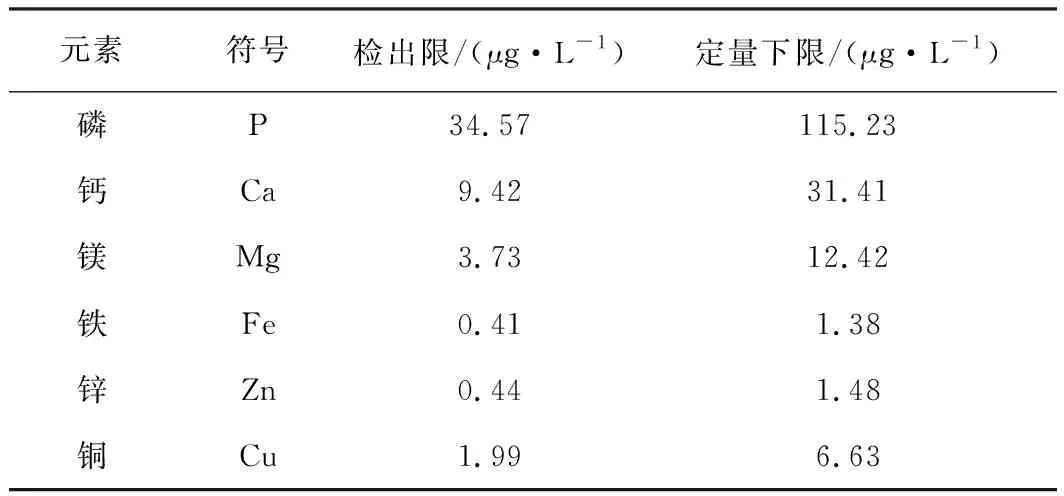
表5(續)
應用該方法對相同血清樣品進行6次獨立測定,計算測定結果的相對標準偏差得到日內精密度;應用該方法對相同的血清樣品連續測定6 d,計算測定結果的相對標準偏差得到日間精密度,結果見表6。
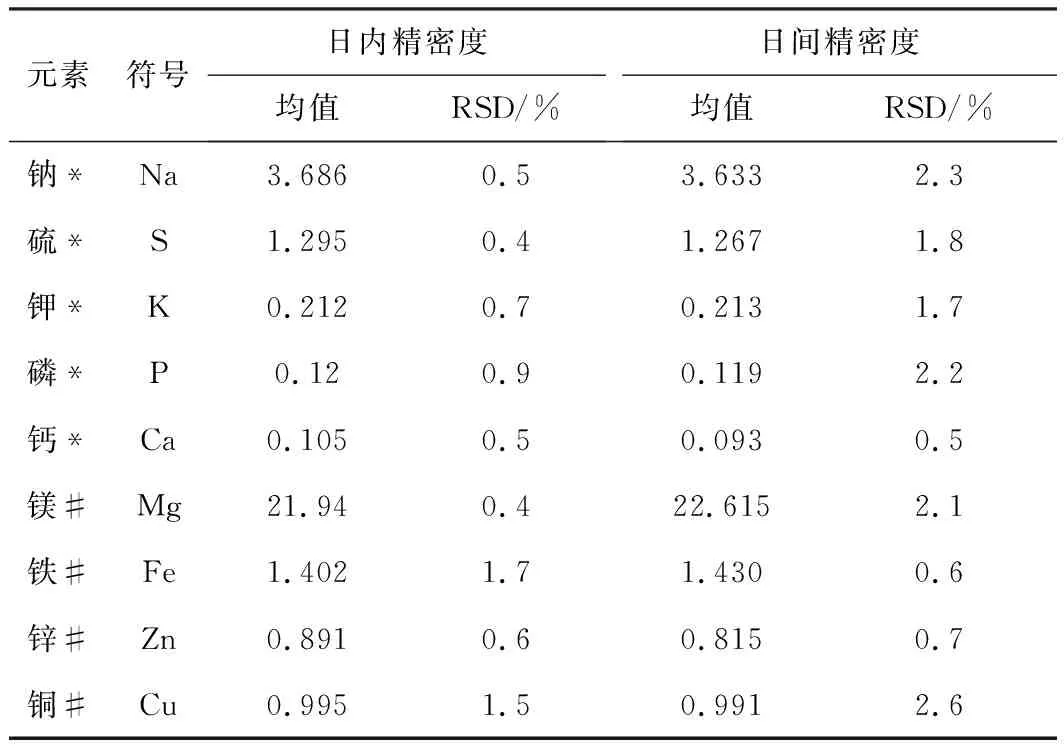
表6 各元素精密度(n=6)
注:*均值單位:mg/L,#均值單位:μg/L。
從表6可知,Na、S、K、P、Ca、Mg、Fe、Cu和Zn元素的日內精密度RSD均小于2%,日間精密度RSD均小于3%。
3.8 加標回收率
加標回收實驗是在測定樣品的同時,于某一樣品的子樣中加入一定量的標準物質并進行測定,將其測定結果扣除樣品的測定值。得到加標回收率見表7。
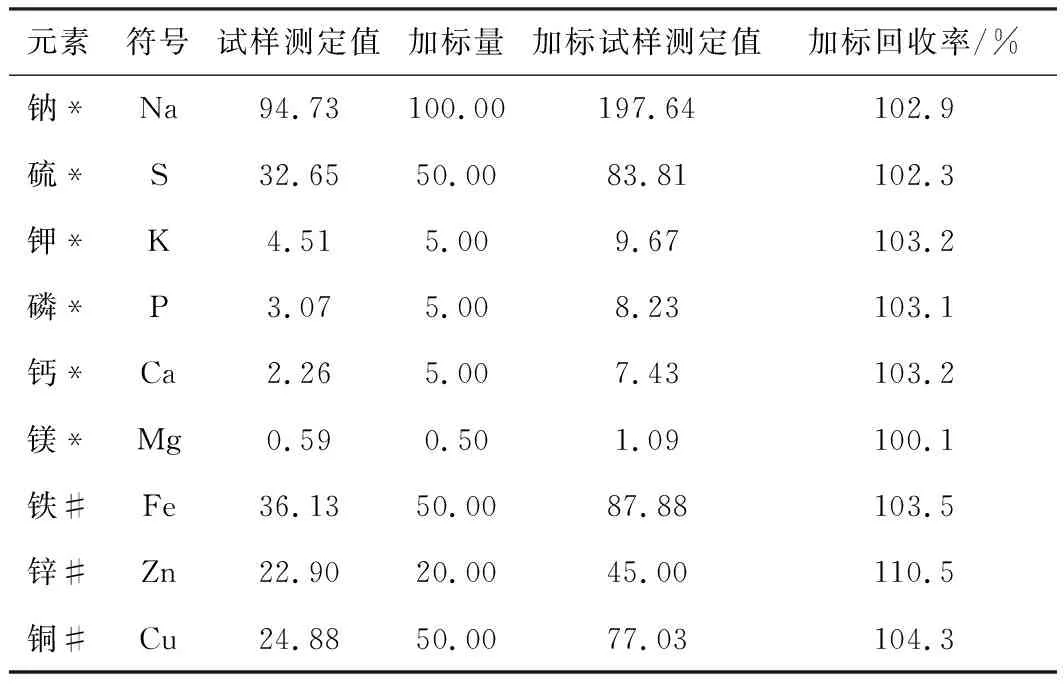
表7 各元素加標回收率(n=6)
注:*測定值、加標量和加標試樣測定值單位:mg/L,#測定值、加標量和加標試樣測定值單位:μg/L。
由表7可知,Na、S、K、P、Ca、Mg、Fe和Cu元素的加標回收率均在100.0%~105.0%之間,Zn元素的加標回收率均為110.5%。
3.9 血清標準物質檢測
人血清標準物質測定結果見表8。
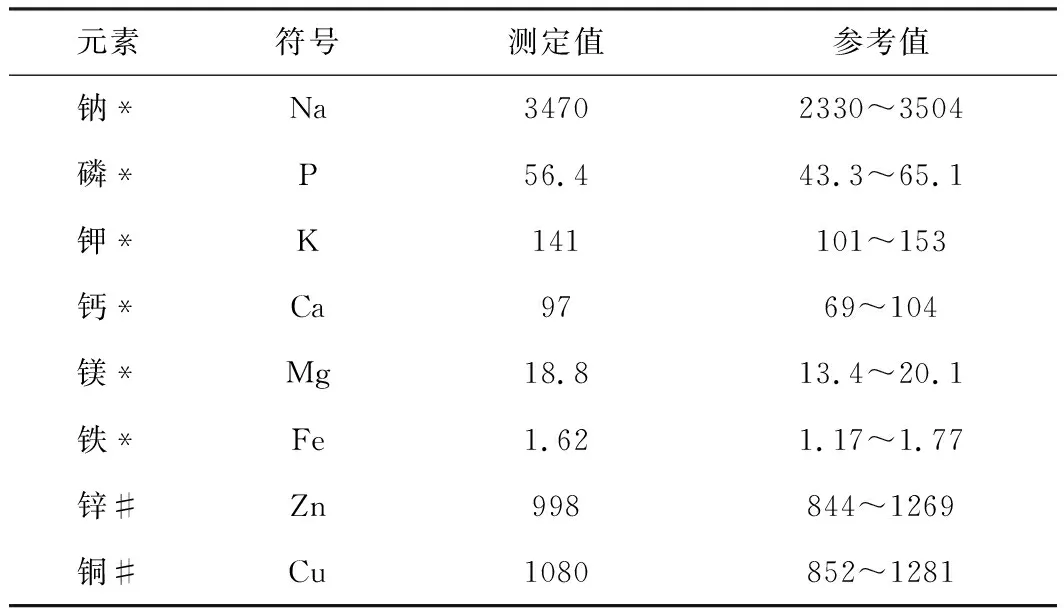
表8 血清標準物質測定結果(n=6)
注:*測定值和參考值單位:mg/L,#測定值和參考值單位:μg/L。
由表8可知,Na、P、K、Ca、Mg、Fe、Zn和Cu元素的人血清標準物質測定值都在參考值范圍內,該人血清標準物質不含S元素。
4 討論
任何樣品在進行檢測之前都需要經過一定的前處理,徐進力等[6]的研究表明,采用直接稀釋進行前處理時,如果稀釋倍數較低,則進樣系統易發生堵塞進而影響檢測結果的準確性;如果稀釋倍數過大,則又會因元素含量過低而達不到理想的靈敏度,其分析信號強度將顯著減弱,檢測結果會產生較大的誤差。稀釋倍數較低條件下,隨著檢測樣品數量的增加,無機鹽會沉積在炬管、霧化器和霧化室中,導致樣品測定值產生波動[7]。本研究的結果與上述一致,將血清直接稀釋10倍和20倍時,進樣系統易堵塞并導致ICP火焰熄火,且血清樣品在較低稀釋倍數下測定結果穩定性較差。因此本研究選用40倍稀釋是相對合理的血清稀釋倍數。當然,對于濃度較低的待測元素,在樣品數不多的前提下也可以采用10倍或者20倍稀釋,其相對標準偏差小于4%(參見表3)。
本研究所用儀器默認設置信號采集延遲時間為30 s,曝光時間每次30 s、清洗時間30 s,且需在待測液充滿管路后才能開始檢測過程,因此默認條件下測定一個樣品至少需150 s,而實際測定過程往往更長。本研究所建方法將信號采集時間與檢測時間相結合,利用浸潤管路的溶液進行測定,只需進樣24 s即可準確測定。此外,由于進樣體積減少,故只需15 s即可完成清洗過程。因此,采用本方法只需39 s即可完成一個檢測周期,相較默認方法節省80%的樣品消耗量和74%的檢測時間,且測定結果準確、可靠。
常規方法進行血清多元素分析時,往往需要0.2~0.5 mL血清才能完成一個樣品的測定[8-10]。李海龍等[11]進行血清中多種元素的電感耦合等離子體發射光譜法直接測定實驗時,提取0.4 mL血清,直接稀釋定容到10.0 mL后上機測定。李萌等[12]進行血清多元素分析時,取0.5 mL血清處理后定容到2.1 mL后上機測定。嚴海英等[13]利用微波消解測定疾病人群血清中的微量元素時,取1.0 mL血清,前處理后定容到10.0 mL上機測定。本研究建立的微量血清多元素定量分析方法僅需約15 μL血清,顯著減少了血清樣本消耗量,有望實現指血、足跟血、耳血中多元素定量分析和滿足嬰幼兒檢測需求。
5 結論
本研究采用直接稀釋的前處理方法,對ICP-OES進樣技術進行優化,建立了一種微量血清多元素定量分析的方法,測定了血清中Na、S、K、P、Ca、Mg、Fe、Zn和Cu元素的含量,并對該方法進行方法學評價。結果表明,該方法較默認方法節省80%的血清樣品和74%的檢測時間,且測定結果準確、可靠,提高了血清樣本利用效率,有利于多組學生同步研究的順利開展。

