腦膠質瘤組織NPAS2時鐘基因啟動子區甲基化與預后的關系
杜權 董曉巧 俞文華 朱強 車志豪 王昊 楊定博 沈永鋒 江力
腦膠質瘤是中樞神經系統常見的惡性腫瘤,其發病率高,預后不佳[1-3]。晝夜節律紊亂與腫瘤的發生、發展密切相關[4-5]。時鐘基因編碼的蛋白質可以調節晝夜節律[6-7]。研究表明,時鐘基因啟動子區甲基化可以改變目的基因表達狀態,從而影響腦膠質瘤的生長[8-10]。NPAS2時鐘基因屬于抑癌基因,其蛋白表達低水平與結直腸癌預后不良相關[11],也預示著腦膠質瘤患者生存期縮短[12]。NPAS2時鐘基因啟動子區甲基化可以降低基因相關蛋白表達,參與帕金森病的發生、發展[13]。本研究通過檢測腦膠質瘤NPAS2時鐘基因啟動子區甲基化狀態,進而分析其與患者臨床特征及預后的關系,現將結果報道如下。
1 對象和方法
1.1 對象 選取2005年6月至2010年6月本院行手術治療的102例初發腦膠質瘤患者為研究對象。其中男63例,女39例;年齡>60歲42例,≤60歲60例;WHO分級:Ⅰ~Ⅱ級49例,Ⅲ~Ⅳ級53例;腫瘤部位:幕上86例,幕下16例;腫瘤全切除72例;術后輔助化療56例;術后輔助放療77例;腫瘤類型:星形細胞瘤68例,其他34例;腫瘤直徑>5cm 32例,≤5cm 70例;術前卡氏評分(KPS)<80分60例,≥80分42例。所有患者均為漢族人,均未合并其他惡性腫瘤,其直系親屬均無膠質瘤病史。
1.2 指標檢測 術中獲取腦膠質瘤組織及癌旁正常組織,采用甲基化特異性PCR檢測NPAS2時鐘基因啟動子甲基化狀態。使用DNA組織提取試劑盒(規格250次,批號Z3105,美國Promega公司)提取基因組DNA,使用甲基化特異性PCR試劑盒(規格60次,批號EM101,美國Millipore公司)對基因組DNA進行亞硫酸氫鈉修飾,修飾后的DNA進行PCR擴增。時鐘基因的引物參照文獻[13],產物于4%瓊脂糖凝膠上進行電泳,在紫外儀下觀察并記錄結果。為了確定甲基化特異性PCR檢測結果,以甲基轉移酶處理的基因組DNA作為陽性對照,未經處理的基因組DNA作為陰性對照。
1.3 統計學處理 應用SPSS 19.0統計軟件。計數資料用率表示,組間比較采用χ2檢驗。利用Kaplan-Meier法繪制生存曲線并計算患者5年總生存期,生存期以表示,采用log-rank檢驗分析生存差異;采用Cox比例風險回歸模型分析影響5年總生存期的獨立危險因素。P<0.05為差異有統計學意義。
2 結果
2.1 腦膠質瘤組織與癌旁正常組織NPAS2時鐘基因啟動子區甲基化頻率比較 腦膠質瘤組織NPAS2時鐘基因啟動子區甲基化頻率為19.6%(20/102),與其癌旁正常組織甲基化頻率5.9%(6/102)比較,差異有統計學意義(χ2=8.64,P<0.05)。
2.2 腦膠質瘤組織NPAS2時鐘基因啟動子區甲基化狀態與臨床特征的關系 腦膠質瘤組織NPAS2時鐘基因啟動子區甲基化狀態與患者性別、年齡、腫瘤部位、腫瘤類型、腫瘤直徑、術前KPS、腫瘤全切除、術后輔助放化療等均無關(均P>0.05);但與WHO分級有關,Ⅲ~Ⅳ級腦膠質瘤組織NPAS2時鐘基因啟動子區甲基化頻率明顯高于Ⅰ~Ⅱ級腦膠質瘤組織,差異有統計學意義(P<0.05),見表 1。
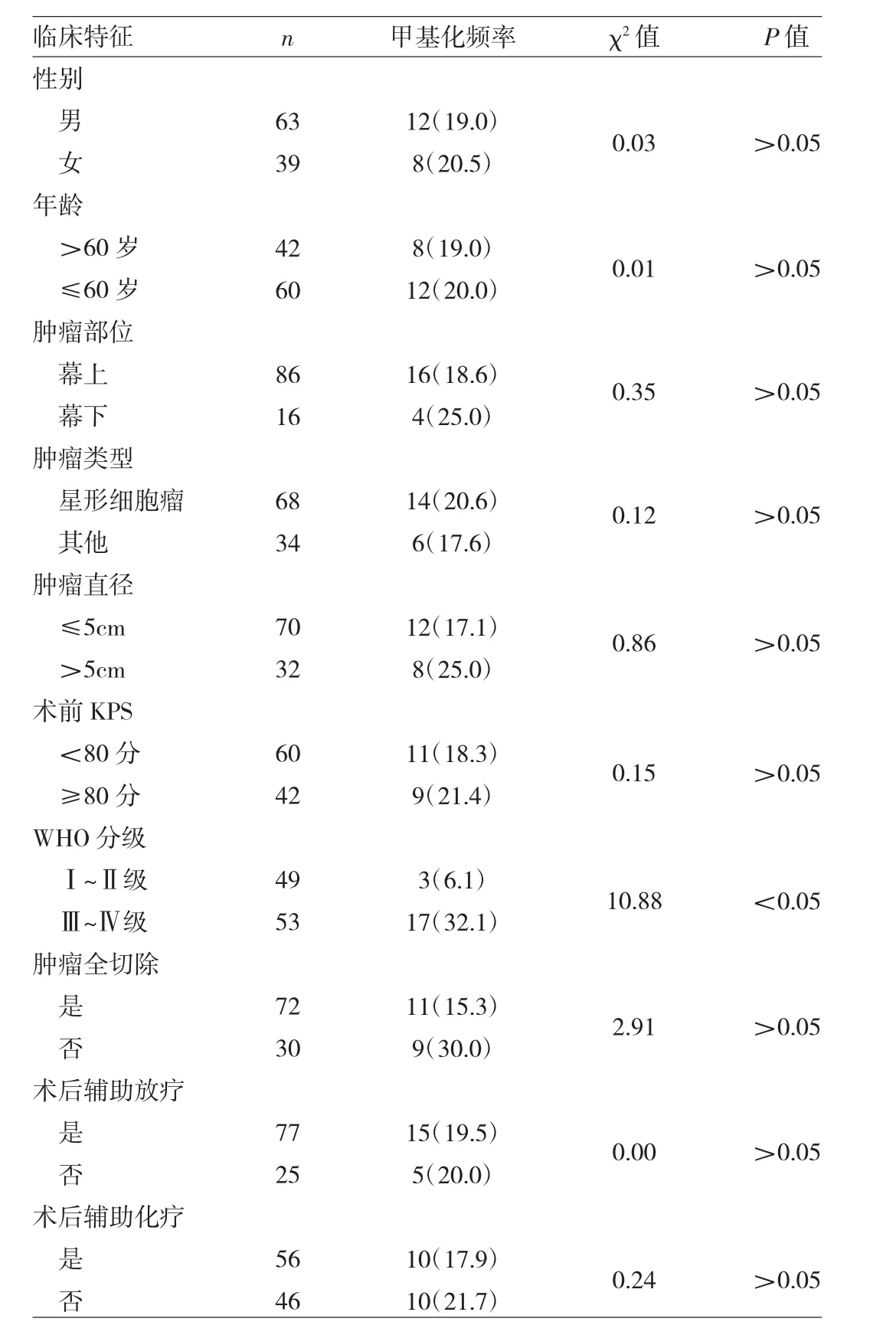
表1 腦膠質瘤組織NPAS2時鐘基因啟動子區甲基化狀態與臨床特征的關系[例(%)]
2.3 腦膠質瘤組織NPAS2時鐘基因啟動子區甲基化狀態與5年總生存期的關系 腦膠質瘤患者5年總生存期為(30.4±2.0)個月,生存曲線見圖1。患者5年總生存期與其腫瘤直徑、術前KPS、WHO分級、腫瘤全切除、術后輔助放化療、腦膠質瘤組織NPAS2時鐘基因啟動子區甲基化狀態均有關(均P<0.05),與性別、年齡、腫瘤部位、腫瘤類型均無關(均P>0.05),見表2。
2.4 影響5年總生存期的因素 經Cox比例風險回歸模型分析,腫瘤全切除與否(HR=0.585,95%CI:0.353~0.969,P<0.05)、腫瘤直徑(HR=1.970,95%CI:1.196~3.243,P<0.05)、WHO 分級(HR=1.786,95%CI:1.110~2.874,P<0.05)、腦膠質瘤組織NPAS2時鐘基因啟動子區甲基化狀態(HR=2.115,95%CI:1.223~3.656,P<0.05)是影響患者5年總生存期的獨立危險因素。
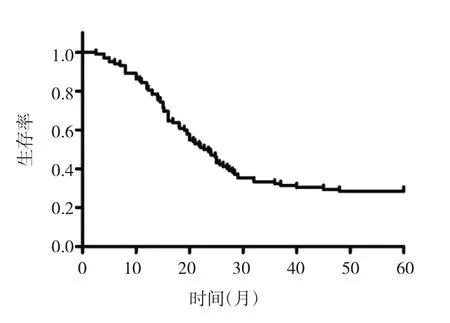
圖1 腦膠質瘤患者的生存曲線
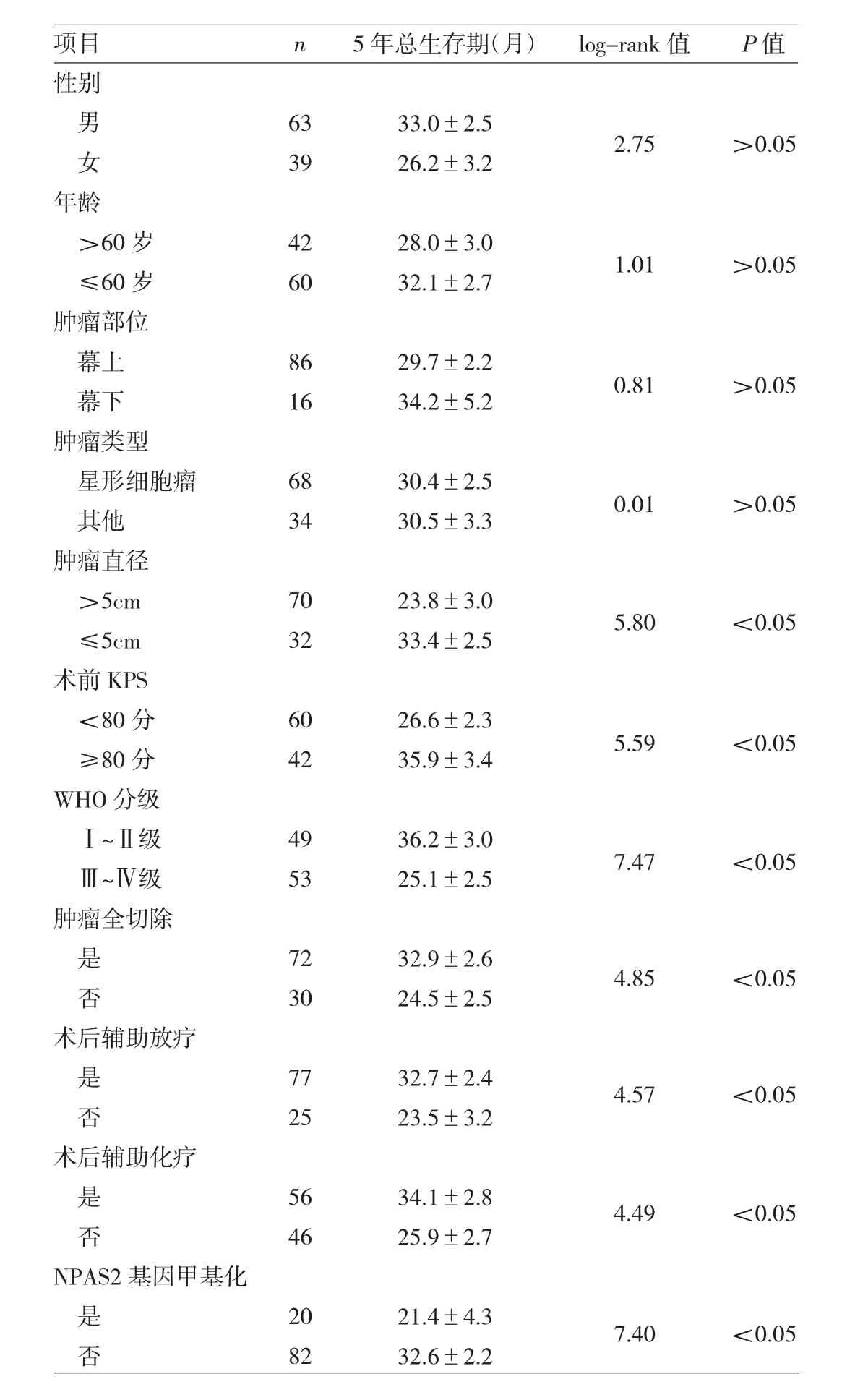
表2 腦膠質瘤患者5年總生存期比較
3 討論
晝夜節律是一種普遍的自然現象,它的存在使生物體的生理、生化、行為等生命現象表現為以24h為周期的振蕩。晝夜節律發生的物質基礎是分子計時器,即晝夜節律生物鐘。它是由一組特異的核心元件組成,包括Clock、Bmal1、Pers、Crys、Tim 等基因及其相關蛋白產物。生物節律的基本分子機制是這些核心元件構成的轉錄-翻譯負反饋環。這個機制本質上是內源性的,但同時會受環境信號的導引,尤其是光信號。哺乳動物的主生物鐘被定位在下丘腦視交叉上核,當它受到異常刺激后,機體的晝夜節律可發生改變,嚴重時會引發疾病。到目前為止,維持生物鐘運行的確切分子調控過程尚未清楚[4-7]。
腫瘤的發生、發展與晝夜節律系統的紊亂密切相關,時鐘基因可能通過復雜的網絡調節系統來影響腫瘤細胞的增生或凋亡[8-12]。基因啟動子區甲基化是時鐘基因蛋白表達功能改變的重要方式[13]。Per1、Per2、Cry1、Cry2、Clock、Bmal1和NPAS2等時鐘基因的甲基化與胃癌、肝癌和乳腺癌等惡性腫瘤的發生、發展密切相關[14-16]。關于時鐘基因甲基化的研究是目前腫瘤研究的熱點,明確某些時鐘基因的甲基化狀態有助于研究個體化的治療手段,從而提高惡性腫瘤的治愈率。
NPAS2是晝夜節律系統中重要的時鐘基因,是腫瘤抑制基因[11]。NPAS2蛋白可以抑制體外培養的癌細胞生長,NPAS2的表達水平與結直腸癌病理分級和預后密切相關[11]。高級別膠質瘤NPAS2表達明顯下降,NPAS2高表達膠質瘤患者生存期明顯延長[12]。本研究發現,膠質瘤組織和癌旁正常組織NPAS2基因啟動子區均有甲基化,而膠質瘤組織甲基化頻率明顯升高。本研究進一步分析發現,NPAS2時鐘基因啟動子區甲基化狀態與患者性別、年齡、腫瘤部位、腫瘤類型、腫瘤全切除、術后輔助放化療、腫瘤直徑、術前KPS等均無關,但與WHO分級有關,膠質瘤組織WHO分級越高,NPAS2時鐘基因啟動子區甲基化頻率越高。生存分析結果提示,除腫瘤全切除、WHO分級、腫瘤直徑外,NPAS2時鐘基因啟動子區甲基化也是影響腦膠質瘤患者5年總生存期的獨立危險因素。考慮原因是NPAS2時鐘基因啟動子區甲基化可能會使NPAS2蛋白表達減少,從而解除對腦膠質瘤生長的抑制,促進腦膠質瘤的發展,最終影響患者的臨床預后。
綜上所述,NPAS2時鐘基因啟動子區甲基化可能參與腦膠質瘤的發生、發展,其甲基化程度與腦膠質瘤惡性程度呈正相關,也是影響患者長期生存的危險因素。臨床檢測腦膠質瘤組織NPAS2時鐘基因啟動子區甲基化狀態,有利于分析和預測患者的臨床預后,同時協助腦膠質瘤惡性程度分級,指導臨床進一步治療。

