阿維A治療反應性穿通性膠原病二例并文獻復習
雷 娜 于 騰 付洪軍
1 臨床資料
1.1 一般資料 病例1,男,47歲。因雙下肢丘疹伴癢4個月就診。患者4個月前無明顯誘因雙下肢出現數個針頭大丘疹,瘙癢明顯。外用紅霉素軟膏,并行抗過敏治療,效果不佳。2個月前皮損累及軀干、上肢,部分丘疹出現臍凹,瘙癢劇烈,搔抓后出現破潰、結痂,少量滲出(圖1a)。外院診斷為“過敏性皮炎”,給予潑尼松(40 mg/d)及抗過敏治療,病情好轉,遂潑尼松減量,減至10 mg/d時,皮損加重,泛發全身。既往史:乙肝攜帶30年,無其他系統疾病,家族中無類似疾病患者。體格檢查:系統檢查未見異常。皮膚科查體:軀干四肢密集分布米粒至黃豆大棕褐色丘疹、斑丘疹,中心有臍凹,內含角質栓,呈火山口狀;左足背及右小腿內側為重。實驗室檢查:血尿便常規、肝腎功能、凝血四項無異常。皮膚組織病理:局部皮膚杯狀凹陷,內含角栓,真皮淺層及附屬器周圍大量淋巴細胞及少量嗜酸粒細胞浸潤(圖2a)。Masson染色:可見膠原纖維經表皮穿出(圖2b)。診斷:獲得性反應性穿通性膠原病。
病例2,男,30歲。因雙下肢丘疹伴癢2個月就診。患者2個月前無明顯誘因雙小腿出現多個針頭大丘疹,正常皮色,而后逐漸擴大,直徑達5~6 mm,中心有臍凹,充填角化性物質,瘙癢劇烈(圖1c)。1個月前在雙臀外側、雙肘外側出現類似皮損。自行外用玉膚霜,無明顯效果,來我院就診。既往史:體健,無糖尿病病史及其他疾病史,家族中無類似疾病。體檢:系統檢查無異常。皮膚科查體:四肢散在粟粒大膚色角化性丘疹,中心有臍凹,小腿伸側為重。實驗室檢查:血尿便常規無異常、肝腎功、血糖血脂、凝血四項、乙肝表面抗體無異常。組織病理示:表皮杯狀下陷,凹陷底部表皮變薄,真皮淺深層血管及附屬器周圍淋巴細胞、漿細胞浸潤(圖2c)。Masson染色:可見膠原纖維穿通表皮(圖2d)。診斷:獲得性反應性穿通性膠原病。
1.2 治療 病例1考慮患者確診前一直應用潑尼松10 mg/d,遂繼續應用,并囑阿維A 10 mg日3次口服,潑尼松應用20天后停藥,阿維A逐漸減量為10 mg日2次,10 mg日1次,2個月后,皮損完全消退,遂停止治療。隨訪3月未復發。
病例2給予阿維A 10 mg,日3次口服,隨皮損好轉逐漸減量,用至2個月,皮疹大部分消退,停口服藥物,同時加用外用藥,2周后皮疹逐漸消退,隨訪2周,未復發,目前患者仍在繼續隨訪中。
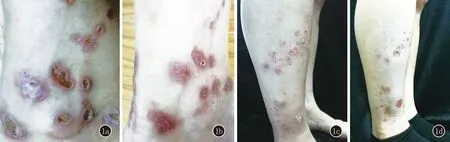
圖1 a:病例1左足踝部可見數個大小不等的孤立分布的暗紅色丘疹,中央凹陷,充填角化性物質,潰瘍邊緣呈火山口狀,周圍繞以紅暈;b:病例1治療2個月后皮損較前變平,皮損區遺留色素沉著;c:病例2下肢多發角化性丘疹,中央可見臍凹,內含角質栓,Kobner現象(+);d:病例2治療2個月后角質脫落,留有暗褐色斑疹
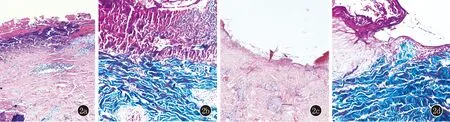
圖2 a:表皮杯形下陷,內含有角化不全角質細胞碎片及嗜蘇木素膠原纖維,真皮淺層血管及附屬器周圍多量淋巴細胞及少量嗜酸粒細胞浸潤(HE,×40);b:嗜藍染膠原纖維穿出表皮(Masson染色,×200);c:可見杯狀下陷的表皮,凹陷底部表皮變薄,真皮淺深層血管及附屬器周圍淋巴細胞、漿細胞浸潤(HE,×40);d:藍染膠原束垂直表皮穿出(Masson染色,×200)
2 討論
反應性穿通性膠原病(RPC)在1967年首次報道,病因不明,遺傳和創傷可能是誘發因素[1],分為遺傳性和獲得性[2]。遺傳性反應性穿通性膠原病多早年發病,Ramesh等[3]報道的最早發病年齡是9個月,大多無系統性疾病,家庭成員中有類似疾病史。獲得性反應性穿通性膠原病大多成人期發病,無家族史。國外García-Malinis[4]、國內楊揚等[5]、謝紅亮等[6]共報道50例獲得性反應性穿通性膠原病,其報道的平均年齡分別是54歲、59歲、45.83歲。我們的2例年齡是47歲和30歲,相比偏小。成人期發病患者多合并有嚴重的糖尿病、慢性腎衰竭、肝病等系統性疾病,也可無任何其他疾病。Karpouzis等[7]報道100 例ARPC,62%與糖尿病及其并發癥有關,Saray等[8]統計22例ARPC中3例患者無系統疾病,國內劉永霞等[9]報道35例ARPC患者,28例患者無系統性疾病,而謝洪亮等[6]報道12例ARPC患者中3例無系統性疾病,各種報道差別較大。由于發病率低,獲得病例少,以及可能誤診的情況,尚不能得出ARPC與已存在的基礎疾病之間存在密切關聯。本次報道2例ARPC患者無基礎疾病,其中病例1乙肝攜帶30年,但肝功正常且無肝功受損的臨床癥狀,故認為與本病發生無直接關系。RPC典型皮損為角化性丘疹,中央有臍凹,內充填角化性物質,伴不同程度瘙癢,Koebner征陽性。病理特點:表皮呈杯狀下陷,內含角栓,其中有角化上皮、角化不全細胞及變性的膠原,真皮淺層淋巴細胞等炎性細胞浸潤;角栓底部的表皮變薄,局部可見垂直穿過表皮的膠原纖維。本病需要與其他穿通性膠原病進行鑒別,穿通性毛囊炎和克里爾病排出物是角蛋白,匍行性穿通性彈性纖維病排出物為彈性纖維,本病排出物為膠原纖維可鑒別。
本病病因及發病機制不清,可能與以下因素相關:①搔抓其引起的輕微創傷是發病的觸發因素[8]。應用止癢藥物后患者臨床癥狀減輕可間接支持這一說法;②糖尿病可能與本病發生有關[10],長期高血糖使蛋白或其他復合物糖基化,導致真皮膠原纖維尤其是膠原I和III結構改變;③膠原代謝紊亂可能是本病發病的另一因素,皮損中(主要是恢復期皮損)可見到轉化生長因子-β3(TGF-β3)、基質金屬蛋白酶-1(MMP-1)和金屬蛋白酶組織抑制因子-1(TIMP-1)的表達增加[11],不過這也可能與正處于皮損恢復期有關;④血清中纖維連接蛋白水平升高也可能與本病有關[12],其可參與上皮細胞間信號傳導,運動和分化的過程,并與Ⅳ型膠原(基底膜中的膠原)和角質形成細胞結合,刺激上皮增生和膠原穿通表皮。結合文獻研究及病理特點,推測ARPC可能是一種內外因素作用下,由炎癥細胞(T細胞為主)介導,通過釋放IL1、IL17等相關細胞因子,引起炎癥及膠原變性穿通表皮的一種免疫性疾病。ARPC的治療具有挑戰性。如果存在基礎疾病,積極治療原發病至關重要。口服抗組胺藥物及外用糖皮質激素經常用作ARPC的經驗治療。有學者報道別嘌呤醇用于ARPC的治療,并取得良好效果[13]。其他治療方式包括口服和外用維A酸類制劑。另外也有他卡西醇、馬沙骨化醇、阿米替林、NB-UVB、光動力療法治療ARPC成功的報道。由于以上報告大部分都是孤立的個案報道,缺乏對照研究及應用推廣,所以ARPC目前尚無標準的治療方法及臨床指南。張倩雯等[14]曾報道過3例ARPC患者口服維A酸類、抗組胺藥物聯合外用糖皮質激素類及NB-UVB照射治療,治療3~4個月之后仍有新發皮疹,未取得滿意療效。我們的2例患者,病例1確診ARPC前,給予糖皮質激素治療,在糖皮質激素減量時皮疹復發泛發全身,加用阿維A治療2個月,角栓脫落,瘙癢減輕,效果佳(圖1b);病例2在發病之初即予以病理活檢,確診為ARPC,給予阿維A口服,皮損得以控制(圖1d)。2例ARPC患者均給予阿維A口服,2個月后,角質栓大部分脫落,皮損均明顯改善。回顧治療過程,推測阿維A在ARPC治療中發揮了重要作用。
結合ARPC發病機制及病理特點,阿維A可能通過以下機制發揮治療作用:①抑制T細胞向Th2、Th17分化,抑制相關炎癥因子釋放,抗炎調節免疫狀態;②抑制增生的膠原蛋白過度表達,誘導基質金屬蛋白酶1、8表達,溶解角栓[15],也能促進老化、萎縮的膠原蛋白增生[16],對膠原纖維代謝起到平衡調節作用。綜上,我們推測阿維A可能通過調節免疫狀態、抗炎、調節膠原代謝,多環節的阻斷ARPC發生,有效治療ARPC。
在本次報道的2例ARPC患者,應用阿維A治療后病情均得到緩解,但遺憾的是我們并未單獨應用阿維A治療,可能其它藥物也起了重要的作用,但兩例均應用阿維A治療有效,尤其是第一例加用阿維A后患者病情明顯好轉,我們推測阿維A治療此病有效。但其作為一線治療藥物仍有待大樣本、隨機對照臨床研究并長期觀察以進一步證實。

