不同單肺通氣模式對胸部手術患者肺氧合功能、血氣指標和炎性因子水平的影響
仲華根 田斌斌 馮 婷 劉志云 張 穎 周子超
胸外科手術時需要采用雙腔氣管插管進行單肺通氣,以保持雙肺良好的隔離效果,防止術側肺的血液、體液溢入健側肺,保證呼吸道通暢,避免發生交叉感染,同時也減少肺的呼吸運動對手術操作產生干擾,為手術提供條件。但單肺通氣可引起低氧血癥,對患者的術中安全造成一定的威脅。提高肺氧合功能、降低肺內分流是降低單肺通氣造成低氧血癥的關鍵環節[1]。
近年來,有學者提出保護性肺通氣策略,在進行單肺間歇正壓通氣的同時,對患側持續正壓通氣,以增加圍術期動脈氧合,保護肺組織免受呼吸機相關肺損傷,但對于其是否影響機體炎癥反應程度尚有待于進一步研究[2]。本研究旨在觀察分析不同單肺通氣模式對胸部手術患者肺氧合功能、血氣指標和血清炎性因子水平的影響。
1 資料與方法
1.1 一般資料
選取2016年2月至2017年12月在泰州市中醫院接受治療的60例胸外科手術患者。根據通氣方式分為對照組和觀察組,每組30例。對照組給予單肺間歇正壓通氣,觀察組采用單肺間歇正壓通氣加患側持續正壓通氣。對照組中男性19例,女性11例,年齡49~72歲,平均年齡(60.12±3.45)歲。觀察組中男性17例,女性13例,年齡48~73歲,平均年齡(60.15±3.72)歲。兩組患者年齡、性別等一般資料比較差異無統計學意義,具有可比性。本項研究經醫院倫理委員會評審通過,且所有患者或家屬均知情同意。
1.2 納入與排除標準
(1)納入標準:①年齡≥18周歲;②接受胸科手術者;③無其他系統嚴重疾病者。
(2)排除標準:①臨床資料不全者;②合并心、腎功能障礙者;③合并免疫功能障礙者;④因肺部感染性疾病行手術者;⑤肺癌患者除外。
1.3 儀器設備
采用Smart-7900型麻醉呼吸機(美國Datex-Ohmeda 公司);PhoxPlus型血氣分析儀(美國NOVA公司);ELX800型全自動酶標儀(美國BIO-TEK公司),試劑盒購自南京建成生物工程研究所。
1.4 通氣方法
(1)對照組給予單肺間歇正壓通氣,患者入室后靜脈注入咪唑安定3 mg/kg、丙泊酚2 mg/kg、芬太尼4 μg/kg及羅庫溴銨0.6 mg/kg進行麻醉誘導。待睫毛反射消失后經口插入BLUELINE雙腔支氣管導管,男性采用37 F導管,女性為35 F導管,插管深度為30 cm左右,定位良好、隔離效果滿意后,連接Smart-7900型麻醉呼吸機行間歇正壓通氣,調節呼吸參數:潮氣量6~7 ml/kg,呼吸頻率18次/min,吸呼比為1∶2。吸入氧濃度(FiO2)為100%。
(2)觀察組采用單肺間歇正壓通氣加患側持續正壓通氣,間歇正壓通氣方法與對照組相同,患側持續正壓通氣采用3號細導管連接帶有濕化瓶的氧流量儀,氧流量為1 L/min。
1.5 評價指標
比較兩組患者通氣前后血氣指標、肺氧合功能、炎性因子水平和并發癥發生率的差異。在單肺通氣前、單肺通氣后30 min及單肺通氣后60 min,采集患者動脈血作血氣分析,檢測儀器為NOVA血氣分析儀,氧合指數(oxygenation index,OI)計算為公式1:
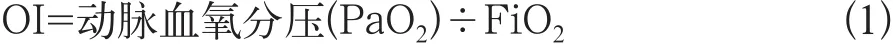
肺血分流率(Qs/Qt)計算為公式2:

式中Qt為心排血量,Qs為肺內分流。
分別于單肺通氣前后抽取患者外周靜脈血,以3000 r/min(離心半徑10 cm)離心10 min,分離血清,于-70 ℃冰箱保存待測。采用雙抗體夾心酶聯免疫吸附法檢測血清白細胞介素-6(interleukin-6,IL-6)和高敏C反應蛋白(high-sensitive C-reactive protein,hs-CRP)水平,檢測儀器為美國BIO-TEK全自動酶標儀,試劑盒購自南京建成生物工程研究所,嚴格按照試劑盒說明書操作。
1.6 統計學方法
數據錄入后,采用SPSS 11.5軟件進行統計分析。計數和計量資料分別采用“例”和均值±標準差(x-±s)表示。兩組患者通氣前后血氣指標、肺氧合功能及炎性因子水平的比較采用t檢驗進行統計分析,兩組患者并發癥發生率的比較采用卡方檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者通氣前后血氣指標比較
兩組患者單肺通氣前血氣指標PaO2和動脈血二氧化碳分壓(PaCO2)比較,差異無統計學意義(t=0.006、t=0.043;P>0.05),單肺通氣后30 min和60 min時,觀察組患者的PaO2水平高于對照組,其差異有統計學意義(t=5.383,t=7.938;P<0.001);兩組患者單肺通氣后30 min和60 min時的PaCO2水平比較,差異均無統計學意義(t=0.056,t=0.024;P>0.05),見表1。
2.2 兩組患者通氣前后肺氧合功能比較
兩組患者單肺通氣前肺氧合功能PaO2和PaCO2比較,差異均無統計學意義(t=-0.037,t=-0.062;P>0.05),單肺通氣后30 min和60 min時,觀察組患者的OI高于對照組,Os/Qt水平低于對照組,其差異有統計學意義[OI(t=-10.748,t=-32.678;P<0.001),Os/Qt(t=5.420,t=8.359;P<0.001)],見表2。
表1 兩組患者通氣前后血氣指標的比較(mmHg,±s)

表1 兩組患者通氣前后血氣指標的比較(mmHg,±s)
注:表中PaO2為動脈血氧分壓;PaCO2為動脈血二氧化碳分壓。
組別 PaO2 PaCO2單肺通氣前 單肺通氣30 min 單肺通氣60 min 單肺通氣前 單肺通氣30 min 單肺通氣60 min觀察組 310.25±14.11 208.17±23.01 198.24±18.15 43.18±2.29 44.12±3.18 45.39±3.25對照組 310.23±13.24 176.25±22.92 162.17±17.03 43.15±3.05 44.08±2.27 45.37±3.31 t值 0.006 5.383 7.938 0.043 0.056 0.024 P值 0.498 <0.001 <0.001 0.483 0.478 0.491
表2 兩組患者通氣前后肺氧合功能的比較(±s)

表2 兩組患者通氣前后肺氧合功能的比較(±s)
注:表中OI為氧合指數;Os/Qt為肺內分流。
組別 OI(mmH2O) Os/Qt(%)單肺通氣前 單肺通氣30 min 單肺通氣60 min 單肺通氣前 單肺通氣30 min 單肺通氣60 min觀察組 365.42±14.23 261.13±13.75 255.24±12.33 10.23±1.21 17.23±2.03 24.87±3.25對照組 365.55±13.03 298.22±12.97 332.18±13.01 10.25±1.27 14.02±2.53 19.03±2.02 t值 -0.037 -10.748 -32.678 -0.062 5.420 8.359 P值 0.485 <0.001 <0.001 0.475 <0.001 <0.001
2.3 兩組患者通氣前后炎性因子水平比較
兩組患者通氣前炎性因子IL-6和hs-CRP水平比較,差異均無統計學意義(t=-0.058,t=0.145;P>0.05),單肺通氣后,觀察組患者IL-6和hs-CRP水平均低于對照組,其差異有統計學意義(t=12.531,t=7.208;P<0.001),見表3。
表3 兩組患者通氣前后炎性因子水平的比較±s)

表3 兩組患者通氣前后炎性因子水平的比較±s)
注:表中IL-6為白介素-6;hs-CRP為超敏反應C蛋白。
組別 IL-6(pg/ml) hs-CRP(mg/L)單肺通氣前 單肺通氣后 單肺通氣前 單肺通氣后對照組 22.15±2.0338.94±3.22 6.29±1.01 11.23±2.09觀察組 22.18±2.0128.65±3.14 6.25±1.12 8.14±1.07 t值 -0.058 12.531 0.145 7.208 P值 0.477 <0.001 0.443 <0.001
2.4 兩組患者并發癥發生率比較
觀察組患者術后不適感、肺部感染和術后尿潴留發生率均低于對照組,其差異有統計學意義(x2=4.043,P<0.05),見表4。

表4 兩組患者并發癥發生率的比較(例(%))
3 討論
胸外科手術在心臟、食道、肺部等疾病的治療中發揮著重要的作用,對手術麻醉提出了更高的要求[3]。單肺通氣模式是胸心外科麻醉中比較常用的通氣模式,既可保證術中呼吸道通暢,又可防止術側肺的血液溢入健側肺,避免發生交叉感染,同時還可減少呼吸運動對手術操作的干擾,更有利于手術視野暴露和手術操作[4]。但在實際工作中發現,單肺通氣時術中常會出現低氧血癥、呼吸動力學改變等問題,這與肺萎陷、通氣和(或)血流比值下降、靜脈血摻雜有關[5]。此外,術中牽拉、擠壓、肺循環血流重新分布、高氣道壓力等因素也會引起PaO2下降[6]。
有研究發現,肺內血流量分布除了與重力因素有關外,還與低氧性肺血管收縮效應有關[7]。肺泡氧濃度水平的降低可觸發低氧性肺血管收縮效應,使缺氧的肺毛細血管前小動脈收縮、從而增加血管阻力、減少血流量,使血液向通氣良好的肺泡區域分布,減少了肺內分流[8]。這一效應是機體的自身保護性調節機制。單肺通氣時機體的低氧性肺血管收縮效應可使非通氣側肺血流減少,通氣側肺血流增加,但仍有部分患者可發生低氧血癥[9]。如何降低肺內分流、提高氧合是單肺通氣的關鍵問題。
單肺間歇正壓通氣加患側持續正壓通氣是對傳統單肺通氣的改進,不僅使患側肺氣道壓較低,提供清晰的手術視野,同時又能提供確切的氣體交換,避免長時間、高濃度的氧氣吸入,并增加血管阻力,促使血流轉向下肺,達到減少分流量、避免低氧血癥的目的[10-11]。本研究中采用單肺間歇正壓通氣加患側持續正壓通氣的患者在單肺通氣后30 min和60 min時的PaO2水平高于單肺間歇正壓通氣患者;OI高于單肺間歇正壓通氣患者;Os/Qt水平低于單肺間歇正壓通氣患者。這是由于對患側肺持續正壓通氣可增加有效氣體分布、促進氣體彌散,并有助于增加肺的功能殘氣量,防止肺泡萎陷、改善動脈血氧合,從而更有助于避免低氧血癥的發生[13]。
IL-6是炎癥反應的促發因子,可促進炎性因子的大量激活和釋放,與肺損傷密切相關。胸科手術創傷大、應激反應強烈,術后炎癥因子顯著升高[14]。hs-CRP是人體急性時相反應蛋白,在創傷、感染發生后急劇升高[15]。本研究中創新性的探討了單肺通氣后患者機體炎癥反應程度的變化,發現采用單肺間歇正壓通氣加患側持續正壓通氣的患者血清IL-6和hs-CRP水平低于單肺間歇正壓通氣患者。這一結果提示,采用單肺間歇正壓通氣加患側持續正壓通氣可降低機體炎癥反應程度。這可能是由于對患側肺持續正壓通氣可改善肺內分流,更有利于保護肺組織,避免發生呼吸機相關性肺損傷。此外,機體缺氧狀態下缺氧誘導因子-1活化,由于缺氧誘導因子-1具有廣泛的靶基因譜,其中包括與缺氧適應、炎癥發展、腫瘤生長等相關靶基因。當其與靶基因結合后,通過轉錄和轉錄后調控使機體產生一系列反應,給機體帶來病理性損害。采用單肺間歇正壓通氣加患側持續正壓通氣可有效改善氧合,抑制缺氧誘導因子-1的活化,進而減輕由此導致的機體炎性損傷。
本研究還發現,采用單肺間歇正壓通氣加患側持續正壓通氣的患者術后不適感、肺部感染和術后尿潴留發生率低于單肺間歇正壓通氣患者。結果提示,采用單肺間歇正壓通氣加患側持續正壓通氣更有助于減少手術并發癥,這可能與機體的炎癥反應程度更小有關,其具體機制尚有待于進一步的研究闡釋。
單肺間歇正壓通氣加患側持續正壓通氣對胸部手術患者肺氧合功能和血氣指標有較好的改善效果,降低炎性因子水平具有臨床推廣應用的價值。

