香榧幼胚發育與胚性感受態之間的相關性
龔 麗,胡恒康, 胡淵淵, 喻衛武,吳家勝,黃堅欽, 張啟香
(1.浙江農林大學 林業與生物技術學院,浙江 杭州311300;2.浙江農林大學 省部共建亞熱帶森林培育國家重點實驗室 浙江 杭州311300)
植物胚性感受態為植物細胞或組織脫分化能力或潛力,胚性感受態的高低直接決定了植物體細胞胚誘導的難易程度[1]。研究發現,大多數植物的組織或細胞維持高水平胚性感受態的時間極短[2-3]。胚性感受態水平的高低與基因型、外植體的取材部位、生理學年齡等密切相關[4]。在黑核桃Juglans nigra中,授粉后3~4周的幼胚開始具有體胚發生能力,授粉后6~7周時幼胚體胚發生頻率最高,此后,體胚發生能力逐漸下降[5]。在梨Pyrus中,具有胚性感受態的時間極短,只有當梨幼胚發育期為魚雷胚至子葉胚時,才有少量體胚的誘導與發生[6]。榧樹Torreya grandis隸屬于裸子植物紅豆杉科Taxaceae榧屬Torreya常綠喬木。香榧Torreya grandis‘Merrillii’是實生榧樹中優良變異類型或優株經人工嫁接繁殖而成的優良品種,為中國特有的珍稀干果和木本油料植物,具有重要的經濟、社會和生態價值[7]。由于傳統嫁接繁殖難以滿足目前市場的巨大需求,近年來,研究人員開展了香榧植株體胚發生及再生體系的建立等研究[8-11]。但由于缺乏對香榧種子內幼胚發育過程及體胚誘導及發生規律的深入了解,導致其體胚發生及再生體系難以穩定,有效繁殖系數低。本研究以不同發育階段的香榧幼胚為外植體,開展胚性愈傷組織及體細胞胚誘導研究,通過對不同發育時期來源的幼胚進行誘導率分析,同時輔以幼胚內源激素的變化規律,擬闡明香榧幼胚發育狀態與其胚性感受態之間的相關性,為建立香榧穩定、高效體胚發生及植株再生體系提供良好的技術平臺,同時也為后期香榧遺傳轉化體系的建立打下良好的基礎。
1 材料與方法
1.1 實驗材料
于2014年7月5日至8月23日,選取浙江農林大學試驗基地中良好的香榧植株(圖1A)。香榧種子于5月10日突破種鱗,以此日期為起點計算,即種子突破種鱗后第8周至第15周(以下簡稱第8周至第15周),分8次采集發育正常、大小適中的種子帶回實驗室待處理。
1.2 實驗方法
將8次采集的香榧種子用解剖刀去除香榧種子的假種皮,放入添加洗滌劑的清水中搓洗數次并漂洗干凈,在自來水流水下沖洗1~2 h后用吸水紙將種子表面水分吸干。在超凈工作臺上用體積分數為75%乙醇表面滅菌處理好的香榧種子3 min,無菌水沖洗3~4次,再用稀釋10倍的次氯酸鈉(NaClO)溶液(每50 mL加1滴吐溫)真空抽濾20 min,無菌水沖洗5~6次,無菌吸水紙吸干種子表面水分后等用。用無菌修枝剪從表面滅菌后的種子頂端(俗稱榧眼端)縱向剪開,在體視顯微鏡(Zeiss Stereo Discovery V12)下用解剖針剝取完整幼胚,待用。
1.2.1 不同發育時期幼胚內源吲哚乙酸(IAA)及脫落酸(ABA)的質量分數測定 將8個不同發育時期的香榧幼胚(每次剝取0.2 g左右),立即用液氮速凍,放入-70℃的低溫冰箱內以備內源激素質量分數測定。內源激素質量分數測定時每0.1 g樣品加入1 mL內含1 mmol·L-1二叔丁基對甲苯酚的80%甲醇提取液,弱光下冰浴研磨冰凍鮮樣成勻漿,轉入離心管中,再用1 mL提取液分次沖洗研缽,一并轉入離心管中。4℃下提取4 h,1 000g離心15 min取上清液,殘渣加入1 mL提取液4℃下提取1 h,合并上清液。上清液過18C固相萃取柱后,用氮氣吹干。過柱后的樣品用pH 7.4的磷酸緩沖液溶解后,將樣品甲脂化,即用氮氣吹干,之后再用甲醇溶解,在冰浴條件下加過量的重氮甲烷反應至黃色,10 min后加半滴0.2 mol·L-1乙酸甲醇破壞過量的重氮甲烷(黃色消失),用氮氣吹干,磷酸緩沖液溶解后進行酶聯吸附法(ELSA)測定ABA和IAA質量分數(分母為幼胚鮮質量)。每個處理重復3次。
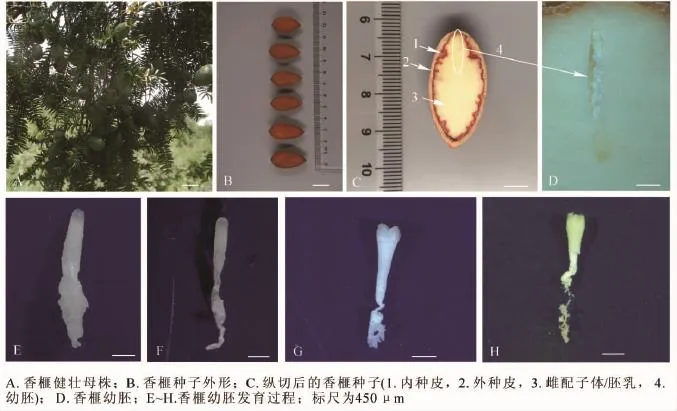
圖1 香榧種子及幼胚生物學特性Figure 1 Characters of seeds and immature embryos of Torreya grandis ‘Merrillii’
1.2.2 香榧胚性愈傷組織及體胚誘導 將8個不同發育時期的香榧幼胚取出后,接種在胚性愈傷組織及體胚誘導培養基中。培養基成分如下:①以1/2 SH為基本培養基[12],附加0.1 mg·L-1萘乙酸(NAA),2 g·L-1活性碳, 30 g·L-1蔗糖; ②1/2 SH 基本培養基, 附加 0.1 mg·L-1NAA, 0.5 g·L-1谷氨酰胺, 2 g·L-1活性碳,30 g·L-1蔗糖;③1/2 SH基本培養基(對照)。培養基附加4 g·L-1瓊脂,pH 5.7,暗培養。每處理接種20個幼胚,重復3次。
1.2.3 數據統計分析 每天觀察幼胚生長情況,當幼胚暗培養4周時,在體視顯微鏡下觀察胚性愈傷組織、體胚誘導以及幼胚萌發情況,統計各處理下胚性愈傷組織誘導率、體胚發生率以及幼胚直接萌發率。實驗數據采用SigmaPlot 8.0和SPSS 17.0進行統計分析,Duncan新復極差檢驗法進行多重比較。
2 結果與分析
2.1 香榧幼胚發育的形態特征觀察
觀察發現,成熟的香榧種子具假種皮,綠色纖維質(圖1A)。剝去假種皮,可見棕褐色外種皮,堅硬木質化(圖1B,圖1C箭頭2所示)。內種皮暗紅色,褶皺膜質,內陷成脊狀(圖1C,箭頭1所示)。胚乳單倍體,乳白色,為主要可食用部位(圖1C,箭頭3所示)。香榧幼胚位于種子榧眼端雌配子體腔內,細小不明顯(圖1C,橢圓所示,圖1D),幼胚胚體和胚柄系統相連,胚柄系統靠近珠孔端,胚頭部遠離珠孔端。香榧胚發育經歷多胚時期、胚胎選擇時期和優勢胚完全發育等3個時期。通過胚胎選擇,多個香榧幼胚最后僅有1個發育較好,其他幼胚在不同發育階段終止發育而萎縮。香榧早期幼胚為棒狀(圖1E,F),隨著幼胚發育成熟,頭部逐漸膨大,直至子葉展開,胚柄萎縮脫落(圖1G,H)。
2.2 不同胚齡對香榧幼胚內源ABA及IAA質量分數的影響
不同發育時期香榧幼胚的內源IAA及ABA質量分數具顯著性差異(P<0.05)。香榧幼胚內源IAA的質量分數在胚珠突破種鱗后第8周處于最大值,達53.90 ng·g-1,第9周稍有下降,但與第8周之間無顯著性差異,之后迅速下降至44.14 ng·g-1。隨著胚齡的逐漸增加,內源IAA質量分數總體呈小幅波動的下降趨勢,第 15周最低,為 35.60 ng·g-1(圖 2)。
香榧幼胚內源ABA質量分數的測定結果表明:幼胚胚齡對其內源ABA的質量分數同樣具有顯著影響(P<0.05)。在種鱗突破種皮后的第8至第15周內,隨著胚齡的增加,內源ABA質量分數呈先下降后上升的總趨勢,其中第8周至第10周,內源ABA質量分數先下降后上升,但變化幅度比較小;第10周到第12周處于快速上升期,從第10周的89.80 ng·g-1上升到第12周的144.67 ng·g-1;第13至15周內源ABA處于變化平緩期,且維持在較高水平,其中第14周和第15周內源ABA質量分數無顯著差異,第15周達到最大值,為160.20 ng·g-1(圖2)。
2.3 不同胚齡對香榧幼胚胚性感受態的影響
不同發育階段香榧幼胚的胚性感受態具顯著差異;同時,不同離體培養條件對香榧幼胚的胚性感受態激發也有顯著差異(表1,圖3,圖4)。將香榧幼胚接種于1/2 SH基本培養基中培養,當幼胚胚齡較小時,可產生極少量胚性愈傷組織,但從第10周開始,胚性愈傷組織誘導率均為0,但各胚齡幼胚均未誘導直接產生體胚。將幼胚接種于附加0.1 mg·L-1NAA的1/2 SH基本培養基上培養,隨著幼胚胚齡的增加,胚性愈傷組織誘導率先上升后下降,其中第8周幼胚的胚性愈傷組織誘導率為48.1%,第9周時略有升高,達到最高值,為48.3%,隨后逐漸下降,第14至第15周胚性愈傷組織誘導率為0;將香榧幼胚置于1/2 SH基本培養基附加0.1 mg·L-1NAA的培養基中培養,隨著胚齡的增加,誘導率也呈先上升后下降的趨勢,第8周體胚誘導率為0,第9周體胚誘導率上升為5.8%,至第10周體胚誘導率達到最高,為42.7%,后隨著胚齡的增加,體胚誘導率逐漸下降,第14周至第15周體胚誘導率為0(圖3)。
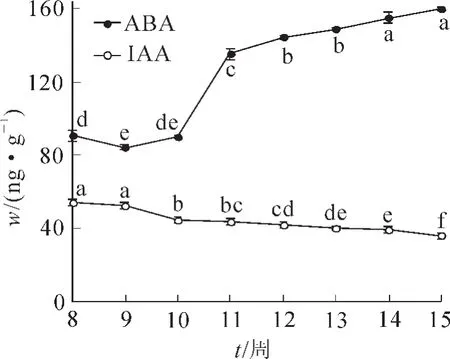
圖2 香榧幼胚胚齡對其內源IAA及ABA質量分數的影響Figure 2 Effectofdevelopmentalstageson endogenous IAA and ABA content of immature embryo in Torreya grandis‘Merrillii’
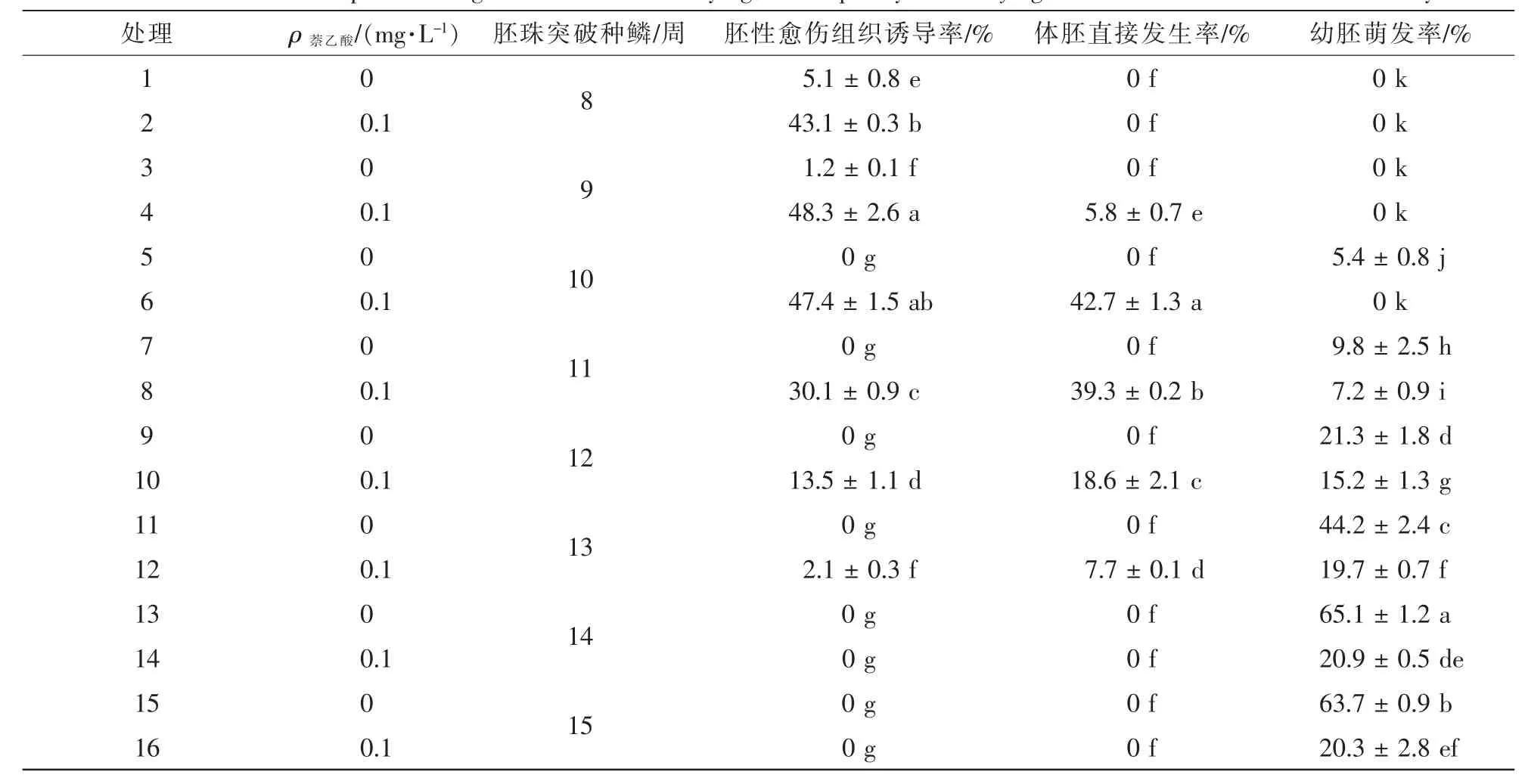
表1 胚齡及萘乙酸對香榧幼胚胚性感受態的影響Table 1 Effect of developmental stages and NAA on embryo genic frequency of Torreya grandis ‘Merrillii’ immature embryos
第8周至第15周的幼胚進行離體萌發試驗發現,不同外植體發育階段及培養條件對萌發率具有顯著影響(圖4)。將幼胚培養于1/2 SH基本培養基中,萌發率隨著胚齡的增加而升高,第8周至第9周幼胚萌發率為0,從第10周開始,萌發率逐漸上升,第14周時達最高值,為65.1%,之后略有下降。而當幼胚培養于附加0.1 mg·L-11/2 SH培養基NAA中進行萌發培養時,香榧幼胚極易產生愈傷組織而不能正常萌發形成有效苗(圖5)。
3 結論與討論
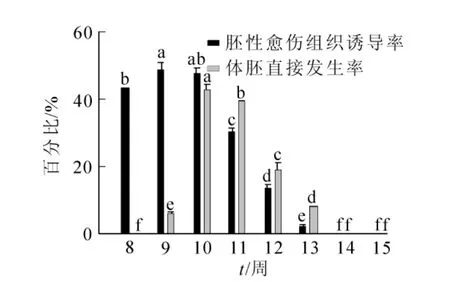
圖3 胚齡對胚性愈傷組織及體胚直接發生的影響Figure 3 Effect of immature embryo developmental stages on embryogenic callus induction and direct somatic embryogenesis (SH+0.1 mg·L-1NAA)

圖4 胚齡及培養條件對香榧幼胚萌發的影響Figure 4 Effect of immature embryo developmental stages and media on in vitro germination
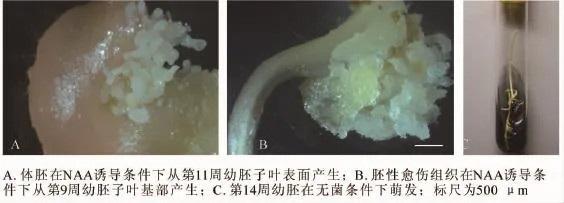
圖5 不同胚齡對香榧幼胚胚性感受態的影響Figure 5 Embryogenic frequency of immature embryos under different developmental stages
體細胞胚胎發生在植物組織培養過程中,外植體材料的基因型、發育階段以及生理狀態等決定了其胚性感受態的強弱。對于多數植物來說,特定階段幼胚的胚性感受態明顯強于其他階段[13]。目前,已有多種裸子植物經誘導成功獲得了體細胞胚[14]。與被子植物不同,裸子植物體細胞胚誘導對外植體的要求更加嚴格,一般情況下,以胚性感受態較高的幼胚為外植體進行體胚誘導。如,在火炬松Pinus taeda,華北落葉松Larix principis-rupprechtii等針葉樹,需采用各發育階段的幼胚為外植體進行體胚誘導[15-19]。除此以外,部分研究還采用了未成熟的雌配子體為外植體成功獲得了體細胞胚[20-22]。本研究采用香榧胚珠突破種鱗后第8~15周的幼胚為外植體,第9周幼胚胚性愈傷組織誘導率最高,達54.3%,第11周幼胚的體胚直接發生率最高,達48.4%,表明不同發育時期對香榧幼胚胚性感受態具顯著影響。然而,盡管幼胚在某些階段(如子葉胚早期、子葉胚晚期等)具有良好的胚性感受態,但對于絕大多數植物來說,植物組織由于幼胚胚性感受態表現出的細胞全能性仍需要合適的條件下才能受到激發。本研究中將香榧幼胚培養于附加0.1 mg·L-1NAA的SH基本培養基時,無論是胚性愈傷組織誘導率還是體細胞胚直接發生率,都顯著高于在SH基本培養基中的誘導結果,說明香榧幼胚胚性感受態也需要特定條件(外源NAA)激發。
幼胚胚性感受態需在特定條件下才能被激活的現象與植物幼胚體的生理狀態密切相關[18,23]。植物的內源激素是影響組織胚性感受態的最重要因素之一。以香雪蘭Freesia refracta花序為外植體進行體細胞胚誘導,花序的形態學上端無體細胞形成,而下端可分化出體細胞胚。檢測結果表明,體細胞胚誘導前的花序形態學上下兩端內源IAA質量分數無明顯差別,但培養后形態學下端(體細胞胚發生端)IAA質量分數明顯高于上端,表明內源IAA質量分數是香雪蘭花序誘導產生體細胞胚的主導因子之一[24]。本研究第8周至第11周幼胚的內源IAA質量分數較高,此時極易誘導胚性愈傷組織或體細胞胚,說明高質量分數內源IAA可能提高幼胚的胚性感受態,使幼胚易于受外源激素誘導并脫分化。現有研究表明,ABA對于植物胚的正常發育和防止早萌具有重要作用[25]。不僅如此,ABA對胚發育調節作用與胚的發育程度有關,果針入土后10 d的花生幼胚,在無外源植物生長調節物質的培養基中能夠正常發育,而果針入土后20 d的花生幼胚需要越來越高的外源ABA維持才能正常發育[26]。本研究中香榧幼胚第8~11周幼胚內源ABA質量分數較低,此時幼胚的胚性感受態較高,隨著胚齡增加,ABA質量分數快速上升并維持在較高水平,但幼胚胚性感受態逐漸降低,可能與ABA可以促進香榧胚胎發育成熟有關,此現象與一定質量分數ABA促進華北落葉松、云杉Picea等裸子植物體胚成熟相似[19,27]。
綜上所述,香榧第8~12周幼胚具有較高的胚性感受態,同時,通過對幼胚內源激素的測定,對維持外植體高胚性感受態,開展香榧胚性愈傷組織及體胚發生培養條件的篩選提供了技術指導。香榧幼胚發育狀態與胚性感受態之間的相關性是以幼胚為外植體進行胚性愈傷組織及體細胞胚的重要環節。由此掌握精確幼胚取樣時間,準確采樣,極大縮短體細胞胚誘導及培養的周期,大大降低培養成本,可為香榧遺傳轉化體系的建立提供良好的技術平臺。
4 參考文獻
[1] 由香玲,譚嘯,戴金玲,等.脅迫誘導植物體細胞發生的研究進展[J].西北植物學報,2010,30(9):1929-1934.YOU Xiangling,TAN Xiao,DAI Jinling,et al.Progress on the stress induction of plant somatic embryogenesis [J].Acta Bot Boreal-Occident Sin,2010,30(9):1929-1934.
[2] ARNOLD S,SABALA I,BOZHKOV P,et al.Developmental pathways of somatic embryogenesis [J].Plant Cell,Tissue Organ Cult,2002,69(3):233-249.
[3] GUAN Yuan,LI Shuigen,FAN Xiaofen,et al.Application of somatic embryogenesis in woody plants [J].Front Plant Sci,2016,7:938.doi:10.3389/fpls.2016.00938.
[4] NIC-CAN G I,GALAZ-áVALOS R M,DE-LA-PE?A C,et al.Somatic embryogenesis:identified factors that lead to embryogenic repression:a case of speciesof the same genus [J].PLoS One,2015.doi:10.1371/journal.pone.0126414.
[5] 湯浩茹,王永清,任正隆.核桃體細胞胚發生與轉基因研究進展[J].林業科學,2000,36(3):102-110.TANG Haoru,WANG Yongqing,REN Zhenglong.An overview of progress on somatic emrbyogenesis and transformation in walnut[J].Sci Silv Sin,2000,36(3):102-110.
[6] 劉淑芳,續海紅.不同發育期梨胚的再生能力[J].江蘇農業科學,2012,40(7):63-64.LI Shufang,XU Haihong.Regeneration frequency of embryo in different developmental stages [J].Jiangsu Agric Sci,2012,40(7):63-64.
[7] 黎章矩,戴文圣.中國香榧[M].北京:科學出版社,2007.
[8] 姜新兵,陳力耕,何新華.香榧體細胞胚發生的研究[J].園藝學報,2004,31(5):654-656.JIANG Xinbing,CHEN Ligeng,HE Xinhua.Studies on the somatic embryogenesis ofTorreya grandis[J].Acta Hortic Sin,2004,31(5):654-656.
[9] 劉海琳,陳立耕,童品璋,等.香榧莖段離體培養再生植株的研究[J].果樹學報,2007,24(4):477-482.LIU Hailin,CHEN Ligeng TONG Pinzhang,et al.In vitro organogenesis and plant regeneration from stem segments ofTorreya grandis[J].J Fruit Sci,2007,24(4):477-482.
[10] 姚進,黃堅欽,胡恒康,等.香榧體細胞胚發生的初步研究[J].浙江農林大學學報,2013,30(1):129-135.YAO Jin,HUANG Jianqin,HU Hengkang,et al.Somatic emryogenesis ofTorreya grandis‘Merrillii’ [J].J Zhejiang A&F Univ,2013,30(1):129-135.
[11] 項偉波,趙金凱,吳家勝,等.香榧體細胞胚發生、發育的形態與細胞學觀察[J].園藝學報,2015,42(8):1477-1486.XIANG Weibo,ZHAO Jinkai,WU Jiasheng,et al.Morphological and cytological observation of somatic emryogenesis and development inTorreya grandis‘Merrillii’ [J].Acta Hortic Sin,2015,42(8):1477-1486.
[12] SCHENK T,SCHENK R U,HILDEBRANDT A C.Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures [J].Can J Bot,1972,50(1):199-204.
[13] 盛德策,李鳳蘭,劉忠華.植物體細胞胚發生的細胞生物學研究進展[J].西北植物學報,2008,28(1):204-215.SHENG Dece,LI Fenglan,LIU Zhonghua.Advances in the cytobiology of plant somatic embryogenesis [J].Acta Bot Boreal-Occident Sin,2008,28(1):204-215.
[14] STASOLLA C,YEUNG E C.Recent advances in conifer somatic embryogenesis:improving somatic embryo quality[J].Plant Cell Tissue Organ Cult,2003,74(1):15 - 35.
[15] NISKANEN A,LU J,SEITZ S,et al.Effect of parent genotype on somatic embryogenesis in Scots pine (Pinus sylvestris) [J].Tress Physiol,2004,24(11):1259 - 1265.
[16] LARA-CHAVEZ A,FLINN B S,EGERTSDOTTER U.Initiation of somatic embryogenesis from immature zygotic embryos of Oocarpa pine (Pinus oocarpaSchiede ex Schlectendal) [J].Tree Physiol,31(5):539 - 554.
[17] PULLMAN G S,CHOPRA R,CHASE K M.Loblolly pine (Pinus taedaL.) somatic embryogenesis:improvements in embryogenic tissue initiation by supplementation of medium with organic acids,vitamins B12 and E [J].Plant Sci,2006,170(3):648 - 658.
[18] PULLMAN G S,ZENG X Y,COPELAND-KAMP B,et al.Conifer somatic embryogenesis:improvements by supplementation of medium with oxidation-reduction agents [J].Tree Physiol,2015,35(2):1 - 16.
[19] 齊力旺,韓一凡,李玲,等.華北落葉松體細胞胚胎發生及遺傳轉化實驗系統的建立[J].實驗生物學報,2000, 33(4): 357 - 365.QI Liwang,HAN Yifan,LI Ling,et al.The somatic embryogenesis and establishment of transformation experiment system inLarix principis-rupprechth[J].Acta Biol Exp Sin,2000,33(4):357 - 365.
[20] KROGSTRUP P.Embryolike structures from cotyledons and ripe embryos of Norway spruce (Picea abies) [J].Can J For Res,1986,16(3):664 - 668.
[21] LELU-WALTER MA,BERNIER-CARDOU M,KLIMASZEWSKA K.Clonal plant production from self-and cross-pollinated seed families ofPinus sylvestrisL.through somatic embryogenesis [J].Plant Cell Tiss Org Cult,2008,92(1):31 - 45.
[22] BECWAR M R,NAGMANI R,WANN S R.Initiation of embryogenic cultures and somatic embryo development in loblolly pine (Pinus taeda) [J].Can J For Res,1990,20(6):810 - 817.
[23] ZHANG Qixiang,HU Hengkang,HUANG Youjun,et al.The relationship between developmental stages of zygotic embryos at explanting and embryogenic frequency on hickory (Carya cathayensisSarg.) [J].Sci Hortic,2012,139:66-70.
[24] 王麗,鮑曉明,黃百渠,等.香雪蘭外植體形態學極性決定的體細胞胚胎發生[J].植物學報,1998,40(2):138-143.WANG Li,BAO Xiaoming,HUANG Baiqu,et al.Somatic embryogenic potential determined by the morphological polarity of the explant in tissue cultures ofFreesia refracta[J].Acta Bot Sin,1998,40(2):138 - 143.
[25] 王穎,劉春朝,陳秀蘭.ABA促進針葉樹體細胞胚胎分化[J].植物生理學通訊,2002,3(6):273-278.WANG Ying,LIU Chunzhao,CHEN Xiulan.Somatic embryogenesis in conifers by ABA [J].Plant Physiol Commun,2002,3(6):273 - 278.
[26] 林鹿,傅家瑞.ABA對花生胚離體發育的調節[J].中國油料,1996,18(1):4-7.LIN Lu,FU Jiarui.Regulation by ABA on development of peanut embryos in vitro [J].Chin Oil Sci,1996,18(1):4-7.
[27] IRAQI D,TREMBLAY F M.The role of sucrose during maturation of black spruce (Picea mariana) and white spruce (Picea glauca) somatic embryos [J].Physiol Plant,2001,111:381 - 388.

