SAPCD2對人結腸癌RKO細胞增殖能力的影響
(青島大學附屬醫院病理科,山東 青島 266003)
結直腸癌是最常見的惡性腫瘤之一,隨著人口老齡化的加劇,其發病率持續增加[1-2]。近年來,人們在結直腸癌的分子診斷和靶向治療方面取得了長足的進步,但是對于其具體的侵襲和轉移機制仍不明確。因此,通過分子生物學的方法對結直腸癌的侵襲和轉移機制進行研究,對于結直腸癌病人的臨床治療以及預后判斷具有重要的意義。Suppressor Anaphase-promoting complex domain containing 2(SAPCD2),又被稱為p42.3或C9orf140,是哺乳動物體內一種新近發現的高度保守的基因,其影響細胞周期并參與染色體的分離[3-4]。相關的研究表明,SAPCD2基因在胃癌、膠質瘤、肝癌等多種腫瘤組織中高表達,并且與腫瘤惡性程度及細胞增殖和侵襲性相關[3,5-9]。最近有研究發現,SAPCD2在結直腸癌中的表達顯著增高[2,10]。然而,其在結直腸癌中過度表達的意義、分子機制及相關信號轉導通路尚未闡明,而且SAPCD2在結直腸腺瘤中的表達情況尚未見報道。本研究擬首先采用免疫組織化學方法檢測SAPCD2在結直腸正常黏膜、腺瘤及結直腸癌組織中的表達情況,分析其在三種組織中表達的差異性及其與臨床病理參數的關系;然后采用慢病毒轉染技術使SAPCD2在結腸癌RKO細胞中表達沉默,通過細胞功能實驗研究SAPCD2的相關生物學功能,進一步探討其對結腸癌RKO細胞增殖能力的影響。現將結果報告如下。
1 材料與方法
1.1 材料
人結腸癌RKO細胞系由浙江大學醫學院分子病理學實驗室提供。胎牛血清購于美國Ausbian公司,細胞轉染試劑、細胞培養板以及DMEM培養基購買于美國Corning公司,慢病毒表達載體由上海吉凱公司構建,四甲基偶氮唑鹽(MTT)購于美國Genview公司,DMSO購于上海試一化學試劑公司,SAPCD2兔多克隆抗體(ab126342)購買自美國Abcam公司。
1.2 實驗方法
1.2.1組織芯片和免疫組織化學染色 收集我院病理科2014—2016年接受手術治療石蠟包埋的結直腸癌組織及匹配的正常黏膜組織標本108例,活檢結直腸腺瘤標本50例(其中13例為108例結直腸癌中的腺瘤標本),標本均經常規病理診斷確診。
使用Pathology Devices TMAjrTM 制作孔徑為 2.0 mm的組織芯片,3 μm厚切片,置于pH 6.0的枸櫞酸中進行恒溫水浴抗原修復35 min,用含體積分數為0.03的H2O2去離子水抑制內源性過氧化物酶10 min,滴加濃度為1∶1 500 的SAPCD2兔多克隆抗體4 ℃孵育過夜;滴加二抗酶復合物HRP試劑于室溫下反應 20 min;通過DAB試劑對組織芯片顯色,蘇木素染色1 min,藍化,梯度乙醇脫水,二甲苯透明,封片。組織芯片SAPCD2的表達情況采用半定量評估的方法[10],免疫組織化學染色的評分標準如下:①按照染色強度計分:陰性為0分,弱陽性為1分,中等陽性為2分,強陽性為3分;②按陽性細胞的百分比計分:陽性細胞百分比0為0分,1%~25%為1分,26%~50%為2分,51%~75%為3分,大于75%為4分。將兩項得分結果相加:0~3分為低表達,4~12分為高表達。
1.2.2細胞培養、轉染以及穩定細胞株的構建 轉染前1 d將處于對數生長期的RKO細胞接種到6孔板上,5×104個細胞/孔,待細胞匯合達到20%時;吸除培養液,加入含病毒的培養液;12 h后更換為常規培養基繼續培養;以pLV-shRNA SAPCD2為陽性對照,pLV-shControl為陰性對照,72 h后通過熒光顯微鏡觀察,熒光率達到80%時,細胞狀態正常,收集兩組RKO細胞,通過RT-PCR檢測兩組細胞中SAPCD2敲減的效果。
1.2.3MTT實驗 將處于對數生長期的兩組細胞以2.5 g/L胰酶消化,完全培養基重懸成細胞懸液,并以1 000個細胞/孔接種到96孔培養板上;待細胞完全沉淀以后,以2 h間隔在顯微鏡下觀察兩組RKO細胞的密度,置于37 ℃、含體積分數0.05的CO2培養箱中培養過夜;細胞貼壁后吸除培養液,每孔中加入5.0 g/L的MTT 20 μL;培養4 h后徹底吸除培養液,每孔加入100 μL的DMSO,然后振蕩5 min,用酶標儀于波長490 nm處檢測各接種板的吸光度(A)值;實驗連續測定5 d,重復3次。
1.2.4克隆形成實驗 將處于對數生長期的兩組細胞以2.5 g/L的胰酶消化,完全培養基重懸成細胞懸液,并以1 000個細胞/孔接種于用6孔板培養板中,每隔3 d進行換液并觀察細胞狀態,在培養箱中持續培養8 d,吸除培養液;每孔加入體積分數為0.04的多聚甲醛1 mL,固定細胞30 min;每孔加入GIEMSA染液500 mL,染色20 min;用ddH2O洗滌細胞數次至洗脫液無色,晾干、拍照、克隆計數,實驗重復3次。
1.2.5Celigo細胞計數檢測 將上述的兩組細胞以2.5 g/L胰酶消化,完全培養基重懸成細胞懸液并計數;以1 000個細胞/孔接種到96孔培養板上,然后于37 ℃、含體積分數0.05 CO2培養箱中培養過夜;通過Celigo儀器檢測讀板1次,連續檢測讀板5 d;對數據進行統計繪圖,繪制出5 d的細胞生長曲線。
1.2.6細胞周期實驗檢測 將兩組細胞接種到6孔板上,細胞覆蓋率達到80%時以2.5 g/L的胰酶消化,離心后收集細胞;用4 ℃預冷的D-Hanks(pH 7.2)洗滌后,離心;以4 ℃的含體積分數0.75乙醇固定細胞1 h后離心并洗滌細胞沉淀;加入PI細胞染液500 μL重懸,37 ℃孵育30 min,通過流式細胞儀檢測細胞周期。
2 結 果
2.1 SAPCD2在各組織中的表達
與結直腸正常黏膜組織相比,SAPCD2在結直腸癌組織中的表達明顯增高(圖1)。結直腸癌組織中SAPCD2的表達與正常黏膜組織、腺瘤組織比較,差異有顯著性(Z=-7.377、-6.204,P<0.01);而在相對正常黏膜及腺瘤組織中的表達差異無顯著性。見表1。對13例匹配的結直腸相對正常黏膜、腺瘤及結直腸癌組織三組相關樣本分析,結果仍顯示,結直腸癌組織中SAPCD2的表達與正常黏膜組織、腺瘤組織比較,差異具有顯著性(χ2=14.170,P<0.05)。見表2。108例結直腸癌病人的臨床病理資料顯示,SAPCD2的表達與腫瘤的浸潤深度相關(χ2=6.402,P<0.05)。見表3。
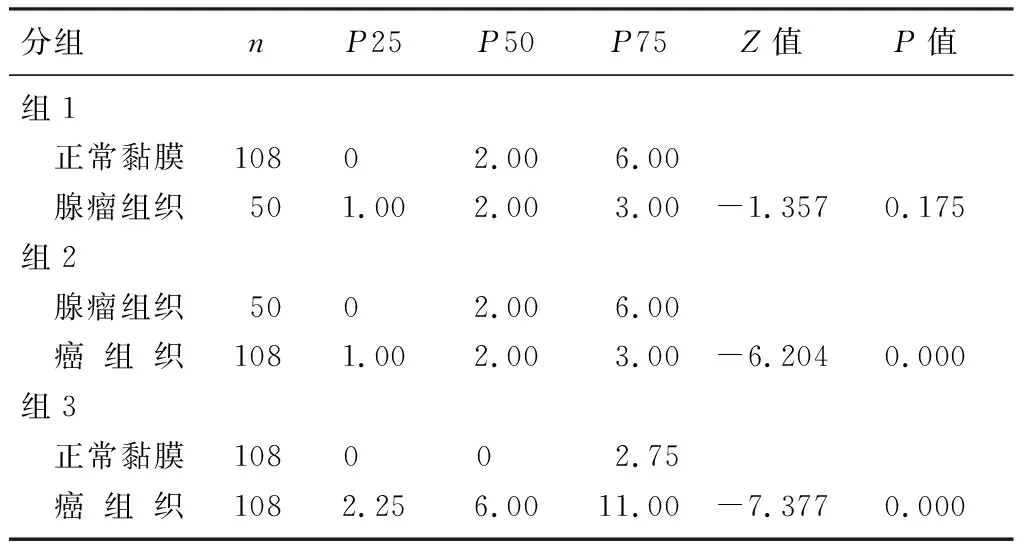
表1 結直腸癌、正常黏膜組織與腺瘤組織中SAPCD2表達
組1與組2采用非參數Mann-Whitney檢驗,組3采用非參數Wilcoxon檢驗。
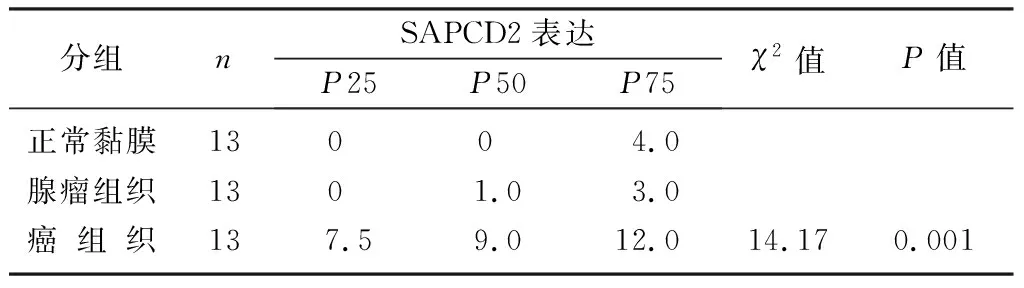
表2 正常黏膜、腺瘤與結直腸癌組織中SAPCD2的表達
采用非參數Friedman檢驗。其中SAPCD2在正常黏膜與腺瘤組織的表達無顯著差異。
2.2 敲減SAPCD2后人結腸癌RKO細胞的增殖和克隆形成能力
經shRNA慢病毒感染后,定量PCR檢測顯示,RKO細胞中SAPCD2 mRNA的表達水平明顯降低(t=9.030,P<0.05)。MTT實驗結果顯示,第3~5 d與shControl組相比,SAPCD2敲減后細胞的增殖速度明顯減慢(t=70.231~244.000,P<0.05)。見表4。克隆形成實驗結果顯示,shControl組及shSAPCD2組細胞克隆數分別為240±6、68±4,SAPCD2敲減后細胞形成克隆的數量顯著減少(t=142.558,P<0.05)。見圖2。Celigo實驗結果顯示,第2~5天,與shControl組相比較,SAPCD2敲減后細胞生長能力受到了明顯抑制(t=4.856~22.869,P<0.05)。見圖3、表5。
2.3 敲減SAPCD2對人結腸癌RKO細胞細胞周期的影響
流式細胞儀檢測結果顯示,SAPCD2敲減后,RKO細胞G1期構成比為(59.18±0.32)%,S期構成比為(21.92±0.31)%,G2/M期構成比為(18.90±0.14)%;shControl組RKO細胞G1期的構成比為(52.19±0.73)%,S期的構成比為(29.88±0.82)%,G2/M期構成比為(17.93±0.54)%。與shControl組相比,敲減SAPCD2后RKO細胞處于S期的細胞顯著減少(t=22.378,P<0.05),處于G1期的細胞顯著增多(t=-26.368,P<0.05)。見圖4。
3 討 論
有研究表明,SAPCD2作為與細胞周期調控相關的新近發現的基因,只在腫瘤中表達而不在成人正常組織中表達,這種分子很可能是結直腸癌進展過程中重要的潛在的標記物,起到致癌基因的作用[2]。然而,SAPCD2對結直腸癌細胞增殖和遷移能力的影響還存在爭議[2,10-12]。因此,我們對結直腸癌標本及結腸癌細胞系進行研究,探索SAPCD2在結直腸癌發生發展過程中的作用以及其對結腸癌RKO細胞增殖能力的影響。
表3結直腸癌組織中SAPCD2表達與臨床病理參數的關系(例(χ/%))
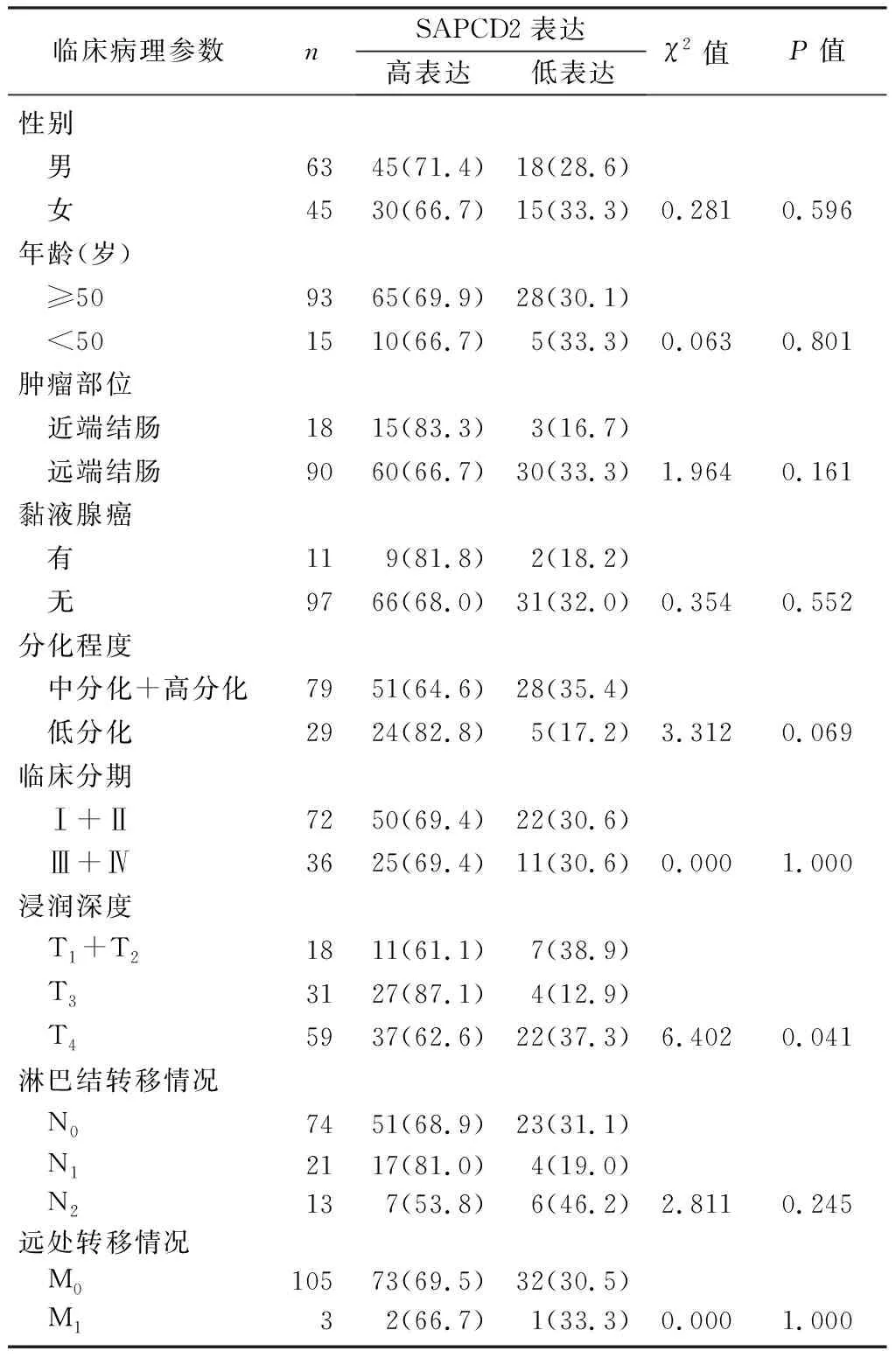
臨床病理參數nSAPCD2表達高表達低表達χ2值P值性別 男6345(71.4)18(28.6) 女4530(66.7)15(33.3)0.2810.596 年齡(歲) ≥509365(69.9)28(30.1) <501510(66.7)5(33.3)0.0630.801 腫瘤部位 近端結腸1815(83.3)3(16.7) 遠端結腸9060(66.7)30(33.3)1.9640.161 黏液腺癌 有119(81.8)2(18.2) 無9766(68.0)31(32.0)0.3540.552 分化程度 中分化+高分化7951(64.6)28(35.4) 低分化2924(82.8)5(17.2)3.3120.069 臨床分期 Ⅰ+Ⅱ7250(69.4)22(30.6) Ⅲ+Ⅳ3625(69.4)11(30.6)0.000 1.000 浸潤深度 T1+T21811(61.1)7(38.9) T33127(87.1)4(12.9) T45937(62.6)22(37.3)6.402 0.041 淋巴結轉移情況 N07451(68.9)23(31.1) N12117(81.0)4(19.0) N2137(53.8)6(46.2)2.811 0.245遠處轉移情況 M010573(69.5)32(30.5) M1 32(66.7)1(33.3)0.000 1.000
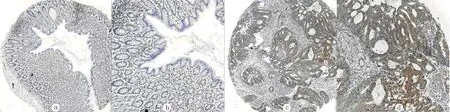
a、b:結直腸正常黏膜組織,分別為100、200倍;c、d:結直腸癌組織,分別為100、200倍。
表5 SAPCD2基因敲減對RKO細胞生長能力的影響
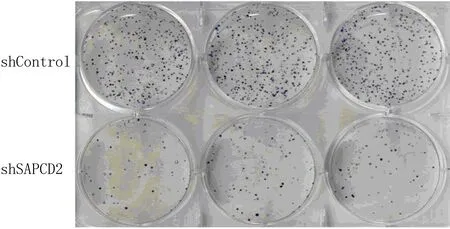
圖2 SAPCD2基因敲減對RKO細胞克隆形成能力的影響
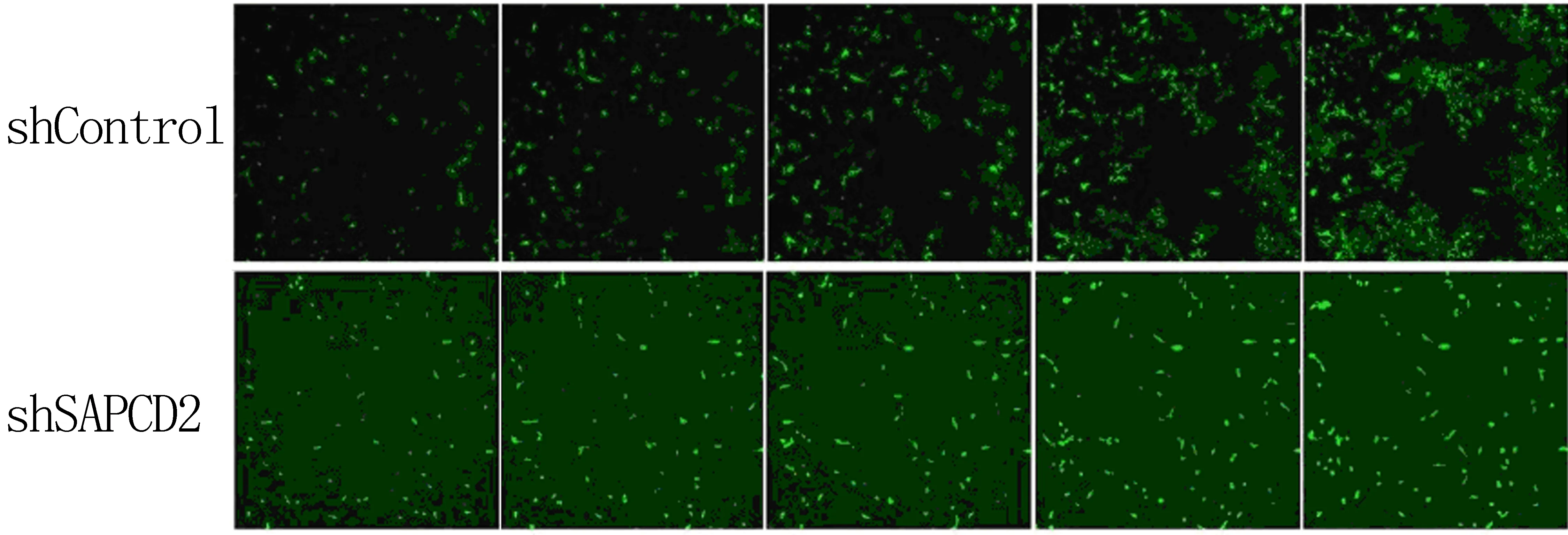
圖3 SAPCD2基因敲減對RKO細胞生長能力的影響
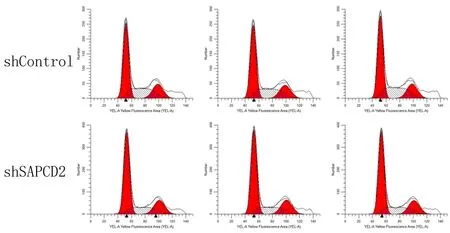
圖4 SAPCD2基因敲減對RKO細胞細胞周期的影響
本研究結果顯示,與結直腸正常黏膜相比,SAPCD2在結直腸癌組織中的表達明顯增高,與相關的研究結果一致[2,10]。這說明SAPCD2的表達與結直腸癌的發生有著一定的關系,很可能是結直腸癌中一種新的潛在的標記物,但先前研究并未對SAPCD2在腺瘤中的表達進行深入探討。而本研究結果顯示,腺瘤中SAPCD2的表達與結直腸正常黏膜無明顯差異,但與結直腸癌的表達卻有顯著性差異,SAPCD2的高表達發生在腺瘤產生之后,因此SAPCD2有可能是腺瘤癌變的一個啟動基因,在腺瘤中進行SAPCD2的早期檢測或許可以在一定程度上預測結直腸癌變的發生。對于SAPCD2在結直腸腺瘤惡變中的預測價值,仍需要進一步的研究。
SAPCD2與結直腸癌的臨床病理特征的相關性在不同的研究中結果尚存在差異。WENG等[10]的研究表明,SAPCD2在結直腸癌中的表達與病人年齡、性別、腫瘤的部位、腫瘤分化程度及淋巴結轉移有關;YUAN等[2]研究顯示,SAPCD2在結直腸癌中的表達只與腫瘤分化程度有關。本研究結果顯示,SAPCD2的表達只與腫瘤的浸潤深度有關,而與病人年齡、性別、腫瘤部位、腫瘤分化程度、淋巴結是否轉移等無關。這些差異有可能是樣本人群年齡、性別分布、環境因素、檢測方法和樣本含量等的差異導致的,SAPCD2與臨床病理特征的相關性還需要大樣本量的研究進一步證實。
目前SAPCD2在結直腸癌中的分子機制及相關信號轉導通路尚未闡明[13]。WENG等[10]研究發現,SAPCD2誘導結直腸癌細胞侵襲依賴于上皮-間質間的轉化,通過增強STAT5與EZH2、β-catenin間相互作用進而加強對細胞的浸潤;同時研究發現MiR-29a能夠通過抑制SAPCD2阻滯細胞周期進而阻遏胃癌細胞的增殖[8]。YUAN等[2]研究認為,MiR-29a作為抑癌基因,在腫瘤中的表達普遍下調,在胃癌中可以通過抑制SAPCD2阻滯細胞周期,因此在結直腸癌中也可能通過抑制SAPCD2進而抑制細胞的增殖和侵襲。而且相關的研究發現,SAPCD2在胃癌細胞G1期和M期的表達明顯增高,在G2期和S期的表達迅速減少[7,9];MAO等[4]研究結果發現,SAPCD2在NIH3T3細胞G1早期和M期大量表達,在G1晚期、S期和G2期表達減少。本研究結果顯示,敲減SAPCD2后G1期細胞顯著增多,而S期的細胞顯著地減少,說明敲減了SAPCD2可顯著抑制人結腸癌RKO細胞的細胞周期中G1/S期的轉換。細胞周期是細胞增殖與生長的關鍵調節因素,因此提示SAPCD2不僅能導致細胞的惡性轉化,并能促進有絲分裂的加速和染色體的分離[4]。但XIONG等[11]研究顯示,結直腸癌上皮-間質間的轉化與STAT3、ZEB1的下調等有關,敲除STAT3可明顯增加E-cadherin水平,同時降低N-cadherin,從而抑制結直腸癌中細胞侵襲性;而WENG等[10]認為,STAT3的敲除對SAPCD2沒有任何影響。因此,SAPCD2在結直腸癌中的分子機制及相關信號轉導通路仍需進一步研究。
綜上所述,本研究結果顯示,SAPCD2的表達與結直腸癌的發生有著一定的關系,很可能是結直腸癌中一種新的潛在的標記物;SAPCD2在腺瘤與結直腸癌中表達的顯著差異說明其有可能是腺瘤癌變的一個啟動基因,在腺瘤中檢測SAPCD2的表達情況或許可以在一定程度上預測腺瘤惡變的發生。另外,本研究通過體外細胞系實驗也進一步證明,沉默SAPCD2可以抑制結腸癌RKO細胞的增殖能力。這些結果都說明SAPCD2在結直腸癌進展過程中扮演著重要的角色。

