南淝河表層沉積物細菌群落結構特征及驅動因素
楊長明,吳亞瓊,王育來,郭韻昊
?
南淝河表層沉積物細菌群落結構特征及驅動因素
楊長明1*,吳亞瓊1,王育來2,郭韻昊1
(1.同濟大學教育部長江水環境重點實驗室,上海 200092;2.安徽工業大學能源與環境,安徽 馬鞍山 234000)
為了探討南淝河不同河段沉積物細菌群落結構特征差異及其主要驅動因素,在對南淝河不同土地利用區域河段表層沉積物的主要理化指標(pH、CEC、TOC、DOC、氮分級形態)進行分析基礎上,重點通過MiSeq高通量測序技術對沉積物中細菌群落結構特征進行了分析,并利用冗余分析(RDA)方法探討了導致群落結構差異的主要驅動因素.結果表明:沉積物中門水平下優勢細菌種群為變形菌門(Proteobacteria)、綠彎菌門(Chloroflexi)和擬桿菌門(Bacteroidetes);綱水平下除未分類外主要是厭氧繩菌綱(Anaerolineae)、γ-變形菌綱(Gammaproteobacteria)、梭狀芽胞桿菌綱(Clostridia)、δ-變形菌綱(Deltaproteobacteria),此外ε-變形菌綱(Epsilonproteobacteria)主要在南淝河下游采樣點被檢測到,說明其在南淝河沉積物生態系統中并不是普遍存在的;屬水平下大多為未分類序列,長繩菌屬()和芽孢桿菌屬()有優勢地位.南淝河不同河段所在流域土地利用方式不同會導致污染物類型、污染源強和沉積物理化指標的不同,進而影響沉積物細菌群落結構,中游城區和工業區段的細菌多樣性整體上高于上、下游;RDA分析結果表明,表層沉積物的CEC、TOC、DOC、TP、WAEF-N和IEF-N是導致細菌群落結構特征差異的主要影響因子,其中變形菌門、擬桿菌門和厚壁菌門受TP影響較大,綠彎菌門則受弱酸浸取態氮(WAEF-N)影響較大.
南淝河;表層沉積物;細菌群落結構;MiSeq高通量測序;冗余分析(RDA)
城市河流沉積物是陸源污染物(營養物、重金屬、有機污染物等)的主要儲存場所[1].沉積物是城市重污染河流內源污染的重要來源,具有產生二次污染的潛在危險,其特殊的生境條件使其具有豐富的微生物資源,而微生物是沉積物和上覆水進行物質循環的重要驅動力[2].微生物在城市內河沉積物物質循環及污染物釋放過程中發揮重要作用,其群落結構特征也能夠作為評估城市河道污染負荷與河流生態系統整體健康狀態的主要根據[3].
傳統的環境微生物研究方法主要依賴分離和培養,不能很好地揭示微生物的群落結構,因此分子生物學研究方法逐漸被大量采用.已有學者運用PCR-DGGE[4]、T-RFLP[5-6]等技術研究了沉積物微生物群落結構分布,然而近些年高通量測序技術被廣泛應用,該技術不僅數據通量大,而且準確度相對較高.部分學者運用高通量測序技術對程海[7]、太湖[8]等水體的沉積物細菌群落結構進行了分析,但應用該技術對跨越不同土地利用類型,并具有復雜污染源強的城市型河流沉積物細菌群落結構及其主要驅動因子的研究還鮮有報道.
南淝河為巢湖的一條重要入湖河流,其上游植被覆蓋以林地為主,中游主要為老城區和工業園區,下游主要是郊區、農田和濕地,土地利用方式呈現多樣化格局.南淝河水體污染狀況嚴峻,水質為劣V類,前期政府部門實施了一些治理工程,包括城市污水管網建設和改善工程、污水廠擴建和提標工程,這在一定程度上較好地管理和控制了外源污染輸入,然而南淝河的水體水質并沒有很大的提高,這和沉積物內源污染物的不斷釋放密切相關[9].已有學者研究了南淝河沉積物有機污染物分布和生態風險[10]、水環境質量[11]、不同形態磷含量分布[12]以及不同季節異養細菌的總量[13],但對細菌群落結構特征及其與理化指標關系的相關報道較少.
本研究在對南淝河表層沉積物基本理化指標進行分析的基礎上,利用MiSeq高通量測序技術對南淝河沉積物細菌群落結構特征和多樣性進行分析,并將細菌門群落結構、多樣性指標和沉積物基本理化指標進行冗余分析,進而全面闡明南淝河沉積物微生物群落結構特征及其主要的驅動因素,為今后利用分子生物學手段評價和指示沉積物污染特征和河流健康水平提供一定的依據.
1 材料與方法
1.1 樣品采集與處理
南淝河是流經合肥市的巢湖一級支流,主河道全長70km,上游為森林公園,中游流經合肥主城區,下游流域主要為農田和濕地, 沿岸分布有較多碼頭.研究區域位于整個南淝河(北緯31.69°~31.88°,東經117.22°~117.42°),考慮到研究區域內土地利用類型以及排口類型的不同所導致的入河污染負荷和組成可能存在差異,本研究分別選擇城市雨水排口、垃圾填埋場、雨污合流排口、污水廠尾水排口、泵站、船舶加油站以及支流匯入口(農業排水)等共17個采樣點,各采樣點位置及所在流域基本信息如圖1和表1所示.
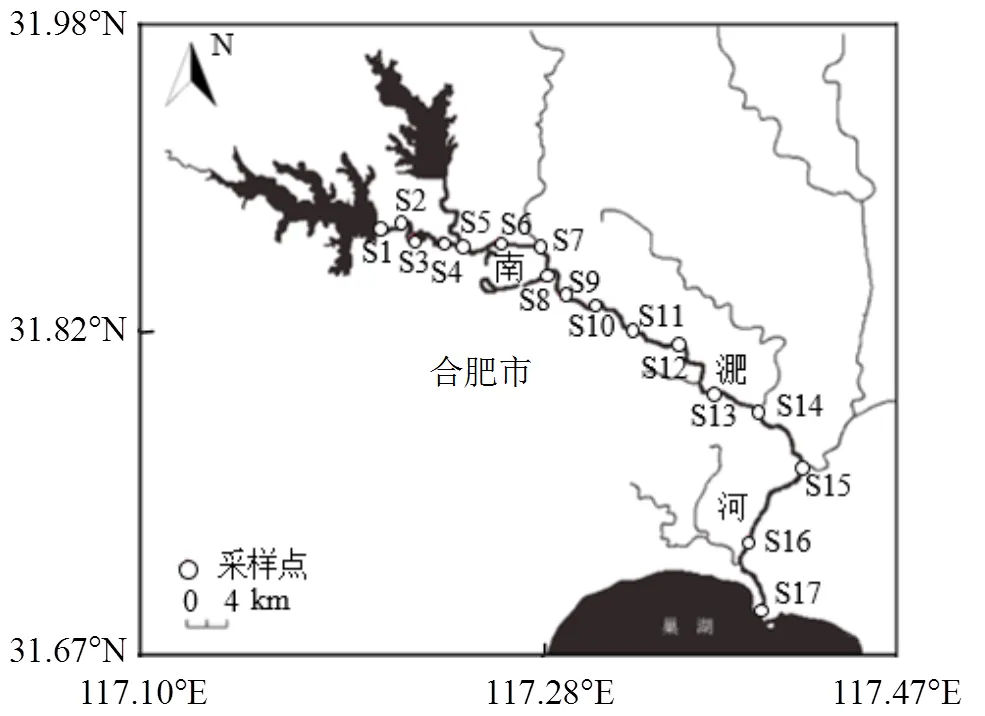
圖1 南淝河沉積物采樣點空間分布

表1 不同沉積物采樣點基本概況
于2016年3月分別采集17個樣點的表層沉積物樣品和上覆水樣,表層沉積物采用抓斗采樣器(采樣深度0~10cm),每個采樣點采集3個沉積物樣并混合均勻,新鮮樣采集后裝于聚乙烯封口袋中并編號,放入冷藏箱帶回實驗室,一部分樣品冷凍干燥研磨后過100目篩,置于聚乙烯封口袋中并在避光狀態下低溫保存,用于理化指標分析;一部分樣品凍存(-20℃)以備后續微生物群落結構分析;同時收集上覆水,采用便攜式參數水質分析儀(哈希SensIon156,美國)現場測定pH值和溶解氧(DO),其余指標在實驗室內測定.
1.2 樣品分析
1.2.1 樣品理化指標的測定 上覆水的總磷(TP)使用鉬酸銨分光光度法(GB 11893-89),總氮(TN)使用堿性過硫酸鉀消解紫外分光光度法(HJ 636- 2012),氨氮(NH4+-N)使用納氏試劑分光光度法(HJ 535-2009),葉綠素a使用丙酮法.沉積物的pH值用酸度計(pHS-3C型)測定,陽離子交換量(CEC)采用氯化鋇-硫酸強迫交換法測定,總有機碳(TOC)和溶解性有機碳(DOC)用總有機碳測定儀(島津TOC- VCPH系列)測定,TP采用堿熔-鉬銻抗分光光度法(HJ 632-2011)測定. 沉積物中的4種可轉化態氮(TF-N)分為離子交換態氮(IEF-N)、弱酸浸取態氮(WAEF-N)、強堿浸取態氮(SAEF-N)和強氧化劑浸取態氮(SOEF-N),采用王圣瑞等[14]的連續分級提取的方法測定.
1.2.2 沉積物細菌群落結構分析 沉積物樣品DNA的提取: 本研究沉積物基因組DNA的提取采用OMEGA土壤提取試劑盒進行提取,利用瓊脂糖凝膠電泳檢測DNA完整性,并采用Qubit2.0DNA檢測試劑盒準確測定基因組DNA的含量,以確定PCR反應應該加入的DNA量.
PCR擴增:選用V3~V4區的引物對提取的DNA進行PCR擴增,引物序列(5’-3’)如下:341F (CCCTACA-CGACGCTCTTCCGATCTG),805R(GACTGGAGTTCCTTGGCACCCGAGAATTCCA),并利用barcode區別樣品序列.PCR反應條件為:95℃預變性30s;95℃ 15s,55℃ 15s,72℃30s,5個循環;72℃5min.PCR產物進行瓊脂糖凝膠電泳檢測,并用PCR產物純化試劑盒純化.
MiSeq高通量測序高通量測序:擴增后的細菌DNA進行宏基因組建庫、測序,然后對所得的數據進行生物信息學分析.擴增區域為 V3~V4 (引物為341F, 805R);基于MiSeq 2x300測序平臺的高通量測序由生工生物工程(上海)股份有限公司測定完成,該測序平臺單次運行可完成15Gb的數據測序,最大讀長2′300bp,片段數單端25M,雙端50M.對各樣品序列做質量控制,去除短片段和低復雜度序列,使用Mothur軟件去除非靶區域序列和嵌合體.
1.3 數據處理與統計分析
試驗數據采用Excel 2010和SPSS 19.0統計軟件進行處理,所有試驗數據通過ANOVA變異分析程序進行統計分析,采用鄧肯新復檢驗法對采樣點上覆水、沉積物理化指標差異進行統計估計,在<0.05的概率水平視為顯著.
在相同測序深度下采用Uclust軟件進行操作分類單元(OUT)聚類;使用Mothur軟件分析多樣性,計算Shannon指數、ACE指數、Chao指數、Coverage指數和Simpson指數;運用加權重的Unifrac算法進行主坐標分析(PCoA);通過RDP classifier把序列進行物種分類;運用R語言繪制熱圖,并對細菌門和理化指標進行冗余分析(RDA).
2 結果與討論
2.1 不同采樣點上覆水水質特征

表2 不同采樣點上覆水主要水質指標

續表2
由表2顯示,南淝河不同采樣點上覆水pH值變化范圍為7.18~9.02,偏弱堿性;溶解氧(DO)變化范圍為0.15~7.54mg/L,其中共有9個樣本溶解氧含量遠小于2mg/L,且多集中在中游城區段;葉綠素(chl-a)變化范圍為0.01~0.06mg/L.總氮(TN)含量為32.20~ 51.84mg/L;氨氮(NH3-N)為0.69~12.69mg/L;總磷(TP)含量普遍較高,其變化范圍分別為和0.25~ 2.54mg/L.結合國家地表水環境質量標準(GB3838- 2002),南淝河各采樣點上覆水水質指標均未達到地表水V類標準,流經合肥老城區的中游河段水質較差,特別是NH3-N含量顯著高于上游和下游河段.
2.2 不同采樣點沉積物理化特征
采用SPSS軟件對上、中、下游的理化指標進行顯著性差異分析表明(表3),南淝河上、中、下游表層沉積物CEC、TOC、IEF-N和WAEF-N差異顯著(<0.05).pH值變化范圍為7.24~8.04,偏弱堿性,而通常微生物通過代謝活動對有機質進行分解,釋放出的CO2和有機酸理論上會使pH值偏弱酸性,但所有樣本點pH值均偏弱堿性,這可能是因為采樣點區域支流眾多,彼此之間有較強的水力聯系,有機質降解所產生的酸會受到稀釋,且人類活動頻繁,pH值則會更多地受周圍工業廢水和生活污水排入的影響.CEC表征了沉積物膠體的物理化學吸附性能,對生源要素在沉積物和上覆水界面的轉化過程具有重要影響,南淝河各采樣點CEC變化范圍為30.98~155.07cmol/kg,在一定程度上表征了南淝河沉積物具有較好的緩沖性能,其中S12的CEC值最高,可能是因為該點為農業集中區,眾多農業活動可能會產生影響.
沉積物TOC可以較全面地反映水體受有機物污染的程度,其來源可能是水體自養生物的合成和陸源性污染物質的輸入[15].南淝河不同采樣點TOC含量變化范圍為12.67~71.34g/kg,其中S9的TOC含量最高,可能是因為該點為污水廠尾水排放口,外源輸入的有機質含量較高;且中游TOC的含量明顯高于上、下游,表明南淝河市中心附近的有機污染情況加重;位于橡膠壩后的S11~S17樣點,TOC含量相對較低,可能是由于水流較快,沉積物泥沙含量較高.DOC含量變化范圍為0.253~1.124g/kg,其中南淝河中游采樣點表層沉積物DOC最高,上游次之,而下游普遍較低.特別是位于中游的王小郢污水廠尾水排放口S9的DOC高達1.124g/kg,位于望塘污水處理廠尾水排口S4的DOC含量也比較高,可能是因為污水廠尾水排放對沉積物DOC具有一定的積累效應.
磷是水體富營養化的主要限制性營養元素,沉積物是水體中磷的主要貯存場所.南淝河不同采樣點表層沉積物TP變化范圍為785.58~3384.4mg/kg,平均為2107.4mg/kg,遠高于與之相鄰的十五里河沉積物[16],說明該區域沉積物中磷對水體有較高的污染風險. S16采樣點沉積物TP最高,可能是因為該點位于下游農業集中區,受農業面源污染影響較大,加上該采樣點位于店埠河入南淝河河口,而該支流上游有一家大型磷礦企業,其生產排水可能會造成該采樣點磷的累積.
有研究表明,沉積物中不同形態氮的環境地球化學行為存在差異[17].南淝河沉積物中可轉化態氮含量的關系為SOEF-N>WAEF-N>SAEF-N>IEF-N.有研究表明,SOEF-N含量和有機質及沉積物的氧化還原環境相關性較大,沉積物生境的還原性越強,對有機質的保存越有利,礦化作用越弱,SOEF-N的含量越大[18];WAEF-N的產生和分布主要受碳酸鹽和pH的影響[19];SAEF-N的形成及分布受沉積物氧化還原環境的影響較大,當水-沉積物界面為還原狀態時容易釋放并參加氮循環系統[20].除了位于雨水泵站排口的S6和S8兩個采樣點外,各采樣點中IEF-N是所有可轉化態氮形態中含量最低的,可能是該形態氮更容易從沉積物中釋放[21].

表3 南淝河采樣點表層沉積物理化指標
2.3 不同采樣點沉積物細菌群落結構特征

圖2 不同采樣點沉積物OTU數量分布
2.3.1 測序結果分析 南淝河17個樣本共得到365547條有效序列,并在97%相似值下進行OTU聚類,共獲得49611種OTU,如圖2所示.其中S3,S4,S5,S6,S7,S9,S12,S13樣本中OTU數目相對較高,S4和 S9均為尾水排口,數量基本一致且較高;S13為污水廠排口加大型碼頭,有明顯的污水入河,所以OTU數量最多;S12為農業集中區,僅次于S13;整體而言中游河段細菌菌種數量相對于上、下游較高.S8有明顯的下降,可能是因為其所在位置有雨水泵站,起到稀釋作用,導致附近水體中營養物質含量較低;S10、S11處也有所下降,可能是因為S10處有橡膠壩,且該位置開始進入郊區,人口密度降低,土地利用強度下降,入河污染負荷減弱.
2.3.2 樣品多樣性分析 (1)α多樣性分析:由表4可知,不同采樣點沉積物Shannon指數在7.38~8.22之間,ACE指數在21421.72~55107.90之間,Chao1指數在13354.83~25658.03之間.中游樣本點的Shannon、ACE、Chao1指數相對上、下游較高,說明中游城區段的細菌多樣性較高,其中S4多樣性最高,該采樣點為望塘污水廠尾水排口,可能是因為該點營養鹽含量較高且有利于微生物的生存,S16的Shannon指數最低,這可能與該位點處于南淝河下游且為農業和工業集中區,有毒有害物質較多;各樣點沉積物細菌Simpson指數變化范圍為0.0008~0.0035,總體變化不大,處于輕微的波動,表明優勢種群更替不明顯;除S2外,測序的覆蓋率均在74%~84%之間,雖然并沒有達到100%的覆蓋率,但是測序結果對樣本的解釋仍然在可信范圍內,測序深度已經反映出該沉積物中大多數的細菌類群.

表4 各采樣點沉積物α多樣性指數統計
(2) β多樣性分析:選取對樣本解釋度最高的3個成分分析其樣本間的差異,通過PCoA分析結果可以明顯看出17個樣本中分布關系相近的類群傾向于聚在一起(圖3).其中,S1、S14、S15、S16、S17距離較近,S3、S6、S11、S12、S13距離較近,S4、S5、S7、S8、S9、S10相對集中,S2異質性較高,整體而言,各樣本間的細菌群落結構存在差異,且中游段位點間差異較上、下游相對較小.
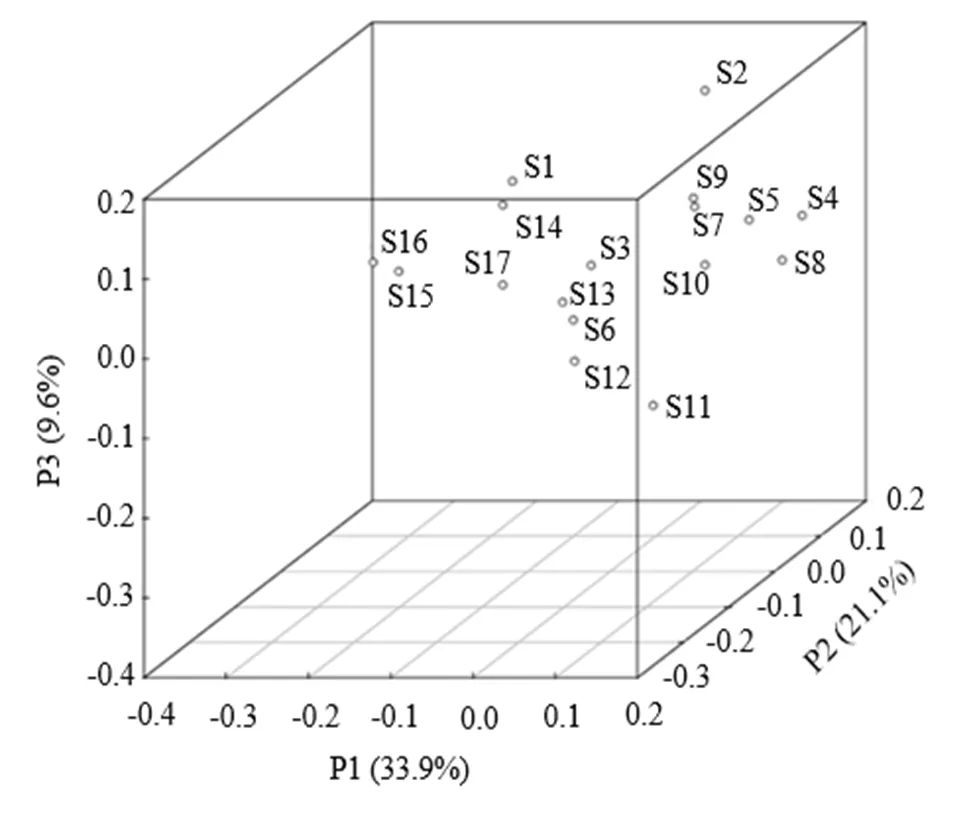
圖3 不同采樣點沉積物主坐標分析
2.3.3 細菌群落結構分析 (1)門水平下細菌群落結構
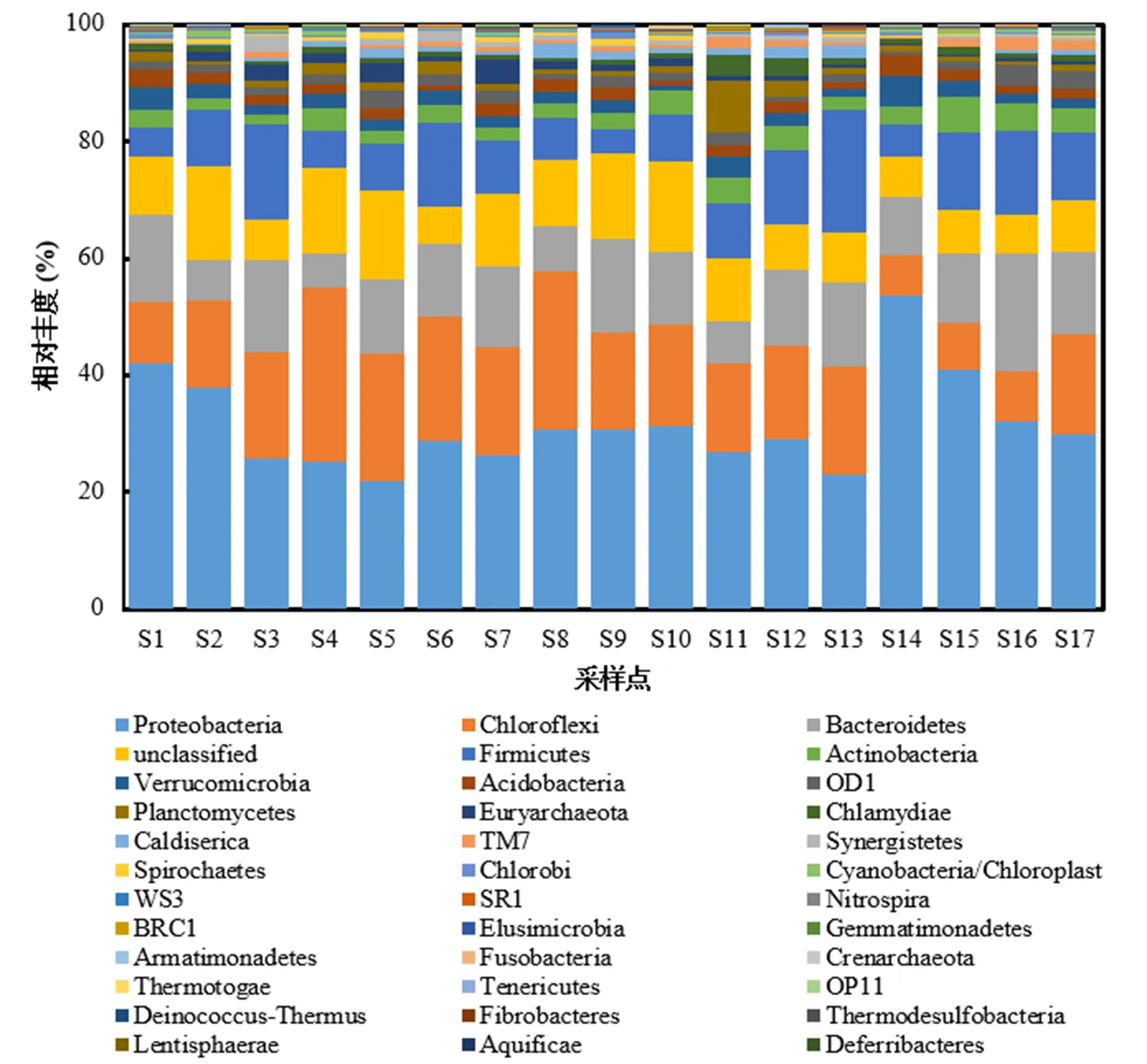
圖4 沉積物樣品中門水平所有樣本菌群分布
圖4為南淝河不同采樣點表層沉積物門水平下細菌群落結構.由圖4可知,沉積物中門水平主要有35個細菌門,其中最優勢細菌類群為變形菌門(相對豐度為21%~54%),其次是綠彎菌門(相對豐度為6%~30%)、擬桿菌門(相對豐度為5%~20%)、厚壁菌門(相對豐度為4%~20%),這些細菌門在滇池[22]、太湖[23]、水庫[24]等中也有發現;同時放線菌門、疣微菌門、酸桿菌門、浮霉菌門、衣原體、互養菌門、藍藻門等均有發現.此外,S14樣本點變形菌門含量達到了50%以上,可能與處于重度污染的二十埠河的匯入有關;S4是唯一綠彎菌門含量比變形菌門含量高的采樣點,可能是因為望塘污水廠尾水水質與其他樣點水質存在差異.
(2)綱水平下細菌群落結構:圖5為南淝河不同采樣點表層沉積物綱水平下細菌群落結構.由圖5可知,沉積物中綱水平主要有49個類群,其中厭氧繩菌綱、γ-變形菌綱、梭狀芽胞桿菌綱、δ-變形菌綱為優勢菌群,其次含量較高的有β-變形菌綱(Betaproteobacteria)和α-變形菌綱(Alphaproteobacteria),且只在S3、S15、S16、S17樣本中發現了ε-變形菌綱,說明其在南淝河沉積物中并不是普遍存在,可能與某種特殊污染物有關.過去研究表明在受碳氫化合物尤其是多環芳烴(PAHs)污染的Apapa沉積物中,ε-變形菌綱的豐度最高[25]. γ-變形菌綱則是太湖富營養化嚴重時的優勢菌群[26].
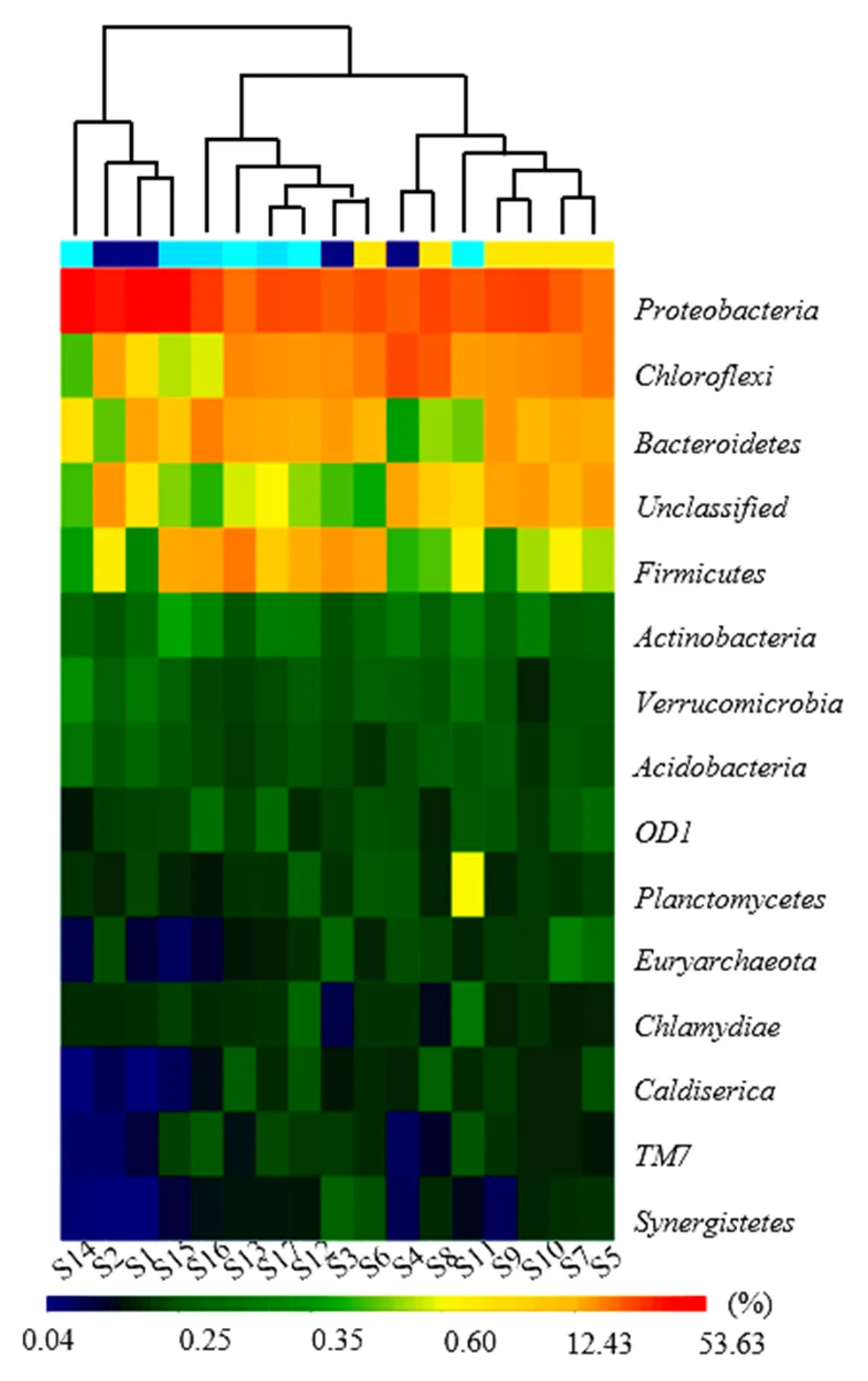
圖6 沉積物樣品中屬水平物種豐度
(3)屬水平下細菌群落結構:將樣本和屬水平下的菌群信息進行聚類后繪制熱圖(圖6),如圖6所示,南淝河表層沉積物中屬于綠彎菌門中厭氧繩菌綱的、、,屬于變形菌門中γ-變形菌綱的、δ-變形菌綱的、β-變形菌綱的,屬于擬桿菌門中鞘脂桿菌綱的、黃桿菌綱的豐度相對較高. Bai等[25]利用454高通量測序技術發現在有機污染重的滇池草海中和為優勢菌群.此外,S5、S7、S8、S11、S12和S2、S9、S10以及S4聚為一類,S3、S6、S13和S15、S16、S17以及S1、S14聚為一類,整體上屬水平下中游河段沉積物細菌群落結構相似性較高.
2.4 細菌群落結構與理化指標的相關性分析
將門水平下樣本中的細菌物種與沉積物的理化指標進行RDA分析,結果如圖7所示.第一軸的主要影響因子是CEC、TP、WAEF-N、IEF-N和DOC,第二軸的主要影響因子是TOC和DOC, 即說明CEC、TOC、DOC、TP、WAEF-N和IEF-N對南淝河沉積物中的細菌群落結構影響較大.過去也有研究表明,有機質、TOC、TN、TP以及C/N是影響細菌群落結構的主要因子[27-30],本研究結果總體與上述相似,但與Wu等[31]對有機碳的分析結果存在差異.另外,本研究通過不同形態氮與細菌群落結構的RDA分析結果顯示,WAEF-N對細菌群落結構影響最大.

圖7 門水平下沉積物RDA分析
由圖7還可發現,17個樣本點分布相對離散,說明微生物群落結構特征存在差異,且距離原點較遠,說明受理化指標影響較大;其中,S4、S8和S7的細菌群落結構特征與TOC和DOC呈正相關;S1、S9、S15和S17細菌群落結構相似,聚集在第二象限,受pH值影響較大;S14則主要受SAEF-N 影響;S2和S11主要與WAEF-N、IEF-N呈正相關;S5和S13主要與CEC呈正相關;S3、S6、S10和S12聚集于第一象限,主要與TP呈正相關,其中S6和S10的相對位置距離較近,說明相似度較高,二者均設有泵站或橡膠壩等水利設施,可能有利于有機質的積累與微生物的增長.此外,除相對豐度較高的4種細菌外,絕大部分菌種聚集分布在靠近原點的位置,說明它們之間有較強的依存關系,且理化指標對它們的影響較小.但變形菌門相對豐度與TP呈正相關,擬桿菌門和厚壁菌門的相對豐度與TP、CEC、IEF-N和WAEF-N呈正相關, 其中主要影響因子為TP.變形菌門、擬桿菌門和厚壁菌門相對豐度均與TOC和DOC呈負相關;綠彎菌門與WAEF-N、IEF-N、CEC和TP呈正相關,且主要影響因子為WAEF-N. 分析結果進一步表明,沉積物中的優勢細菌群落與部分理化指標關系密切.
3 結論
3.1 南淝河上覆水質為劣Ⅴ類,其中氨氮超標嚴重.不同采樣點表層沉積物樣的CEC、TOC、IEF-N和WAEF-N差異顯著,其中位于中游的老城區河段采樣點TOC和DOC明顯高于上游和下游采樣點;可轉化態氮含量關系為SOEF-N>WAEF-N>SAEF-N>IEF-N,其中SOEF-N是沉積物可轉化氮素中主要形態.
3.2 南淝河中游城區段細菌的多樣性和相似性均高于上、下游;不同采樣點表層沉積物中門水平優勢菌群為:變形菌門、綠彎菌門、擬桿菌門、厚壁菌門;綱水平優勢菌群為厭氧繩菌綱、γ-變形菌綱、梭狀芽胞桿菌綱、δ-變形菌綱;屬水平優勢菌群為長繩菌屬和芽孢桿菌屬.
3.3 RDA分析結果表明,沉積物的CEC、TOC、DOC、TP、WAEF-N和IEF-N為導致細菌群落結構特征差異的關鍵影響因子;此外,變形菌門、擬桿菌門和厚壁菌門受TP影響較大,綠彎菌門則受WAEF-N影響較大.以上結論為今后深入研究沉積物細菌種群與環境因素的關系提供一定參考.
[1] Kevin G T, Philip N O. Sediments in urban river basins: a review of sediment contaminant dynamics in an environmental system conditioned by human activities [J]. Journal of Soils Sediments, 2009,9(4):281-303.
[2] 屈建航,李寶珍,袁紅莉.沉積物中微生物資源的研究方法及其進展 [J]. 生態學報, 2007,6:2636-2641.
[3] 沈 爍,楊長明,成水平.PCR-DGGE分析合肥市塘西河表層沉積物細菌群落結構空間分布特征 [J]. 應用與環境生物學報, 2015, 1:80-87.
[4] 牛鳳霞,吉芳英,趙 艮,等.龍景湖沉積物的細菌群落垂向分布特征.中國環境科學, 2017,37(6):2322-2331.
[5] Zhao D, Huang R, Zeng J, et al. Diversity analysis of bacterial community compositions in sediments of urban lakes by terminal restriction fragment length polymorphism (T-RFLP) [J]. World Journal of Microbiology & Biotechnology, 2012,28(11):3159-3170.
[6] 劉 睿,周孝德.水沙環境變化對季節性多沙河流沉積物菌群特征的影響 [J]. 中國環境科學, 2017,37(11):4342-4352.
[7] 丁 春,盛周君.基于主成分分析法的南淝河水質綜合評價 [J]. 安徽農業科學, 2007,35(35):11583-11584.
[8] 李 慧,曹秀云,宋春雷,等.巢湖及其入湖河流(南淝河)沉積物磷形態與吸附行為的垂直變化 [J]. 長江流域資源與環境, 2012(s2):3-9.
[9] 王永霞.云南高原程海湖沉積物中的細菌多樣性研究 [D]. 昆明:云南大學, 2014.
[10] 蔡林林,周巧紅,王 川,等.南淝河細菌群落結構的研究 [J]. 環境科學與技術, 2012,3:1-6.
[11] 陳 楠.太湖沉積物微生物群落組成與物質循環及藻華爆發的相關性 [D]. 北京:中國農業大學, 2015.
[12] 沈 爍.南淝河不同排口表層沉積物DOM、氮形態及反硝化細菌群落特征 [D]. 上海:同濟大學, 2015.
[13] 鄧 琳,李宏卓,廖達偉,等.南淝河沉積物有機物污染及其生態風險評價 [J]. 環境科學與技術, 2011,8:179-184.
[14] 丁 春,盛周君.基于主成分分析法的南淝河水質綜合評價 [J]. 安徽農業科學, 2007,35(35):11583-11584.
[15] 李 慧,曹秀云,宋春雷,等.巢湖及其入湖河流(南淝河)沉積物磷形態與吸附行為的垂直變化 [J]. 長江流域資源與環境, 2012,(s2): 3-9.
[16] 蔡林林,周巧紅,王 川,等.南淝河細菌群落結構的研究 [J]. 環境科學與技術, 2012,3:1-6.
[17] 王圣瑞,金相燦,焦立新.不同污染程度湖泊沉積物中不同粒級可轉化態氮分布 [J]. 環境科學研究, 2007,20(3):52-57.
[18] Cho Y S,Lee W C, Kim J B, et al. Establishment of environmental assessment using sediment total organic carbon and macrobenthic polychaete community in shellfish farms [J]. Journal of the Korean Society of Marine Environment and safety, 2013,19(5):430-438.
[19] 李如忠,李 峰,周愛佳,等.巢湖十五里河沉積物氮磷形態分布及生物有效性 [J]. 環境科學, 2012,33(5):1503-1510.
[20] 沈洪艷,張綿綿,倪兆奎.鄱陽湖沉積物可轉化態氮分布特征及其對江湖關系變化的響應 [J]. 環境科學, 2015,36(1):87-93.
[21] 馬紅波,宋金明.渤海南部海域柱狀沉積物中氮的形態與有機碳的分解 [J]. 海洋學報, 2002,24(5):64-70.
[22] 王 梅,劉 琰,鄭丙輝,等.城市內河表層沉積物氮形態及影響因素-以許昌清潩河為例 [J]. 中國環境科學, 2014,34(3):720-726.
[23] Wang S, Jin X, Jiao L, et al. Nitrogen fractions and release in the sediments from the shallow lakes in the middle and lower reaches of the Yangtze River area, China [J]. Water, Air, and Soil Pollution, 2008,187(1-4):5-14.
[24] Wang P F, Zhao L, Wang C, et al. Nitrogen distribution and potential mobility in sediments of three typical shallow urban lakes in China [J]. Environmental Engineering Science, 2009,26(10):1511-1521.
[25] Bai Y, Shi Q, Wen D, et al. Bacterial Communities in the Sediments of Dianchi Lake, a Partitioned EutropHic Waterbody in China [J]. Plos One, 2012,7(5):e37796-e37796.
[26] Shao K, Gao G, Qin B, et al. Comparing sediment bacterial communities in the macrophyte-dominated and algae-dominated areas of eutrophic Lake Taihu, China [J]. Canadian Journal of Microbiology, 2011,57(4):263-72.
[27] Zhang H H, Huang T L, Chen S N, et al. Abundance and Diversity of Bacteria in Oxygen Minimum Drinking Water Reservoir Sediments Studied by Quantitative PCR and Pyrosequencing [J]. Microbial Ecology, 2015,69(3):618-629.
[28] Obi C C, Adebusoye S A, Ugoji E O, et al. Microbial Communities in Sediments of Lagos Lagoon, Nigeria: Elucidation of Community Structure and Potential Impacts of Contamination by Municipal and Industrial Wastes [J]. Frontiers in Microbiology, 2016,7(306):1213.
[29] 吳 鑫,奚萬艷,楊 虹.太湖梅梁灣冬季浮游細菌的多樣性 [J]. 生態學雜志, 2006,25(10):1196-1200.
[30] Haller L, Tonolla M, Zopfi J, et al. Composition of bacterial and archaeal communities in freshwater sediments with different contamination levels (Lake Geneva, Switzerland) [J]. Water Research, 2011,45(3):1213-1228.
[31] Saarenheimo J, Aalto S L, Rissanen A J, et al. Microbial Community Response on Wastewater Discharge in Boreal Lake Sediments [J]. Frontiers in Microbiology, 2017,8:1-12.
[32] 王 鵬,肖漢玉,張 華,等.鄱陽湖入湖河口沉積物細菌群落特征 [J]. 中國環境科學, 2018,38(4):1481-1489.
[33] 金 笑,寇文伯,于昊天,等.鄱陽湖不同區域沉積物細菌群落結構、功能變化及其與環境因子的關系 [J]. 環境科學研究, 2017,30(4): 529-536.
[34] Huang W, Chen X, Jiang X, et al. Characterization of sediment bacterial communities in plain lakes with different trophic statuses [J]. Microbiologyopen, 2017,6(5):e00503.
[35] Wu H, Li Y, Zhang J, et al. Sediment bacterial communities in a eutrophic lake influenced by multiple inflow-rivers. [J]. Environmental Science & Pollution Research, 2017:1-12.
Microbial community structure characteristics and its key driving factors in surface sediments along Nanfei River.
YANG Chang-ming1*, WU Ya-qiong1, WANG Yu-lai2, GUO Yun-hao1
(1.Key Laboratory of Yangtze Water Environment of Ministry of Education, Tongji University, Shanghai 200092, China;2.School of Energy and Environment, Anhui University of Technology, Maanshan 234000, China)., 2018,38(9):3552~3561
In order to explore the differences in bacterial community structure and its driving factors in the sediment of Nanfei River, the key physiochemical parameters including pH, CEC, TOC, DOC, and various forms of nitrogen were determined in the surface sediment samples along Nanfei River with different land uses such as urban, suburb, industrial park and rural areas. Specially, sediment bacterial community structure characteristics were analyzed by using MiSeq high-throughput sequencing technology. The relationships between sediment bacterial community structure and aforementioned physiochemical parameters were examined by redundancy analysis (RDA). The results showed that the major bacterial phylum is Proteobacteria in the surface sediments, followed by Chloroflexi, Bacteroidetes, Firmicutes. At the level of class, the major bacterial class are Anaerolineae, Gammaproteobacteria, Clostridia, Deltaproteobacteria besides the unclassified. Epsilonproteobacteria were detected mainly in sediment samples from downstream of the Nanfei River, suggesting that they were not ubiquitous in the sediment ecosystem of the Nanfei River. Most of the genus is unclassified, withandbeing predominant species. Different types of land uses along the Nanfei River led to different pollution sources and discharging load will result in different physicochemical properties of surface sediment, which in turn reshape the bacterial community structure of the sediment. The bacterial diversity in the sediments from urban and industrial areas of the middle reaches is generally higher than that in the upper and lower reaches. RDA analysis indicated that the sediment CEC, TOC, DOC, TP, nitrogen in weak acid extractable form (WAEF-N) and nitrogen in ion exchangeable form (IEF-N) were the key factors driving the differences in the structural characteristics of bacterial communities in the sediment of Nanfei River. The influence of TP was significant on Proteobacteria, Bacteroidetes and Firmicutes, and WAEF-N had a greater influence on Chloroflexi.
Nanfei River;surface sediments;bacterial communities;MiSeq high-throughput sequencing;redundancy analysis (RDA)
X522
A
1000-6923(2018)09-3552-10
楊長明(1973-),男,安徽巢湖人,研究員,博士,主要從事污染底泥和土壤生態風險評價與修復技術研究.發表論文60余篇.
2018-01-18
國家水污染控制與治理科技重大專項(2017ZX07603-003);國家自然科學基金資助項目(51608002)
* 責任作者, 研究員, cmyang@tongji.edu.cn

