制備方法對CuO-CeO2-ZrO2催化CO氧化性能的研究
劉 通,王 單,劉世成,肖 瑞,張春雪,王金波
(重慶科技學院 化學化工學院,重慶 401331)
一氧化碳(CO)是一種無色、無味和有毒的空氣污染物,來源廣泛,對人類的呼吸系統和身體健康有著極大的危害和影響。為了消除CO這類空氣污染物,使用最多的方法就是催化氧化法。目前,CO的催化氧化在很多方面都有非常重要的應用價值,比如可用于汽車尾氣的凈化處理、密閉空間內CO的消除(地下礦井、潛艇等)、凈化空氣以及燃料電池中少量CO的消除等[1-2]。因此,實現CO 在較低的溫度下甚至室溫下轉化具有非常重要的實用價值和研究意義。CO的催化氧化一般采用過渡金屬作為活性組分,又可以分成貴金屬和非貴金屬類催化劑,但是由于貴金屬類催化劑(Au、Pt等)容易中毒、價格昂貴等限制了其使用,非貴金屬CuO-CeO2系列催化劑受到國內外研究者的廣泛關注[3-5]。有研究學者發現在CeO2中加入ZrO2能夠提高CeO2的儲氧量以及催化劑表面的穩定性[6-7],因此,與CuO-CeO2二元催化劑相比,CuO-CeO2-ZrO2的三元復合氧化物催化劑具有更高的活性和熱穩定性。
目前用于制備Cu基催化劑的方法有很多,比如浸漬法[8]、共沉淀法[9]、溶膠凝膠法[10]等。然而催化劑的結構、壽命、活性、穩定性和選擇性等性能在很大程度上往往會受到制備方法和工藝條件等因素的制約和影響。因此,本文的重點主要是運用溶膠-凝膠法(Sol-gel method)和共沉淀法(Coprecipitation method)這兩種方法,制備兩種不同類型的CuO-CeO2-ZrO2催化劑,然后進行分析討論。我們徹底分析和探索了兩種制備方法對催化劑結構、穩定性和活性的影響。并且利用XRD、H2-TPR等方法測試和表征催化劑CCZ,此外還考察了CO的氧化活性。
1 實驗部分
1.1 催化劑的制備
采用兩種方法制備Cu0.1Ce0.6Zr0.3催化劑。
方法一:將一定量的Cu(NO3)2·3H2O、Ce(NO3)3·6H2O、ZrO(NO3)2.H2O加到一起用去離子水溶解,配成0.5 mol/L的金屬硝酸鹽溶液,其中金屬離子的摩爾比為Cu2+∶Ce4+∶Zr4+=l∶6∶3。將配好的硝酸鹽溶液緩慢滴加到一定量的1 mol/L氫氧化鈉溶液中,在室溫下攪拌3h,整個過程中pH值控制為9~10。等到沉淀完全后在85℃水浴鍋內陳化回流3 h。然后經過濾、去離子水洗濟、烘箱內干燥至恒重。最后將得到的催化劑粉末放于馬弗爐內以一定的溫度(400℃,500℃和600℃)焙燒,將所得到的催化劑標記為co-CCZ。
方法二:將一定量的Cu(NO3)2·3H2O、Ce(NO3)3·6H2O、ZrO(NO3)2.H2O加到一起用去離子水溶解,硝酸鹽溶液的濃度為1 mol/L。往配好的鹽溶液中慢慢加入檸檬酸并緩慢攪拌,其中檸檬酸與全部金屬陽離子的比例控制為1∶1。將溶液放置在85℃恒溫攪拌器中加熱攪拌,蒸發掉溶液中多余的水分,得到溶膠,置于90℃烘箱干燥得到凝膠。最后經馬弗爐焙燒將所得到催化劑標注為sg-CCZ。
1.2 催化劑的表征
采用Shimadzu Corporation公司生產的XRD-7000型X射線衍射儀進行物相分析。測試條件為:Cu靶,X射線,管電壓和管電流分別為40kV和30mA,掃描的范圍為10°~80°,掃描的速度為2°/min,步長2θ為0.02。
H2程序升溫還原(H2-TPR)實驗是采用衢州市沃德儀器有限公司生產的化學吸附儀進行,型號為VDSorb-91i,測試條件:載體Ar,反應氣10%H2/Ar混合氣,預處理條件:以10℃/min的速率升溫至200℃,然后恒溫30min,冷至室溫后,通入10%H2/Ar混合氣,以10℃/min的速率升至600℃還原,TCD檢測器溫度80℃。
1.3 催化反應性能的評價
CO氧化反應的活性測試是在自己搭建的微型固定床反應器中進行的。將0.3 g的催化劑粉末和一定量石英砂(60~100目)稀釋混合均勻后,裝入玻璃管反應器中,兩端塞有石英棉。反應的氣體是由空氣壓縮機壓縮產生的壓縮空氣和0.8%CO/N2組成,混合氣的空速為12000 h-1,CO濃度為500 ppm。反應前后CO濃度采用氣相色譜儀GC-2014測量。
2 結果與討論
2.1 催化劑XRD分析

圖1 不同煅燒溫度下所制備的兩種CCZ催化劑的XRD譜圖
圖1是 Cu0.1Ce0.6Zr0.3催化劑用兩種不同制備方法表征后得到的XRD譜圖。兩種方法制備的CCZ催化劑主要有四個特征峰,分別位于29.1°、33.5°、48.2°和57.5°處,它們是屬于鈰鋯固溶體和立方螢石結構的CeO2的特征衍射峰。而在圖1中沒有出現ZrO2的特征衍射峰,說明存在的鈰鋯固溶體是由于ZrO2進入了CeO2的晶格中形成的,而且維持了原來的螢石結構。
通過共沉淀法和溶膠凝膠法制備得到的CCZ催化劑XRD譜圖上并沒有出現CuO的特征峰。這種結果說明,Cu物種在鈰鋯固溶體上高度分散,沒有出現團聚現象、或者是因為其晶粒尺寸太小XRD儀器檢測不出來,或是形成了Cu-Ce-Zr-O的固溶體,或是兩種情況同時存在[11]。
從制備CCZ催化劑的兩種方法的XRD圖中可以顯示出,CeO2的特征峰的位置有不同程度的偏移。這是因為Cu2+半徑小于Ce4+,促使Cu2+更加容易進入CeO2的晶格,從而產生大量的Ce3+使得晶格擴大[12]。用溶膠凝膠法制備的催化劑,其CeO2晶面的特征峰偏移較小,說明進入到了這個催化劑CeO2晶格中的Cu2+數量較少。
當催化劑的焙燒溫度為400℃和500℃時,從XRD圖中可以看出運用共沉淀法制備得到的CCZ催化劑圖譜中并沒有出現很顯著的寬度和強度上的變化,但是伴隨著CCZ催化劑焙燒的溫度升高到600℃,CCZ催化劑的特征峰強度慢慢增強,相應的峰形也會變得更加尖銳。從這一現象可以說明,提高溫度可以使CCZ催化劑的晶化程度提高并且使其晶粒尺寸變大[13]。但是用溶膠凝膠法制備的CCZ催化劑隨著溫度的升高,特征峰并沒有出現特別明顯的變化,說明溫度的變化對其結構、晶型影響較小。
2.2 催化劑的H2-TPR分析
為了研究兩種方法制備的co-CCZ和sg-CCZ催化劑的還原性,選擇焙燒溫度分別為400℃、500℃和600℃的CCZ催化劑對其進行H2-TPR表征,表征的結果見圖2。
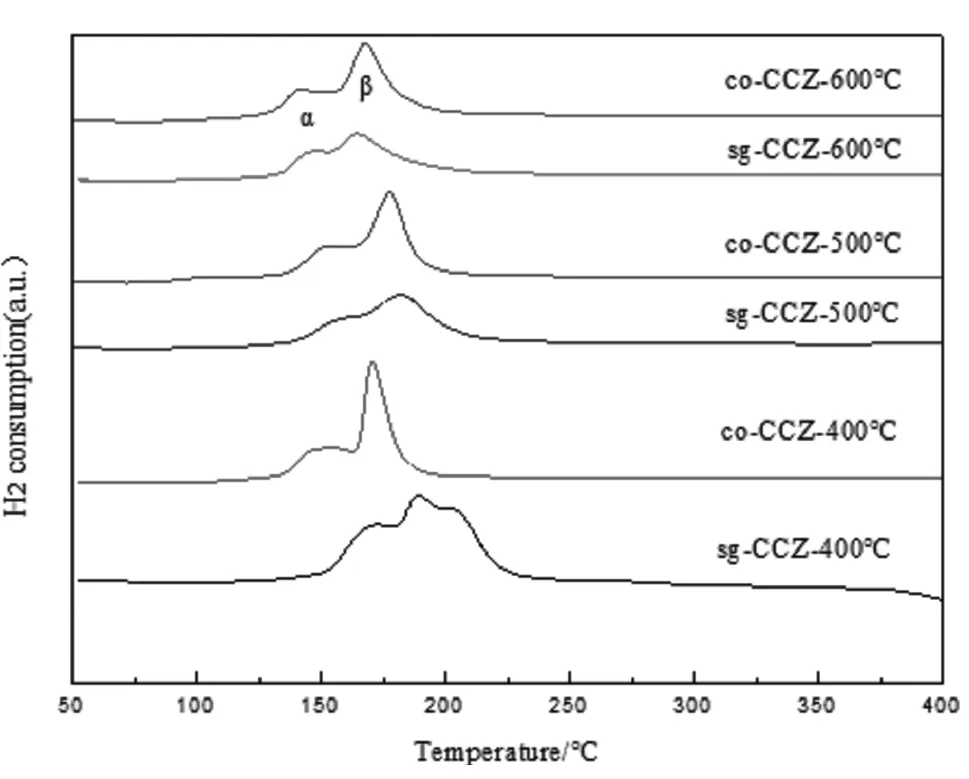
圖2 由不同焙燒溫度制得的2種CCZ催化劑的H2-TPR圖譜
從圖2看出,兩種方法制備得到的co-CCZ和sg-CCZ催化劑的還原峰的溫度范圍較寬,主要集中在150~220℃的范圍內,低于純的氧化銅的還原溫度(320℃),說明鈰鋯載體可以提高CuO的還原性。H2-TPR譜圖中有兩個主要的還原峰,根據相關文獻可知,第一個低溫峰是催化劑CCZ表面高分散的CuO,而第二個峰則是進入到鈰鋯載體晶格內部的Cu2+的還原峰[14]。
從用溶膠凝膠法和共沉淀法制備得到的催化劑的H2-TPR圖譜可以看出,所制備的催化劑主要有兩個還原峰,在400℃下焙燒的CCZ催化劑的α還原峰為170℃,當焙燒溫度升高到600℃時,所焙燒的CCZ催化劑的α還原峰僅為150℃,說明提高CCZ催化劑的焙燒溫度可以使CuO還原溫度降低。當焙燒溫度為400℃和500℃時,co-CCZ催化劑的β還原峰高于sg-CCZ催化劑,說明sg-CCZ催化劑比co-CCZ更加容易形成固溶體。此外,采用共沉淀法制備的催化劑,其低溫峰面積較大,說明具有更多的高分散CuO活性組分。
2.3 CO催化氧化活性
圖3表示分別經過400℃、500℃、600℃煅燒制備得到的sg-CCZ型和co-CCZ 型催化劑,然后在不同的反應溫度下CO對應的轉化率。
從圖3可以看出,CO的活性隨著反應溫度的升高,其CO轉化率也相應的增高,用共沉淀法和溶膠凝膠法兩種方法制備得到的CCZ催化劑,各自的CO氧化性能有很大的不同。在不同焙燒溫度下,co-CCZ活性明顯優于sg-CCZ,當CO的轉化率達到100%時的溫度僅僅為90℃。隨CCZ的焙燒溫度由400℃升高到600℃,催化劑的活性(CO的轉化率)先升高然后又降低。究其原因也許是由于焙燒溫度過高導致了CCZ催化劑的活性組分被燒結,而較低的焙燒溫度又不利于CuO的高分散以及CuO與鈰鋯載體之間的強相互作用[15]。因此,合適的煅燒溫度對于催化劑CCZ就顯得尤為重要。

(a)400℃,(b)500℃,(c)600℃
圖3 不同焙燒溫度下制備的兩種催化劑的CO轉化率
Fig.3 CO conversion of two types of catalysts prepared at different calcination temperatures
3 結論
本研究對于co-CCZ和sg-CCZ催化劑的合成分別采用了兩種不同的方法,并且考察了不同的焙燒溫度對催化劑活性的影響。當CCZ的焙燒溫度為500℃,反應溫度為90℃時,CO的轉化率均在90%以上。綜合表征結果:XRD、H2-TPR和CO的活性測試,可以認定共沉淀法制備的co-CCZ催化劑更加容易形成高度分散的CuO,從而有利于CO 的氧化反應。co-CCZ和sg-CCZ 這兩種催化劑中,co-CCZ催化劑具有更好的低溫還原特性,從而也具有更優良的催化氧化活性。因此,在制備CCZ催化劑時,共沉淀法是較于溶膠凝膠法更優良的方法。

