肝動脈灌注化療栓塞及微波消融對肝癌患者細胞免疫及體液免疫臨床意義分析
曹慶柱
肝癌是臨床上最常見的惡性腫瘤之一,全世界每年大約有689700名患者死于肝癌,而我國大約占一半以上[1-2]。治療肝癌最好的方法是進行癌瘤根治性切除,但是由于肝癌發病過程隱匿,大多數患者就診時已屬于中、晚期,只有極少部分患者具有外科手術切除機會,且在這些進行手術切除的患者中有80%以上會出現復發[3]。近年來,肝動脈化療栓塞術(TACE)、微波消融(PMCT)等介入治療方法的出現成為臨床治療中晚期肝癌患者的新方法[4]。研究發現,采用單一肝動脈化療栓塞術對肝癌患者治療效率較低,容易出現遠處轉移及復發,且多次治療易損傷肝功能[5]。而微波消融在肝癌患者的治療過程中發揮著明顯的優勢[6]。據此,本研究以122例肝癌患者作為研究對象,探討肝動脈灌注化療栓塞聯合微波消融治療中晚期肝癌患者的臨床治療效果及其對肝癌患者細胞免疫及體液免疫功能的影響。
1 材料與方法
1.1 一般資料
病例來源于2015年6月至2017年6月在我院進行住院治療的原發性肝癌患者122例。病例納入標準:①影像學檢查及病理學診斷均符合第8版外科學原發性肝癌的診斷標準[7];②肝功能Child-Pugh分級為A級或B級,無手術切除可能性;③Karnofsky功能評分70分;④符合醫學倫理學要求,患者知情同意,簽署知情同意書。排除標準:①門靜脈壓明顯升高者;②近1個月有過手術史;③合并有心、肝、腎、骨髓等系統疾病者;④近1個月內出現消化道出血、肝性腦病等臨床癥狀者。按隨機數字表法將122例納入病例分為對照組和觀察組,每組61例。對照組給予單一肝動脈灌注化療栓塞法,觀察組給予肝動脈灌注化療栓塞法聯合微波消融。對照組:年齡45~78歲,平均年齡(59.3±2.4)歲;男性38例,女性23例;AFP水平≥400/L 40例,<400/L 21例;Child A級32例,Child B級29例。觀察組:年齡44~76歲,平均年齡(58.1±3.1)歲;男性37例,女性24例;AFP水平≥400/L 41例,<400/L 20例;Child A級33例,Child B級28例。兩組患者在一般資料等方面不具有統計學差異(P>0.05)。
1.2 方法
1.2.1 肝動脈灌注化療栓塞術(TACE) 采用改良的Seldinger技術,經右側股動脈進行穿刺,置入導管至肝動脈,并行數字減影血管造影,明確腫瘤病灶供血動脈。肝動脈灌注栓塞藥物選用氟尿苷700~1 000 mg、奧沙利鉑100~200 mg、表柔比星20~100 mg,選擇以上3種藥物中的一種或兩種與超液態碘化油20~30 mL進行肝動脈灌注栓塞,手術過程中若伴有肝動脈-門靜脈瘺時或供血動脈血流豐富時可加用明膠海綿栓塞。
1.2.2 肝動脈灌注化療栓塞術聯合微波消融(PMCT) 在行TACE治療3~4周后進行PMCT治療,PMCT治療方法:行肝臟CT,明確腫瘤的大小及部位,術前給予鹽酸異丙嗪、鹽酸哌替啶進行鎮靜、鎮痛,手術過程中密切關注患者各項生命指征。根據腫瘤的具體位置選擇合適的穿刺部位及穿刺途徑,并設置適宜大小的微波參數。大多數情況下選擇在CT引導下經過正常肝臟1 cm作為穿刺點,并巧妙避開腸胃管、重要神經血管,微波消融功率多設置為50~60 W,時間為20~30 min,對于腫瘤病灶直徑>5 cm進行多刀、分點、分次消融,治療結束前再次行肝臟全面CT掃描,確保腫瘤已完全被微波消融覆蓋,排除血(氣)胸、出血、腫瘤破裂等并發癥的發生,治療結束后退針時行針道消融,避免腫瘤沿針道發生種植轉移及術后出血。術前、術后3天采集患者空腹靜脈血,采用免疫比濁法檢測IgA、IgM、IgG、補體C3、補體C4水平變化,所有試劑及耗材均購于上海必幫生物科技有限公司,采用密度梯度離心法分離外周血中的有核細胞,進行染色,溶血反應時間為15 min,在流式細胞儀上檢測CD4+、CD8+、CD4+/CD8+、NK細胞的變化情況,采用Cellquest軟件對數據進行分析。
1.3 療效評價
根據WHO制定的關于實體瘤治療效果的診斷標準,完全緩解(CR):病灶消失時間持續1個月以上;部分緩解(PR):病灶最大直徑縮小總和>30%;疾病進展(PD):病灶最大直徑增加>20%或有新的腫瘤病灶產生;疾病穩定(SD):介于部分緩解和疾病進展之間。總有效率=(CR+PR)/總患者數。
1.4 觀察指標
觀察兩組患者臨床治療效果、不良反應發生率,檢測術前、術后3天患者外周血體液免疫(IgA、IgM、IgG、補體C3、補體C4)及細胞免疫(CD4+、CD8+、CD4+/CD8+、NK細胞)指標水平變化。
1.5 統計學分析
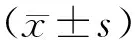
2 結果
2.1 兩組患者臨床治療效果比較
對照組有40例患者治療有效,總有效率為65.57%;觀察組有56例患者治療有效,總有效率為91.80%,觀察組的治療有效率明顯高于對照組,兩組比較具有統計學差異(P<0.05),見表1。
2.2 兩組患者治療前后體液免疫指標比較
與治療前相比,對照組IgM、IgG水平明顯升高,補體C3水平明顯降低,具有統計學差異(P<0.05);與治療前相比,觀察組IgM、IgG水平明顯升高,補體C3、補體C4水平明顯降低,具有統計學差異(P<0.05);與對照組治療后相比,觀察組治療后IgM、IgG水平明顯升高,補體C3水平明顯降低,具有統計學差異(P<0.05)。見表2。
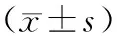
表2 兩組患者治療前后體液免疫指標比較
2.3 兩組患者細胞免疫功能指標變化情況
與治療前相比,對照組CD4+、CD4+/CD8+、NK細胞明顯升高,CD8+明顯降低,具有統計學差異(P<0.05);與治療前相比,觀察組CD4+、CD4+/CD8+、NK細胞明顯升高,CD8+明顯降低,具有統計學差異(P<0.05);與對照組治療后比較,觀察組CD4+明顯升高、CD8+明顯降低、CD4+/CD8+升高、NK細胞增多,兩組治療后比較具有統計學差異(P<0.05),見表3。
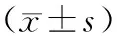
表3 兩組患者細胞免疫功能指標變化情況
2.4 兩組患者不良反應發生情況比較
兩組患者不良反應情況主要表現為肝功能損害、脫發、消化道反應、骨髓抑制,對照組總共有11例患者發生不良反應,觀察組有12例患者發生不良反應,兩組患者不良反應發生率不具有統計學差異(P>0.05),見表4。

表4 兩組患者不良反應發生情況比較(例,%)
3 討論
原發性肝癌在臨床上非常常見,多由于肝內膽管細胞或肝細胞發生腫瘤病變[8]。其臨床癥狀主要表現為肝臟腫大、疼痛、消瘦乏力等,晚期時表現為多器官衰竭、腹水、黃疸、惡病質以及出血等[9]。發病初期癥狀不明顯,確診時多為中晚期,具有極高死亡率及復發率,給患者生命造成了嚴重的威脅[10]。研究表明,在原發性肝癌患者體內具有一定量的免疫抑制因子,可抑制癌細胞增殖,誘導癌細胞凋亡。活化后的NK細胞可直接與腫瘤細胞作用,殺死腫瘤細胞,抑制癌瘤的擴大[11]。T淋巴細胞可分為多種亞群,主要包括CD4+和CD8+,兩者在正常人體內處于平衡,使免疫系統維持穩定。CD4+是輔助性T細胞,當機體受到外界傷害時,可輔助性調節機體免疫力,并具有誘導下游靶向因子的作用;CD8+屬于抑制性T細胞,發揮抑制腫瘤細胞生長、擴散及轉移功能[12-13]。CD4+/CD8+體現了機體的免疫功能,當機體免疫功能下降時,CD4+/CD8+比值會降低,反之,當機體免疫功能增強時,CD4+/CD8+比值會升高[14]。
研究發現,采用TACE法治療原發性肝癌后,只有6%癌組織出現壞死,而殘留的腫瘤細胞會產生更強的增殖活性,而且在TACE術后一段時間內患者可能更容易發生遠處轉移或肝內播散,導致病情加重[15]。Wai等[16]研究發現,多次進行TACE術治療原發性肝癌可得到較好的遠期治療效果,但是在某種程度上可導致肝硬化病情加重。亦有研究表明,TACE術可使因慢性乙肝病毒導致的原發性肝癌患者乙肝DNA病毒增殖活躍,導致肝功能惡化[17]。微波消融治療在近年來得到迅猛發展,是除了手術切除、介入治療之外的有效治療手段,因腫瘤細胞不耐熱,當腫瘤局部組織溫度升高到53 ℃~61 ℃時,癌細胞就會發生壞死,而微波消融則主要通過其熱效應,通過微波天線將能量傳導入瘤體內,使癌細胞發生壞死,達到局部根除腫瘤的目的[18-19]。微波參數設置為90 W、6~9 min、6 cm時即可使電極單根熱凝達到最大有效直徑范圍,對于直徑<3 cm的小肝癌來說,單次熱凝即可達到根治腫瘤的目的,使腫瘤組織完全壞死,達到與手術切除相同的效果[20-21]。因此,微波消融被認為是根治小肝癌的手段之一。
本研究結果表明,采用肝動脈灌注化療栓塞及微波消融聯合治療中晚期肝癌效果優于單一使用肝動脈灌注化療栓塞術,微波消融熱療后使腫瘤細胞釋放抗原,刺激免疫應答,增強機體抗腫瘤免疫反應。微波消融可解除抑制因子對機體免疫系統的抑制作用,使機體恢復免疫應答功能。TACE聯合PMCT治療中晚期肝癌可針對性的殺死腫瘤細胞,把對正常細胞的傷害降到最低,并提高機體免疫功能,獲得良好的臨床治療效果,值的臨床推廣使用。

