硫酸軟骨素中蛋白質(zhì)類雜質(zhì)去除方法研究
曹紅光,李燕妮
(1. 煙臺東誠藥業(yè)集團(tuán)股份有限公司,山東 煙臺 264006;2. 濱州醫(yī)學(xué)院藥學(xué)院,山東 煙臺 264003)
關(guān)鍵字:硫酸軟骨素;蛋白質(zhì)雜質(zhì);蛋白酶水解;稀堿處理
硫酸軟骨素(chondroitin sulfate,CS)是一種結(jié)構(gòu)復(fù)雜的糖胺聚糖,由D-葡糖醛酸和N-乙酰半乳糖胺以β-1, 3糖苷鍵連接形成二糖(GlcAGalNAc),二糖單位之間以β-1, 4糖苷鍵連接而形成多聚糖[1-2]。CS廣泛存在于動物組織的細(xì)胞外基質(zhì)和細(xì)胞表面,尤其在軟骨等結(jié)締組織中含量豐富,不同生物或同一生物的不同組織所含CS的結(jié)構(gòu)不盡相同[3]。
CS在透明軟骨組織中是以聚集蛋白聚糖(aggrecan)糖鏈的形式存在的。聚集蛋白聚糖與膠原蛋白纖維等組分構(gòu)成細(xì)胞外基質(zhì)。膠原蛋白大約占干軟骨重量的50 %~75 %,聚集蛋白聚糖大約占干軟骨重量的15 %~30 %[4]。聚集蛋白聚糖聚集體的中心是一條透明質(zhì)酸糖鏈,核心蛋白通過連接蛋白以非共價鍵與透明質(zhì)酸連接。核心蛋白上連接著多條糖鏈,包括CS和硫酸角質(zhì)素。CS和硫酸角質(zhì)素共價連接在核心蛋白質(zhì)上,見圖1。所以CS產(chǎn)品中可能存在的天然雜質(zhì)有蛋白質(zhì)及其水解產(chǎn)物、透明質(zhì)酸和硫酸角質(zhì)素,本文重點討論蛋白質(zhì)水解產(chǎn)物的去除方法。
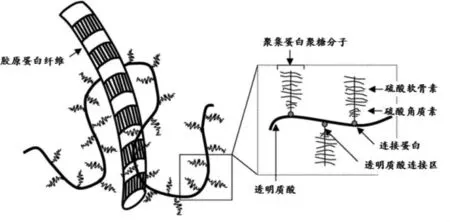
圖1 軟骨中膠原蛋白和聚集蛋白聚糖的網(wǎng)狀結(jié)構(gòu)
蛋白水解酶消化方法已取代堿提取的方法用于將CS從軟骨中釋放出來。為充分降解蛋白質(zhì),應(yīng)使用廣特異性的蛋白酶。用胰酶或鏈酶蛋白酶處理軟骨均可得到只含有少量殘余肽段的多糖鏈[5]。基于酶的特異性不同,一般需要堿性、中性和酸性蛋白酶共同作用才可將蛋白質(zhì)水解得比較徹底,在工業(yè)生產(chǎn)中一般使用堿性蛋白酶與胰酶共同使用的方法來水解軟骨蛋白。通過蛋白酶的水解,切斷蛋白聚糖中肽鍵后,CS從不溶于水的蛋白聚糖大分子變成溶于水的CS糖鏈。
工業(yè)生產(chǎn)中,使用適當(dāng)濃度的乙醇可將CS先從溶液中分離出來,而蛋白質(zhì)降解產(chǎn)物留在溶液中,從而實現(xiàn)分離和純化。由于蛋白酶作用的特異性和多糖鏈的空間位阻會影響蛋白酶水解,只用蛋白酶不能斷裂多糖與核心蛋白連接的糖苷鍵及附近肽鍵[6],因此CS成品中可能保留肽段,這些肽段是通過共價鍵與硫酸軟骨素連接在一起的,因此不能用乙醇沉淀的方法去除,需使用堿降解方法。在堿性條件下,多糖與蛋白連接區(qū)的糖苷鍵(即絲氨酸-O-木糖)會發(fā)生斷裂,完全釋放出CS[7]。本文采用稀堿處理方法,去除CS中蛋白質(zhì)類雜質(zhì),從而獲得高純度CS。
1 儀器與材料
1.1 儀器
1260 Infinity液相色譜儀(美國安捷倫);Waters Spherisorb S5 SAX色譜柱(4.0 mm×250 mm);UV 2550紫外分光光度計(日本島津);S20 pH計(梅特勒-托利多); AVANCE IIITM 500核磁共振波譜儀(德國Bruker公司)。
1.2 材料
豬軟骨(鼻骨,購于農(nóng)貿(mào)市場);硫酸軟骨素對照品,硫酸軟骨素ABC酶(Sigma公司);無水乙醇,氫氧化鈉,甲醛,鹽酸等試劑(分析純,上海試劑一廠);胰酶(2000 U/g,重慶奧力);Alcalase 3.0 T堿性蛋白酶(諾維信)。
2 方法
2.1 蛋白酶水解和乙醇沉淀方法去除CS中蛋白質(zhì)
取1 kg鮮新軟骨,勻漿后加入6.0 L純化水,調(diào)節(jié)pH 7.5~8.0,加入一定量的堿性蛋白酶和胰酶,50 ℃水解10 h。每小時取樣檢測氨基氮含量。調(diào)節(jié)pH 6.0,85 ℃處理10 min。水解液離心,去除不溶物,0.8 μm微孔濾膜過濾澄清。水解液中加入2 %(w/v)氯化鈉,1.2倍體積無水乙醇,沉淀,重新加水溶解為6.0 L,加入2 %(w/v)氯化鈉和1.2倍體積無水乙醇,離心得CS沉淀,烘干。
2.2 堿降解法去除CS中的核心蛋白
將5.0 g上述實驗得到的CS樣品溶解成1000 ml(含NaBH41.0 mol/L,分別含NaOH 0.01 mol/L,0.05 mol/L和0.1 mol/L),45 ℃處理48 h[8]。用鹽酸調(diào)節(jié)pH 6.5,加入4倍體積無水乙醇得到CS沉淀,烘干。
2.3 氨基氮含量測定
蛋白酶水解到一定時間時,取10 ml水解液,快速用冰水降溫到10 ℃以下,離心后取上清,準(zhǔn)確吸取5 ml,加20 ml純化水,用氫氧化鈉標(biāo)準(zhǔn)溶液(0.05 mol/L)滴定至 pH 8.2。向上述溶液中準(zhǔn)確加入甲醛10 ml,混勻,放置3~5 min,用氫氧化鈉標(biāo)準(zhǔn)溶液(0.05 mol/L)滴定至pH 9.2。記錄消耗的氫氧化鈉標(biāo)準(zhǔn)溶液體積。
氨基氮含量(mg/ml)=C×VNaOH÷V樣品×m
式中:C為氫氧化鈉標(biāo)準(zhǔn)溶液濃度(mol/L);VNaOH為滴定時消耗氫氧化鈉標(biāo)準(zhǔn)溶液的體積(ml);V樣品為量取樣品的體積(ml);m為氮原子摩爾質(zhì)量,14。
2.4 蛋白質(zhì)含量測定
按中國藥典福林酚法測定[9]。
2.5 CS含量測定
按中國藥典酶解液相法測定[10]。樣品經(jīng)硫酸軟骨素ABC酶充分消化后,用強陰離子交換色譜柱分離二糖組分,對二糖組分峰面積積分來確定CS含量。
3 結(jié)果與分析
3.1 蛋白酶水解和乙醇沉淀方法去除硫酸軟骨素中的蛋白質(zhì)
為了對比工業(yè)化生產(chǎn)中常用的堿性蛋白酶和胰酶兩種酶的水解特性,單獨使用0.8 %(按軟骨重量計)堿性蛋白酶和0.8 %(按軟骨重量計)胰酶對軟骨進(jìn)行水解。通過檢測水解液中氨基氮的含量來檢測水解程度,見圖2。
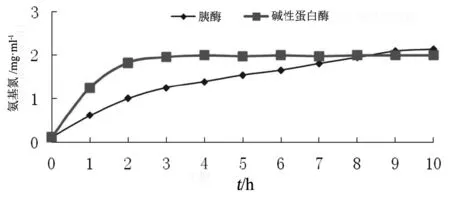
圖2 堿性蛋白酶和胰酶單獨使用對軟骨的水解特性對比
水解過程中堿性蛋白酶更快地完成水解,僅需大約2 h即可水解較徹底,而胰酶10 h內(nèi)一直保持較緩慢的水解過程,這對工業(yè)化生產(chǎn)是不利的。盡管胰酶水解速度較慢,但是對蛋白質(zhì)的水解更為徹底,因此在水解9 h后,其水解程度最終超過堿性蛋白酶。因此推測兩種蛋白酶合用,可達(dá)到減少水解時間和增加水解程度的目的。
為了證明上述推論,將兩種蛋白酶均按軟骨重量的0.2 %,0.4 %和0.8 %的比例混合后同時使用,通過檢測水解液中氨基氮的含量來檢測水解程度,見圖3。
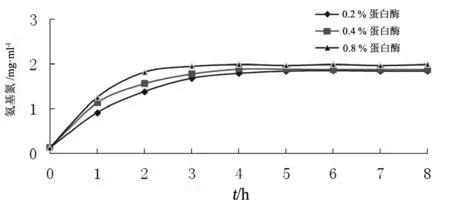
圖3 堿性蛋白酶和胰酶合用對軟骨的水解特性
堿性蛋白酶和胰酶合用時的水解曲線與堿性蛋白酶單獨使用時類似。由圖3可見,3個水平的酶用量均可在水解2~4 h后接近水解終點,并且氨基氮的最終含量比單獨使用堿性蛋白酶的水平稍高,水解速度比單獨使用胰酶更快。
為評價蛋白酶水解程度對最終CS產(chǎn)品中蛋白含量的影響,取0.8 %堿性蛋白酶和0.8 %胰酶聯(lián)用水解液,兩次乙醇沉淀后檢測CS產(chǎn)品中CS含量和蛋白質(zhì)含量,見表1。
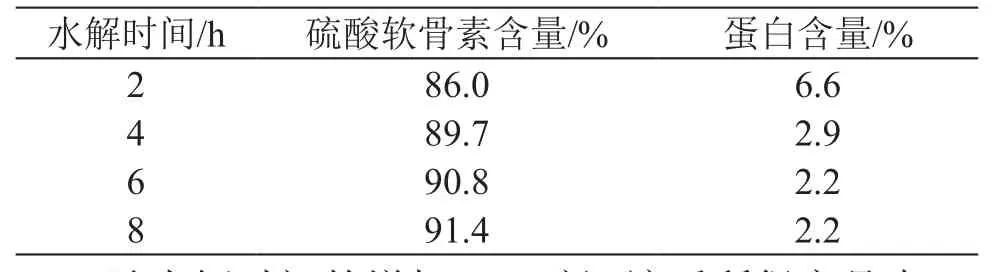
表1 水解程度對最終產(chǎn)品中CS和蛋白質(zhì)含量的影響
隨水解時間的增加,乙醇沉淀后所得產(chǎn)品中CS含量增加,蛋白質(zhì)含量降低,但水解4 h后這種變化不再顯著而慢慢趨于穩(wěn)定。這個變化趨勢與軟骨的水解程度隨時間的變化趨勢一致。
乙醇沉淀是從溶液中分離多糖的一個簡單途徑,這個過程可去除大部分的小分子物質(zhì),包括肽和無機鹽。實驗發(fā)現(xiàn)重復(fù)的乙醇沉淀可大幅去除蛋白質(zhì)水解產(chǎn)物,但當(dāng)CS中的蛋白質(zhì)含量降低到一定程度,如1 %~3 %時,重復(fù)乙醇沉淀就無法繼續(xù)降低蛋白質(zhì)含量。這是因為與堿解會不同程度破壞CS分子結(jié)構(gòu)不同,蛋白酶水解的方法可獲得完整的CS多糖分子,但獲得只結(jié)合一個氨基酸殘基的多糖幾乎是不可能的。用木瓜蛋白酶徹底水解軟骨獲得的CS分子中含殘留肽段,平均由5個氨基酸構(gòu)成。與此相似的是,鏈酶蛋白酶水解后獲得的CS也包含具有數(shù)個氨基酸的肽段[12]。這些肽段來自于CS在生物體內(nèi)合成時,作為起點的核心蛋白。由于肽段與CS以共價鍵連接,并非游離形式存在,因此無法用乙醇沉淀等方法簡單去除,需使用堿降解方法。
3.2 堿降解法去除CS中的核心蛋白肽段
堿降解過去常被用于從組織中提取多糖。用此方法從軟骨中提取CS,產(chǎn)品具有較高純度,但在堿處理過程中一些糖苷鍵被切斷[13]。為在可控條件下盡可能斷開連接區(qū)的肽段,采用不同濃度的氫氧化鈉處理含蛋白質(zhì)的CS樣品,這些樣品的蛋白質(zhì)含量無法通過乙醇沉淀的方法繼續(xù)降低。堿降解后,樣品中CS含量和蛋白質(zhì)含量的變化見表2。
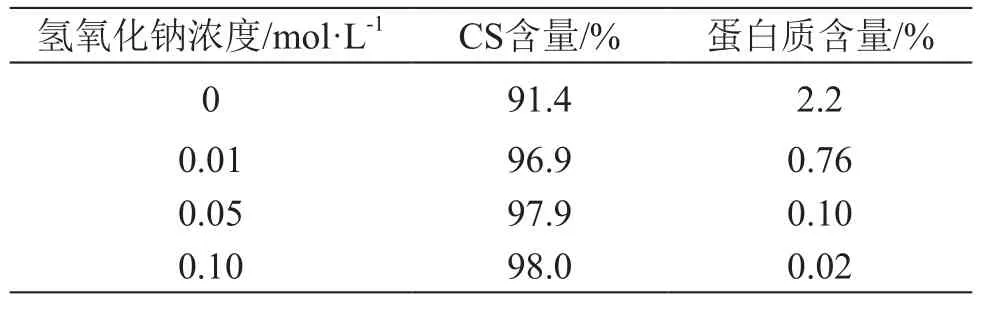
表2 堿降解對CS含量及蛋白質(zhì)含量的影響
堿降解后,CS中蛋白質(zhì)的含量明顯降低,同時CS含量發(fā)生不同程度的提高,接近最高值,這與其含有的蛋白質(zhì)雜質(zhì)含量降低有關(guān)。此實驗證明,適量的堿降解可去除CS中無法通過乙醇沉淀去除的核心蛋白。
核心蛋白的含量可通過13C-NMR中56.4 ppm處絲氨酸信號峰檢測[14-15],見圖4。由圖4可見,經(jīng)0.1 mol/L堿處理后樣品的絲氨酸信號峰消失。
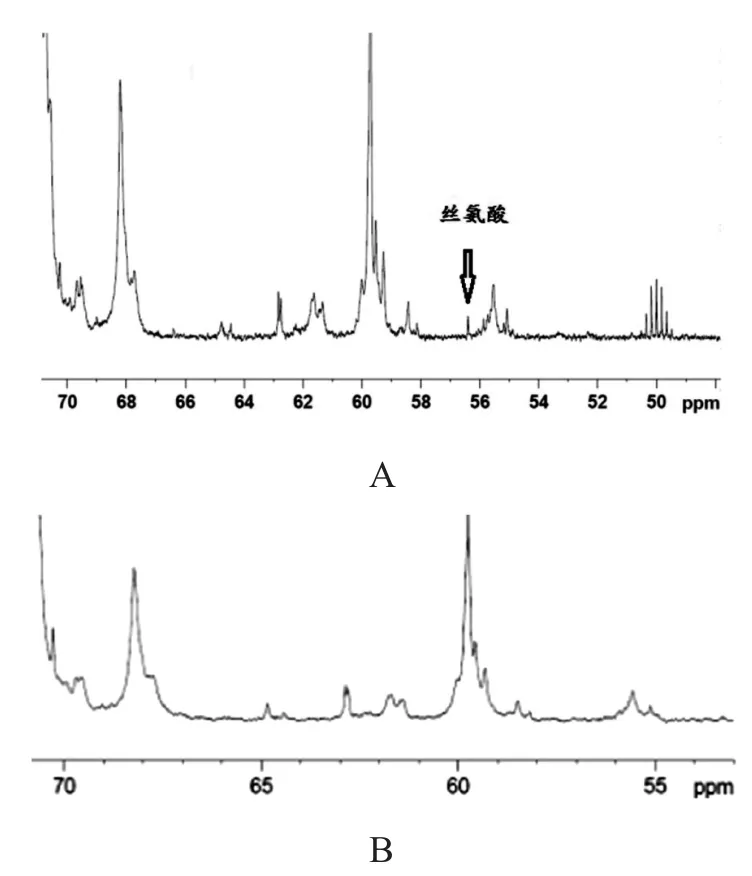
圖4 CS核磁共振碳譜(部分)
堿降解是通過β消除反應(yīng)切斷蛋白聚糖連接區(qū)木糖和絲氨酸羥基之間的-O-糖苷鍵。堿處理可在有硼氫化物存在的還原環(huán)境下進(jìn)行,它可使木糖殘基還原成木糖醇,從而有效地阻止進(jìn)一步降解。
4 討論
目前酶解法成為從生物組織中釋放多糖的最普遍的工藝。由于蛋白酶作用的特異性和多糖鏈本身會阻礙蛋白酶酶解,只用蛋白酶往往不能斷裂糖苷鍵附近的肽鍵,因此CS成品分子中可能保留一定長度的肽段。使用胰酶或堿性酶蛋白酶水解軟骨可得到含少量殘余肽段的CS糖鏈。
盡管堿提取已不再用于任何大規(guī)模的多糖制備,對于CS等多糖來說,打開其還原端的木糖-絲氨酸連接,使其釋放出最后連接的肽段,堿降解仍是一個有價值的方法。

