阿爾茨海默病與維生素D受體基因遺傳變異的關聯分析
史曜維, 莊曉偉, 朱 磊, 王稀琛, 劉 寒
阿爾茨海默病(Alzheimer disease,AD),又稱老年性癡呆,是一種不可逆的中樞神經退行性疾病,臨床主要表現為認知功能下降、精神癥狀和行為障礙、日常生活能力的逐漸下降[1]。AD發病隱匿,病程長且預后較差,目前已成為繼心腦血管疾病、惡性腫瘤之后的第3位危害人類健康的重要慢性非傳染性疾病。流行病學調查顯示,全球范圍內已有超過3500多萬的AD患者[2],并且這個數字還會以每3 s增加1名的速度上升。中國人口老齡化日益嚴重,AD已成我國人民健康的巨大挑戰。AD可能是一組異質性疾病,在多種因素(包括環境因素、遺傳因素以及社會心理因素)的作用下才發病。多項臨床實驗研究報道了AD患者體內普遍存在維生素D缺乏的現象[3,4]。此外,基礎研究亦發現維生素D在AD的病理過程中發揮重要作用,然而,其具體機制尚不清楚。維生素D與維生素D受體(Vitamin D receptor,VDR)結合而發揮作用。國外已有關于VDR基因遺傳多態與AD發病關聯研究的探索。Gezen-Ak等[5]在高加索人群中首次發現了VDR基因ApaI位點多態性與AD的發病存在關聯。目前,在我國漢族人群中尚未開展AD與維生素D受體基因遺傳變異的關聯分析。為此,本研究結合國外已有的研究進展,采用基于醫院的病例對照研究,探討AD與維生素D受體基因遺傳變異的關聯。
1 對象與方法
1.1 研究對象 AD組:隨機選取于2013年1月-2017年12月在上海市靜安區精神衛生中心門診收治且診斷為AD患者263例,納入標準:(1)所有病例均符合NINCDS/ADRDA的診斷標準;(2)年齡18~70歲;(3)自愿作為研究對象,保證完成研究過程。排除標準:(1)其他非AD癡呆患者;(2)年齡在18歲以下或70歲以上;(3)有腦創傷、腦損害病史,或正在服用抗精神病藥物。所有研究均為無血緣關系的人群,且排除孕婦、哺乳婦女者。健康對照組:選自本單位同時期參加體檢的健康人群591例,按照年齡、性別等因素與AD組相匹配。本研究獲得了本單位倫理委員會的批準,且嚴格遵守倫理學的各項規定。
1.2 調查方法 參照相關文獻自行設計《AD調查表》進行現場詢問調查,在研究對象知情同意的前體下由經過培訓的調查人員對研究對象進行詢問調查,調查內容包括基本情況(年齡、性別、吸煙、飲酒等);既往疾病史(慢性疾病史、傳染病史、其他疾病史等)。
1.3 實驗方法 經知情同意后,抽取研究對象EDTA抗凝靜脈血5 ml,并在24 h內4000轉離心10 min,將靜脈血分離成血清層、白細胞層和紅細胞層,分裝于1.5 ml凍存管,置-20 ℃貯存。血清25(OH)D3水平的檢測采用ELISA法,試劑盒購自上海斯凱科技有限公司。所有實驗的具體操作均嚴格按照說明書進行。從NCBI、HapMap等數據庫中尋找和確認VDR基因的SNPs位點,選擇在中國人群具有較高頻率(MAF≥ 5%),再結合國內外文獻報道[5~7],最終確定了FokI和ApaI兩個位點。運用ABI公司設計的TaqMan-MGB熒光探針實時定量PCR法檢測FokI和ApaI位點基因型,FokI位點野生純合型為FF,雜合型為Ff,突變純合型為ff,ApaI位點野生純合型為AA,雜合型為Aa,突變純合型為aa。探針和引物均委托上海科邁生物技術公司設計。反應在ABI 7900 PCR儀中進行,采用SDS 2.3軟件讀取檢測數據。
1.4 統計學分析 應用EpiData 3.10、SAS 9.1.3、SPSS 17.0和PHASE 2.0軟件對調查和實驗數據進行分析,健康對照和AD組中性別、吸煙、飲酒分布情況采用卡方檢驗,年齡分布差異采用t檢驗,血清25(OH)D3水平分布不符合正態分布,故采用秩和檢驗方法。VDR基因位點在人群中分采用多因素Logistic回歸分析。本研究的檢驗均為雙側概率檢驗,當P<0.05時有統計學意義。
2 結 果
2.1 研究對象的一般情況 本研究共納入263例AD患者和591例健康對照者。兩組人群在性別和年齡分布上無統計學差異(P值分別為0.58和0.28)。血清25(OH)D3水平在兩組間的分布差異具有統計學差異(P<0.01)(見表1)。
2.2 VDR基因SNPs位點多態性與AD遺傳易感性的關系 多因素Logistic回歸分析顯示:在調整年齡、性別等因素后,與FF基因型相比,FokI位點的Ff可以顯著增加個體AD的發病風險(調整OR=1.65,95%CI=1.18~2.32);我們并沒有發現ApaI位點多態性與AD的發病風險存在顯著關聯。顯性模型顯示:與FF基因型相比,FokI位點的變異基因型Ff/ff可以顯著增加AD的發病風險(調整OR=1.61,95%CI=1.16~2.21),而ApaI位點Aa/aa基因型與AA相比,并未發現該基因型與AD發病風險存在關聯(調整OR=1.17,95%CI=0.87~1.57)(見表2)。
2.3 單倍型分析 FokI和ApaI兩個位點組成的單倍型共有4中形式,即FA、Fa、Af、af。研究結果顯示與fa單倍型相比,Fa單倍型在AD組的分布顯著低于健康對照組(調整OR=0.66,95%CI=0.51~0.85)(見表3)。
2.4 VDR基因FokI位點基因型分布與血清25(OH)D3水平的關系 采用方差分析方法,分析VDR基因FokI位點基因型分布與血清25(OH)D3水平的關系。結果顯示,在AD組和健康對照組中,FokI位點不同基因型分組中血清25(OH)D3水平有統計學差異(F=3.15,P=0.04)(見表4)。
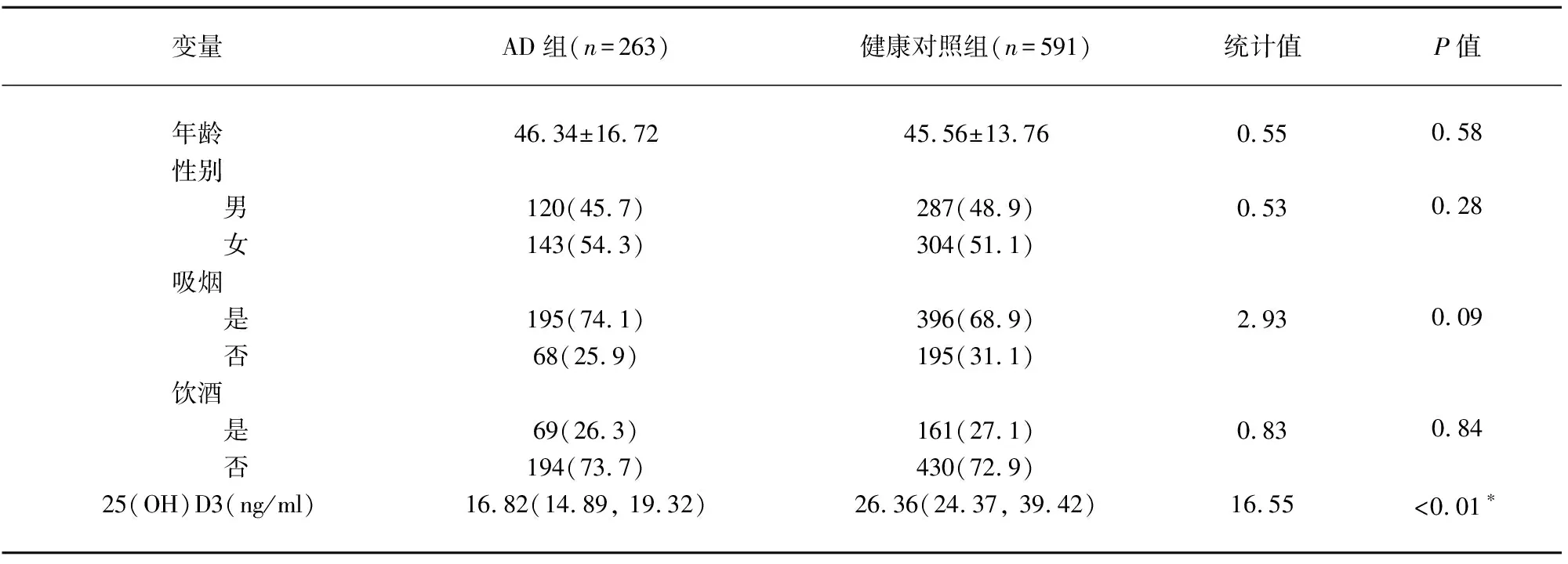
表1 AD組與健康對照組之間一般情況的比較
注:*25(OH)D3在AD組合健康對照組中的分布存在統計學差異
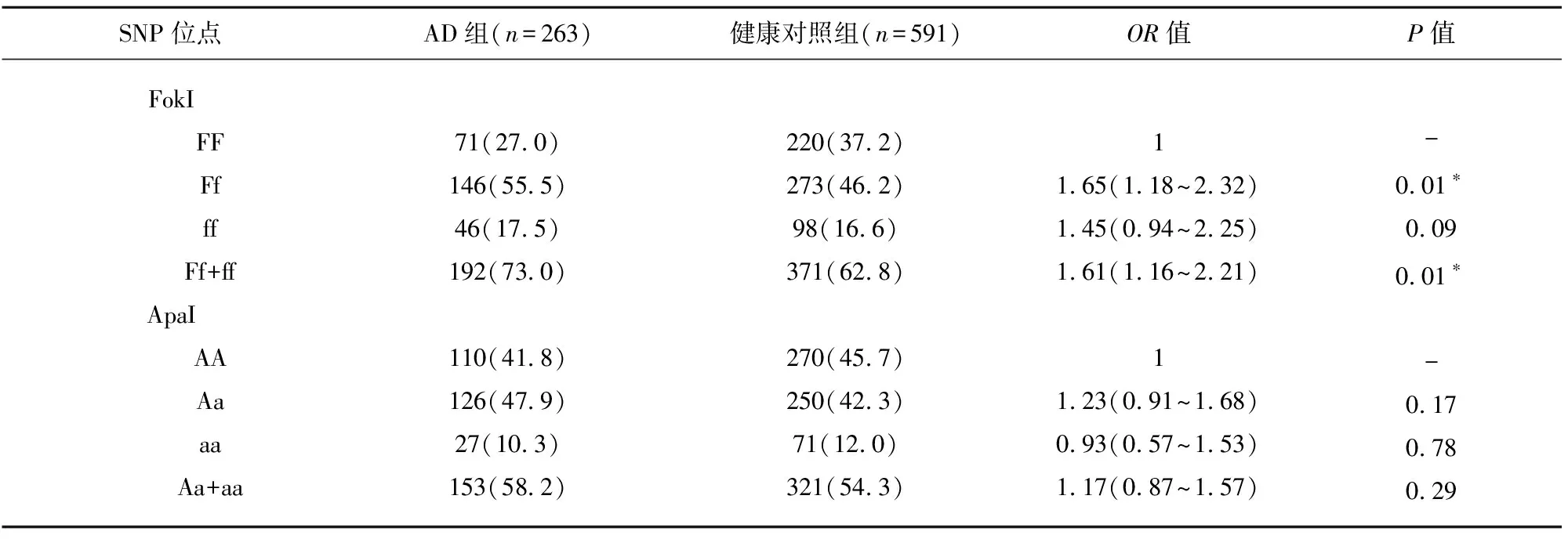
表2 VDR基因多態性與AD遺傳易感性的關系
注:調整因素分別為年齡、性別、吸煙和飲酒。*基因型在AD組合健康對照組中的分布存在統計學差異

表3 VDR基因SNP位點單倍型分析與AD發病的關聯
注:調整因素分別為年齡、性別、吸煙和飲酒。*單倍型在AD組合健康對照組中的分布存在統計學差異

表4 兩組人群中FokI不同基因型血清25(OH)D3水平分布差異
注:*在AD組和健康對照組中,FokI位點不同基因型分組中血清25(OH)D3水平有統計學差異
3 討 論
目前,關于AD的發病機制還處于研究階段,但遺傳因素已被證實在AD的發病過程中起到重要作用。其中,載脂蛋白E(apolipoprotein E,ApoE)基因、補體受體1(complement receptor 1,CR1)基因已相繼被證實與AD的發病存在關聯[6,7]。隨后,全基因組關聯研究(genome-wide association studies,GWAS)、Meta分析等研究也發現和驗證了一系列基因遺傳變異與AD的發病存在關聯。迄今為止,僅有少數國外研究發現VDR基因多態性可能與AD發病存在關聯[8,9]。本研究首次在漢族人群中探討了VDR的2個多態性位點(FokI和ApaI)與AD發病的關聯,并發現FokI位點多態性可能與AD的發病發展存在關聯。
維生素D除了可調節血清鈣水平外,還參與機體抗氧化水平、減輕抗氧化水平、清除自由基以及保護神經元等反應[10]。因此,機體血清維生素D水平可能參與了AD的發生、發展等過程。此外,維生素D與膠質細胞源性神經營養因子的合成和表達也有關,這更加提示維生素D可能對退行性神經病變有一定的應用價值。多項研究發現,AD患者血清維生素D水平普遍低于健康人群[3,4]。本研亦發現AD患者血清維生素D水平低于健康對照者,表明機體血清維生素D水平確與AD的發病風險存在關聯,且AD患者普遍存在缺乏維生素D的現象,這對AD臨床診斷具有一定的指導意義。
VDR作為一種配體激活轉錄因子在腦組織中廣泛表達,主要與維生素D形成維生素D-VDR的復合物,后者與存在于靶基因序列上的反應元件(vitamin D response element,VDRE)結合反應物,從而改變靶基因mRNA的水平[11]。VDR可能通過調節維生素D生物學功能間接影響AD的發病,而VDR的表達受控于VDR基因多態性。VDR基因可表達在神經細胞和神經膠質細胞中,其基因多態性直接影響著維生素D與其受體結合的親和性[12],從而可能影響著AD的發病、進展以及預后。Gezen-Ak等[5]首次開展了VDR基因變異與AD發病關聯的研究,發現了ApaI位點多態性可能與AD的發病存在關聯。隨后,Khorram Khorshid HR等[8]繼續在晚期AD患者中檢測VDR基因其他位點基因型的分布情況,未發現FokI、TaqI、BsmI等位點與AD的發病存在關聯。這一研究結果與本次研究結果完全相反。
在本研究中,筆者發現FokI位點的Ff可以顯著增加個體AD的發病風險,其變異基因型Ff/ff亦可顯著增加VD的發病風險。然而,未發現ApaI位點多態性與AD的發病風險存在關聯。與Gezen-Ak等研究結果不一致的原因可能是由于基因在不同人群中分布差異導致。Khorram等[13]在伊朗人群中也未發現ApaI位點多態性與AD的發病風險存在關聯,這一結果與本研究一致,可能也是由于伊朗人群與漢族人群同為亞洲人群。在單倍型研究中,我們亦發現,與fa單倍型相比,Fa單倍型在AD患者中的分布顯著低于健康對照組,由此可見,FokI位點多態性在VDR基因變異中發揮著重要作用,且這種作用在一定條件下起到主導作用。
綜上,VDR基因變異對VD遺傳易感性可能有不可忽視的作用,其可影響VD發生、發展的臨床結局。本研究在該領域尚屬首次,也存在一些不足,如樣本量不夠多、研究對象全部來自醫院,存在選擇偏移等。因此,還需進一步擴大樣本量,在其他人群中進行驗證。除此之外,環境相關的因素與遺傳因素聯合作用對VD致病機制中的影響值得深入探索。

