豌豆肽對環磷酰胺致免疫抑制小鼠免疫功能的影響
張敏佳,劉文穎,賈福懷,劉偉,周雅琳,熊菲菲,袁媛,蔡木易*,許雅君, 4
1(北京大學 公共衛生學院,營養與食品衛生學系,北京,100191) 2(中國食品發酵工業研究院有限公司,北京市蛋白功能肽工程技術研究中心,北京,100015) 3(寧波御坊堂生物科技有限公司,浙江 寧波,315012) 4(食品安全毒理學研究與評價北京市重點實驗室,北京,100191)
生物活性肽是指對生物機體的生命活動有益或具有生理作用的肽類化合物,生物學意義主要體現在其優于氨基酸的吸收機制和生理功能。已有研究顯示,不同種類的生物活性肽具有抗血栓、抗高血壓、降膽固醇、抗氧化和清除自由基等生物學作用[1]。目前,人們已從動物、植物和微生物中制備了許多不同種類的生物活性肽[2],其中植物蛋白來源主要是谷物,如大豆、小麥、大米、燕麥和黑麥等[3]。植物蛋白由于其來源廣泛,價格低廉,以其為原料利用適當方法制備的低聚肽生物效價可接近動物蛋白,因此對植物源生物活性肽的研究開發日益受到人們的重視[4]。
豌豆,別稱寒豆、麥豆、雪豆、畢豆、國豆等,種植廣泛,是我國重要的農作物之一。豌豆的主要成分是淀粉和蛋白質,豌豆蛋白是一種優質蛋白,氨基酸比例均衡,基本達到FAO/WHO推薦模式值[5]。目前,我國對于豌豆蛋白尚未能進行充分開發利用,相關研究較少,有限的研究發現豌豆蛋白水解物具有抗氧化活性[6],但對于豌豆肽的其他功能鮮有探索。本實驗以CTX誘導的免疫抑制小鼠為模型,探究豌豆肽對免疫抑制小鼠免疫功能的影響,為豌豆肽的進一步開發利用提供理論依據。
1 材料與方法
1.1 材料與試劑
本實驗所用豌豆肽干粉以豌豆蛋白為原料,經酶解、精制、噴霧干燥、包裝后所得。
酪蛋白(Sigma C5890),環磷酰胺(Sigma C0768),北京寶瑞杰科技有限公司。
1.2 儀器與設備
電子天平(奧豪斯SPN3001F),電子天平(賽多利斯BS2000S),NIKON TE2000-S 倒置熒光顯微鏡,全自動血細胞分析儀(日本光電工業株式會社,MEK-6318K),流式細胞儀(美國BD FACS Calibur),羅氏全自動生化儀501,超微量分光光度計(德國Nano Photometer P-Class)。
1.3 實驗動物
健康SPF級雌性ICR小鼠,6~8周齡,體重(27±2) g,由北京大學醫學部實驗動物中心提供[SCXK(京)2016—0010]。動物飼養在屏障環境,溫度控制在(22±2)℃,相對濕度50%~60%,晝夜照明時間為12 h∶12 h。實驗期間動物自由飲水和進食。
1.4 實驗動物分組與處理
實驗動物適應性喂養3 d后,稱量初始體重,按體重隨機分為5組,每組12只,分別為對照組,CTX模型組及豌豆肽低、中、高劑量組。實驗第1~3天,除對照組外,其余各組每天腹腔注射80 mg/(kg·bw)CTX,建立免疫抑制小鼠模型,對照組每天注射等量生理鹽水。第4天起,每天給予對照組和CTX模型組1.6 g/(kg·bw)酪蛋白灌胃,豌豆肽低、中、高劑量組分別給予0.4、0.8、1.6 g/(kg·bw)豌豆肽,灌胃體積為0.1 ml/(10 g·bw),連續灌胃15 d后動物隔夜禁食,第二天晨起進行指標檢測。
1.5 檢測指標及方法
1.5.1 體重和免疫臟器指數
分別于分組前及實驗第15天稱量動物初始體重和終末體重,并于動物處死前再次稱量體重,用于免疫臟器指數計算。摘眼球取血后,斷頸處死小鼠,分離脾臟和胸腺,并用電子天平稱重,分別計算脾臟指數和胸腺指數,臟器指數=臟器質量(mg)/體質量(g)。
1.5.2 免疫臟器形態學觀察
將稱重后的脾臟和胸腺固定于4%甲醛溶液中,石蠟包埋、切片,蘇木精-伊紅染色(hematoxylin-eosin staining ,HE 染色) ,顯微鏡下觀察脾臟組織和胸腺組織的形態學變化。
1.5.3 外周血白細胞計數
動物摘眼球取血,取適量全血于EDTA抗凝管中,立即顛倒混勻,使用全自動血細胞分析儀計數白細胞。
1.5.4 骨髓有核細胞計數和DNA含量
每組取6只小鼠股骨進行骨髓有核細胞計數[7]:去除股骨附著的肌肉及結締組織,用1 mL Hank′s液將骨髓液沖洗至已加入EDTA的離心管內。吸取0.38 mL 0.1 mol/L HCl溶液于另一離心管,加入混勻后的骨髓液20 μL混勻,靜置2~3 min待紅細胞溶解。取20 μL沖入細胞計數板進行計數。
另每組取6只小鼠股骨進行骨髓DNA含量檢測[8]:吸取10 mL 5 mmol/L的CaCl2溶液,將全部骨髓沖入離心管中,在4 ℃條件下放置30 min,2 500 r/min離心15 min,棄掉上清,向沉淀物中加入0.2 mol /L的HClO4溶液5 mL,充分混勻,90 ℃水浴15 min,冷卻至室溫后,3 500 r/min離心15 min,取上清液,用超微量分光光度計在260 nm處測定吸光度A260值,計算骨髓DNA含量。
1.5.5 外周血免疫球蛋白含量測定
動物摘眼球取血,離心制血清,取200 μL血清使用全自動生化儀檢測免疫球蛋白IgG、IgM含量。
1.5.6 外周血、脾臟T 淋巴細胞亞群檢測
收集小鼠脾臟制備單細胞懸浮液,350×g離心5 min,棄上清,加入2 mL 1×裂解液將細胞沉淀重懸。冰上孵育5 min后加入2 mL PBS,350×g離心5 min,棄上清,加入1 mL PBS。計數細胞,調整濃度為1×106/100 μL。取100 μL細胞懸液于流式管,加入3種熒光染料綴合的抗體,避光孵育30 min,每5 min混勻1次。加入1 mL PBS清洗細胞,350×g離心5 min,棄上清,加300 μL 2%多聚甲醛溶液重懸細胞,用流式細胞儀檢測CD3+、CD4+和CD8+細胞亞群百分比。
1.5.7 血清中細胞因子水平測定
取50 μL血清,采用流式微球陣列(cytometric bead array,CBA)液相多重蛋白定量技術檢測細胞因子水平。使用Biolegend Multi-Analyte Flow Assay Kit并按其說明書制備標準品及待測樣品,用流式細胞儀進行檢測。
2 結果
2.1 豌豆肽對免疫抑制小鼠體重和免疫臟器指數的影響
如表1所示,各組小鼠初始體重和終末體重無統計學差異(p>0.05),各組胸腺指數和脾臟指數也無統計學差異(p>0.05)。
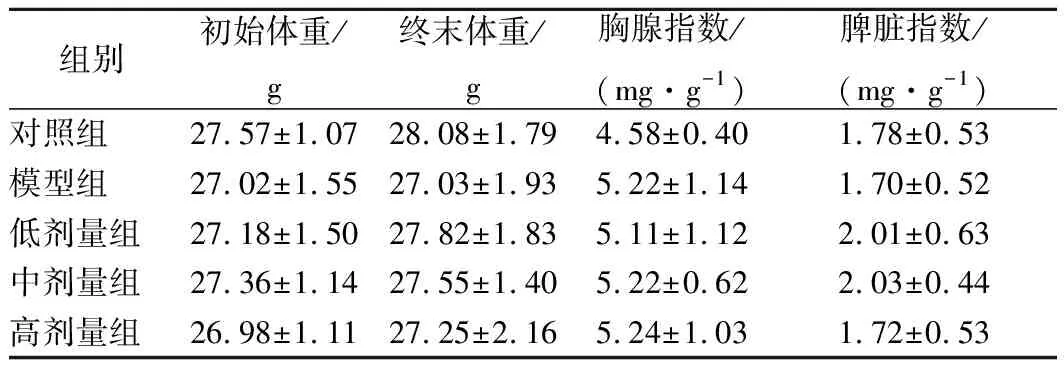
表1 豌豆肽對免疫抑制小鼠體重和免疫臟器指數的影響Table 1 Effects of pea peptide on body weight and immune organ index of immunosuppression mice induced by CTX
2.2 豌豆肽對免疫抑制小鼠脾臟和胸腺組織結構的影響
顯微鏡下脾臟HE染色切片如圖1所示,對照組脾臟組織結構清晰,白髓、紅髓、邊緣區界限明顯,脾小結發育良好。CTX模型組白髓與紅髓界限模糊,脾小結不完整。與模型組相比,豌豆肽低、中、高劑量組脾小結結構逐漸恢復,脾臟結構逐漸清晰。
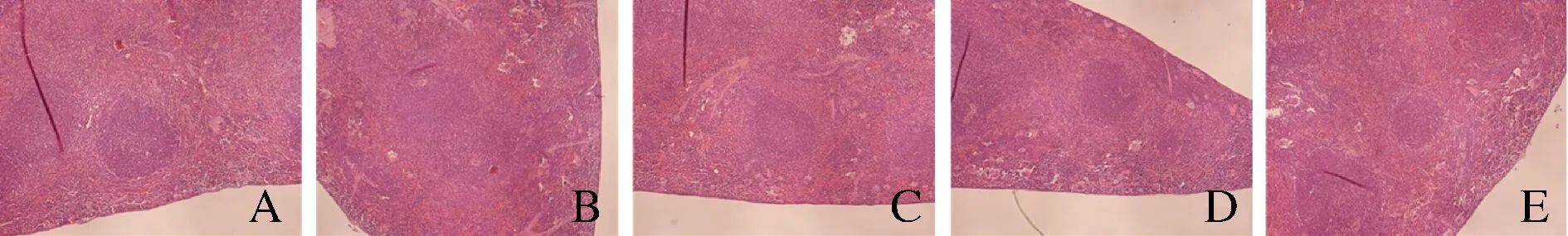
A-對照組;B-模型組;C-低劑量組;D-中劑量組;E-高劑量組圖1 豌豆肽對免疫抑制小鼠脾臟組織形態學變化的影響(×100)Fig.1 Effects of pea peptide on morphologic variations of spleen of immunosuppression mice induced by CTX(×100)
胸腺HE染色切片如圖2所示,對照組胸腺皮質、髓質結構清晰,皮質染色較深且面積大于髓質,淋巴細胞排列緊密。CTX模型組胸腺皮質、髓質分界不清,皮質面積減小,髓質面積增大,皮質區淋巴細胞減少。與模型組相比,豌豆肽低、中、高劑量組皮質面積呈劑量依耐性增加,皮、髓交界清晰。
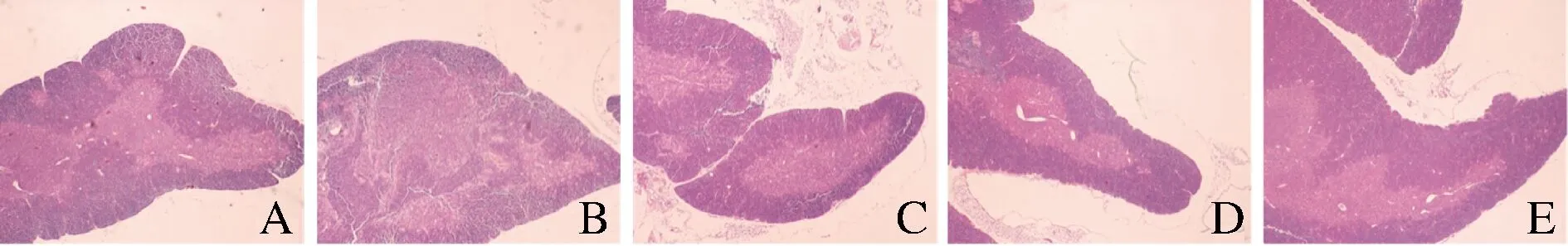
A-對照組;B-模型組;C-低劑量組;D-中劑量組;E-高劑量組圖2 豌豆肽對免疫抑制小鼠胸腺組織形態學變化的影響(×40)Fig.2 Effects of pea peptide on morphologic variations of thymus of immunosuppression mice induced by CTX(×40)
2.3 豌豆肽對免疫抑制小鼠外周血白細胞計數的影響
如表2所示,與對照組相比,CTX模型組小鼠外周血白細胞計數顯著下降(p<0.05);豌豆肽干預后白細胞計數有不同程度的恢復,低劑量組與模型組相比有所增高,但差異無統計學意義(p>0.05),與對照組相比仍明顯偏低(p<0.05),而豌豆肽中、高劑量組外周血白細胞計數比模型組顯著增高(p<0.05),且恢復到了對照組的水平。
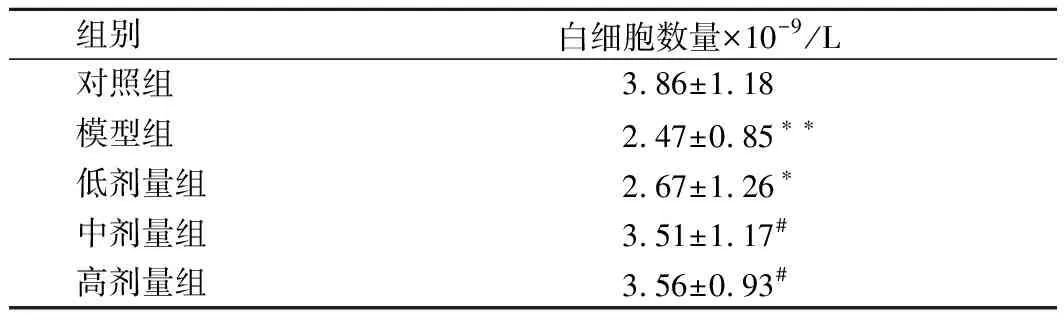
表2 豌豆肽對免疫抑制小鼠外周血白細胞計數的影響Table 2 Effect of pea peptide on white blood cell count of immunosuppression mice induced by CTX
注:與對照組相比,*p<0.05,**p<0.01;與模型組相比,#p<0.05,##p<0.01,下表同。
2.4 骨髓有核細胞計數和DNA含量
如表3所示,與對照組相比,CTX模型組骨髓有核細胞濃度和骨髓DNA含量均顯著下降(p<0.01)。與模型組相比,豌豆肽低、中、高劑量組骨髓有核細胞濃度有不同程度的升高,低劑量組與模型組相比差異不顯著(p>0.05),中、高劑量組與模型組相比差異有統計學意義(p<0.01,p<0.05);豌豆肽低、中、高劑量組骨髓DNA含量與模型組相比均有顯著升高(p<0.05)。
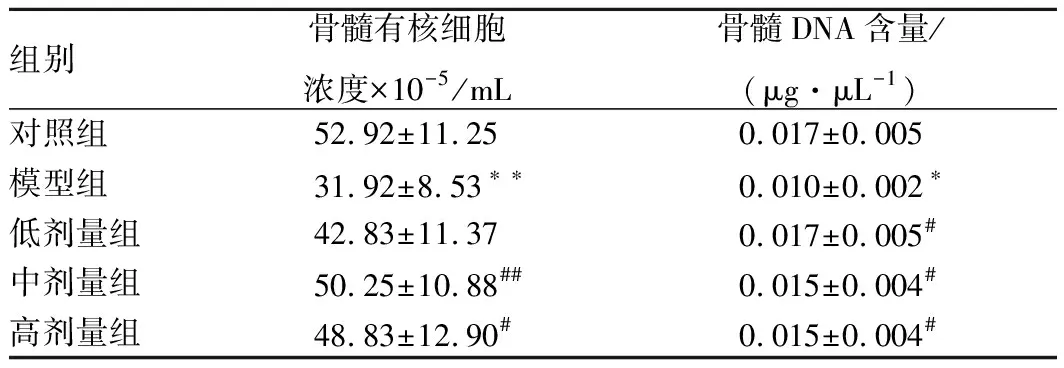
表3 豌豆肽對免疫抑制小鼠骨髓有核細胞濃度和DNA含量的影響Table 3 Effect of pea peptide on nucleated cell counts and DNA density in bone marrow of immunosuppression mice induced by CTX
2.5 外周血免疫球蛋白含量測定
如表4所示,與對照組相比,CTX模型組外周血免疫球蛋白IgG、IgM含量顯著降低(p<0.01)。與模型組相比,豌豆肽高劑量組IgG、IgM含量顯著升高(p<0.01,p<0.05)。

表4 豌豆肽對免疫抑制小鼠外周血免疫球蛋白IgG、IgM含量的影響Table 4 Effect of pea peptide on concentration of immunoglobulin IgG and IgM of immunosuppression mice induced by CTX
2.6 脾臟T 淋巴細胞亞群檢測
如表5所示,與對照組相比,CTX模型組CD3+、CD4+、CD8+淋巴細胞百分比均顯著降低(p<0.01)。與模型組相比,豌豆肽低劑量組CD3+、CD4+、CD8+T淋巴細胞百分比有所改善,但差異不顯著(p>0.05);豌豆肽中劑量組CD3+、CD4+淋巴細胞百分比有不同程度的增高,差異有統計學意義(p<0.01,p<0.05),CD8+T淋巴細胞百分比有所改善,但差異不顯著(p>0.05);豌豆肽高劑量組CD3+淋巴細胞百分比顯著增高(p<0.05),CD4+、CD8+T淋巴細胞百分比有所改善,但差異不顯著(p>0.05)。
2.7 血清中細胞因子水平測定
如表6所示,與對照組相比,CTX模型組小鼠外周血中IFN-γ濃度顯著降低(p<0.05)。與模型組相比,豌豆肽中、高劑量組小鼠外周血中IFN-γ濃度顯著升高(p<0.05),與對照組相比差異無統計學意義(p>0.05)。另外,豌豆肽低劑量組小鼠外周血中IL-9、IL-17A濃度與模型組相比顯著(p<0.05),與對照組相比差異無統計學意義(p>0.05)。其他各細胞因子(TNF-α、IL-2、IL-4、IL-6)濃度在各組之間差異無統計學意義。
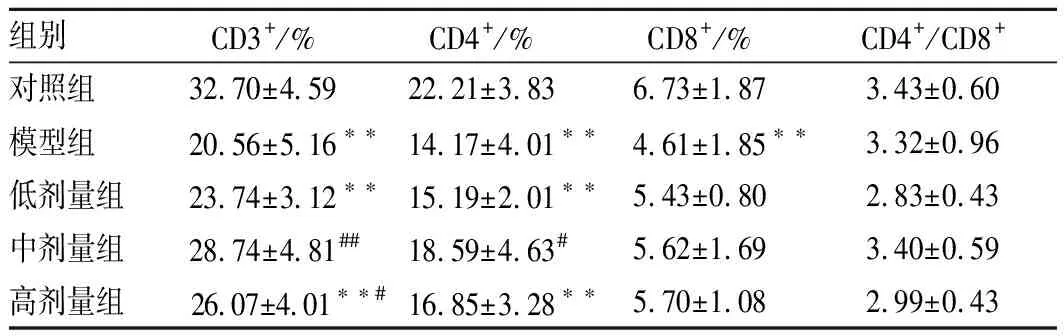
表5 豌豆肽對免疫抑制小鼠脾臟T淋巴細胞亞群的影響Table 5 Effect of pea peptide on T-lymphocyte subsets of spleen of immunosuppression mice induced by CTX
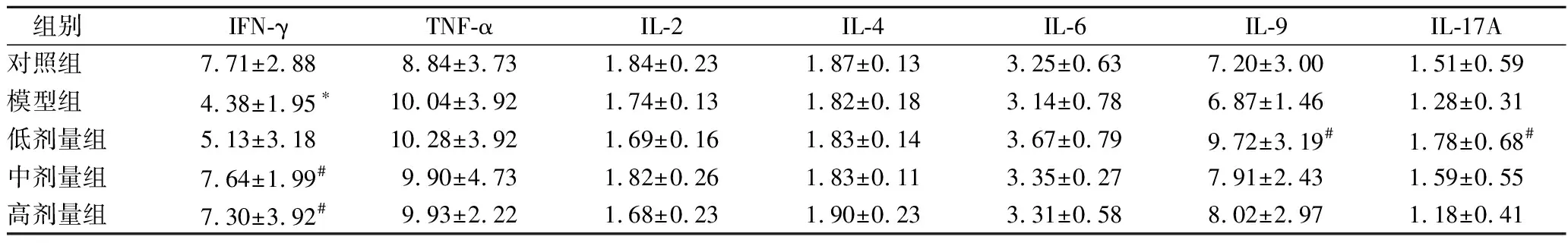
表6 豌豆肽對免疫抑制小鼠外周血細胞因子水平的影響Table 6 Effect of pea peptide on T-lymphocyte subsets of spleen of immunosuppression mice induced by CTX
3 討論
植物蛋白占世界蛋白供應總量的70%以上[4], 因其營養豐富,價格低廉而日益受到人們的重視。我國幅員遼闊,植物資源豐富,許多重要的農作物如大豆、小麥、玉米等均被開發出多種蛋白產品及其生物活性肽產品[3]。豌豆也是我國重要的農作物之一,但目前對于豌豆蛋白尚未能進行充分開發利用,其生物活性肽產品的功能學研究更少。實驗中所用豌豆肽含有豐富氨基酸,其中谷氨酸和谷氨酰胺含量最高,已有研究[9-12]顯示谷氨酰胺具有重要的免疫調節功能,因此,本實驗采用目前制備動物免疫抑制模型中應用廣泛的CTX[13],建立免疫抑制小鼠模型。同時,給予不同劑量豌豆肽干預15 d,探究豌豆肽的免疫調節功能。
實驗結果顯示,各組小鼠初始體重和終末體重無統計學差異(p>0.05),提示環磷酰胺及環磷酰胺與豌豆肽對小鼠的生長發育無明顯影響。免疫器官指數是衡量機體免疫功能的初步指標,本實驗結果顯示,各組胸腺指數和脾臟指數無統計學差異(p>0.05),可能是由于影響胸腺和脾臟指數的因素較多,準確性難以保證,并且已有文獻指出免疫器官質量不能單獨作為評價免疫毒性的指標[14],相似結果也在多項研究中出現[7, 15-16]。與空白對照組相比,模型組小鼠脾臟和胸腺鏡下形態學結構紊亂,外周血白細胞計數、CD3+、CD4+、CD8+T淋巴細胞百分比、免疫球蛋白IgG和IgM含量、骨髓有核細胞濃度和DNA含量均顯著低于對照組(p<0.01),細胞因子IFN-γ濃度明顯低于對照組(p<0.05),提示免疫抑制模型建立成功。
免疫器官是機體執行免疫功能的重要部分,是免疫細胞產生、分化、成熟和增值的場所,脾臟是機體最大的免疫器官,參與調解細胞和體液免疫,而胸腺是機體的主要中樞免疫器官,是T細胞生長、分化和成熟的場所,脾臟和胸腺在質量和形態結構上的改變可在一定程度上反應機體免疫功能的變化[17]。本實驗結果顯示,各組小鼠脾臟、胸腺指數與對照組相比無明顯變化,但CTX模型組小鼠脾臟、胸腺組織結構被破壞,而豌豆肽組小鼠脾臟、胸腺結構有所改善,且隨劑量升高而更接近對照組,提示豌豆肽對兩大免疫器官的組織結構具有保護作用。
白細胞是機體防御系統的重要組成部分,骨髓是人體的造血組織,也是重要的免疫組織,白細胞計數顯著降低和骨髓的抑制狀態反映機體免疫功能下降。實驗結果顯示,CTX模型組小鼠外周血白細胞計數、骨髓有核細胞計數和DNA含量顯著降低,豌豆肽可增加免疫抑制小鼠的白細胞計數、骨髓有核細胞數量以及骨髓DNA含量,可改善免疫抑制小鼠的免疫功能和骨髓抑制狀態。
免疫球蛋白是機體在抗感染方面的重要屏障,IgG、IgM是活化B淋巴細胞產生的主要免疫球蛋白,可反映機體的體液免疫功能[18]。實驗結果顯示,CTX模型組小鼠外周血免疫球蛋白IgG和IgM含量顯著降低,豌豆肽可增加免疫抑制小鼠免疫球蛋白IgG、IgM含量,表明豌豆肽對免疫抑制小鼠的體液免疫具有改善作用。
T淋巴細胞是一類在胸腺中成熟隨后遷移至外周淋巴組織的淋巴細胞,在細胞免疫中起核心作用。細胞膜表面的CD3+為成熟T細胞表面標志,反映總T淋巴細胞水平,根據CD4+和CD8+分子表達情況,可將成熟的T細胞分為CD4+或CD8+細胞,CD4+細胞即T輔助細胞(Th細胞),CD8+細胞即細胞毒性T細胞。T淋巴細胞亞群的平衡是反映機體免疫穩態的重要指標[19]。實驗結果顯示,CTX模型組CD3+、CD4+、CD8+淋巴細胞百分比顯著降低,顯示免疫低下狀態。與模型組相比,豌豆肽中劑量組CD3+、CD4+淋巴細胞百分比有不同程度的增高,差異有統計學意義,豌豆肽高劑量組CD3+淋巴細胞百分比顯著增高,且各豌豆肽劑量組CD3+、CD4+、CD8+淋巴細胞百分比均比模型組升高,表明豌豆肽能調整免疫低下小鼠T淋巴細胞亞群的異常分布,對CTX致免疫低下小鼠的細胞免疫具有一定的改善作用。
細胞因子是由免疫細胞和某些非免疫細胞經刺激而合成、分泌的一類具有廣泛生物學活性的小分子蛋白質,在免疫應答中占據著重要地位。CD4+T淋巴細胞存在許多亞群,包括Th1、Th2、Th17、Treg、Th9等[20]。Th1細胞主要通過分泌IFN-γ、IL-2、TNF-α等介導細胞免疫應答;Th2細胞主要通過產生IL-4、IL-6等細胞因子輔助體液免疫應答;Th17可通過分泌IL-17A、IL-17F等因子抵御胞外細菌和真菌感染;Th9作為一種新發現的CD4+T細胞亞群,其分泌的主要細胞因子IL-9參與寄生蟲感染、自身免疫性疾病、腫瘤免疫等過程[20-22]。本研究顯示,豌豆肽將免疫抑制小鼠外周血細胞因子IFN-、IL-9、IL-17A水平改善至正常,提示豌豆肽可能通過調節IFN-γ、IL-9、IL-17A等細胞因子的分泌進而影響其介導的免疫反應。
實驗結果顯示,豌豆肽對于不同免疫的調節作用最佳有效劑量不同,對于大多數免疫指標來說,在本研究劑量范圍內,隨著干預劑量的增加,豌豆肽的免疫調節效果越顯著。綜上所述,豌豆肽能夠通過改善免疫器官發育、骨髓抑制狀態、免疫球蛋白含量、T淋巴細胞亞群百分比和細胞因子水平改善CTX致免疫抑制小鼠的免疫功能。本研究為豌豆肽的進一步開發利用提供了理論依據。

