航天搭載對嗜熱鏈球菌G2的誘變作用及發酵性能評價
王瑩,孫二娜 ,隋馨瑤,趙亮,3,孫健,牛天嬌,張明,文鵬程*
1(甘肅農業大學 食品科學與工程學院,甘肅 蘭州,730070) 2(中國農業大學 食品科學與營養工程學院,北京,100083) 3(河北省畜產食品工程技術研究中心,河北 三河,065200) 4(蒙牛高科乳制品(北京)有限責任公司,北京,101107) 5(北京工商大學 食品學院,北京,100048)
航天搭載是把菌株搭乘返回式衛星送到太空,利用太空中特殊的環境誘變作用使菌株產生突變,主要是通過強輻射、微重力、高真空等太空綜合環境因素誘發其變異。因為空間變異的突變頻率高、突變譜廣、變異幅度大同時變異性狀穩定,所以航天誘變成為近年來發展迅速的新型微生物誘變育種技術[1]。航天誘變其有益突變可達2%~3%[2],且有益變異的頻率比傳統的γ射線處理要明顯提高[3]。作為人工誘變的新途徑,航天誘變對豐富種質資源、選育新品種具有重要的意義[4]。
嗜熱鏈球菌是原核微生物中的鏈球菌屬,是能夠利用乳糖的同型發酵生成乳酸的兼性厭氧菌,為革蘭氏陽性菌[5]。嗜熱鏈球菌一般與德氏乳桿菌保加利亞亞種配合,作為發酵劑廣泛應用于酸乳生產。嗜熱鏈球菌產酸特性、代謝產物直接影響酸乳生產過程,以及風味、質構等酸乳品質。嗜熱鏈球菌產酸速度快(主要在發酵前期產酸),且能縮短凝乳時間[6],提高生產效率,從而降低了酸乳的生產成本。菌株產生的胞外多糖不僅賦予酸乳特殊的風味和口感,而且還能提高其穩定性和持水性,從而減少酸乳在生產過程中穩定劑的使用[7-8]。但是不同的嗜熱鏈球菌種直接會影響酸乳產品的質量,而且不同的菌株發酵特性也有較大差異,所以篩選出優良發酵性能的嗜熱鏈球菌是制備發酵劑及酸奶的基礎[9]。
嗜熱鏈球菌G2是從新疆奶疙瘩中篩選出的1株產酸快、凝乳早且黏度高的菌株,將其作為出發菌株并搭載神舟十一號返回式飛船進行太空誘變處理,返回地面后進行菌株分離純化,通過發酵及一系列產酸特性、產黏及產胞外多糖等指標的研究,以期獲得具有優良發酵性狀的突變株,并為優良發酵劑菌種的選擇和發酵乳制品的開發提供理論依據。
1 材料與方法
1.1 原料
嗜熱鏈球菌G2凍干菌粉置于無菌搭載小管中,搭載前4 ℃保存。“神舟十一號”返回式飛船2016年10月17日發射,2016年11月18日返回地面,飛行過程中樣品置于飛船返回艙,返回地面后取出樣品,由中國農業大學食品科學與營養工程學院功能乳品實驗室保存備用。
1.1.1 培養基
10%復原脫脂乳用于菌株發酵試驗,M17培養基用于嗜熱鏈球菌的分離純化。
1.1.2 主要儀器設備
LDZX-50KBS高壓滅菌鍋;LXJ-IIB高速臺式離心機;UV-2102PC紫外可見分光光度計;DNP9082恒溫培養箱 ;SNB-2黏度計;pH計;Biocreen C全自動生長曲線儀;JEM 1200EX透射電子顯微鏡;SU8010場發射掃描電鏡。
1.2 試驗方法
1.2.1 樣品分離純化[10]
搭載返回的G2凍干菌粉在無菌條件下稱取0.1 g菌粉至9.9 mL生理鹽水中,以10倍稀釋法從10-1稀釋到10-10,取5個稀釋梯度10-4~10-8,分別吸取稀釋液各1 mL,進行平板稀釋,每個梯度做2個平行。平板在恒溫培養箱中42 ℃培養48 h,隨機挑選10個單菌落進行液體培養。在M17平板上進行多次劃線純化并挑取單菌落,經鏡檢確認為純種,進行液體培養,作為搭載菌株用于后續實驗。
1.2.2 脫脂乳培養基制備
10%脫脂乳粉10 mL于試管中,110 ℃滅菌10 min備用,將M17培養基培養的第2代菌接種于脫脂乳培養基待測。
1.2.3 生長曲線測定[11]
菌種以2%的接種量接種于新鮮的M17液體培養基中,42 ℃條件下進行培養,在不同時間點、600 nm處測定菌液的吸光度值。
1.2.4 pH值測定[12]
用pH計測定發酵乳的pH值。
1.2.5 酸度測定[13]
以0.5%酚酞作為指示劑,用0.1 mol/L的NaOH標準溶液滴定,用吉爾涅爾度(°T)表示。樣品取3個平行,取其平均值。
1.2.6 黏度測定[14]
采用SND-2黏度計在室溫下測定。讀數選擇停留時間較長且偏大的數值記錄。樣品取3個平行,取其平均值。
1.2.7 活菌數測定[15]
吸取1 mL發酵液至9 mL 0.8%生理鹽水中,振蕩混勻后采用10倍稀釋,吸取1 mL稀釋液進行平皿傾注,42 ℃恒溫培養48 h,以測定發酵乳中嗜熱鏈球菌的活菌數。
1.2.8 胞外多糖的分離與含量測定[16]
胞外多糖的提取:將第二代菌接入10%脫脂乳培養基中,發酵12 h,取10 mL發酵乳加入15%三氯乙酸,4 ℃下放置3 h,10 000 r/min離心30 min,取上清液備用。取上清液加入無水乙醇(1∶5,V∶V),4℃放置12 h;將上清液與無水乙醇的混合液10 000 r/min離心30 min,棄上清,加入10 mL蒸餾水,即為待測樣品。采用苯酚-硫酸法測定多糖含量;測定時吸取樣品1 mL,加入5%苯酚1 mL迅速搖勻,再加入5 mL濃硫酸冷卻至室溫,在490 nm處測定吸光值。
1.2.9 電鏡測試
1.2.9.1 掃描電鏡測試
取樣:取大量樣品離心(轉速 3 000~4 000 r/min),去除上清液,加入適當 pH(7.2~7.4)的0.1 mol/L PBS清洗3遍;清洗時菌體溫柔懸浮。固定:2.5%戊二醛固定3 h,用PBS清洗2遍,每遍10 min,再用純水清洗2遍。梯度脫水:用乙醇的水溶液按體積分數為 30%、50%、70%、80%、90%的梯度對樣品進行脫水,每步 15 min,之后在100%乙醇的水溶液中脫水 15 min×2次;再將樣品置于乙醇和叔丁醇 1∶1(V∶V)混合液中15min;最后置樣品于叔丁醇中 15 min×2次。冷凍干燥:滴加處理好的樣品于5×5 mm的蓋玻片上,置-80 ℃冰箱冷凍后放入冷凍干燥機(或者臨界點干燥儀)中冷凍干燥。電鏡觀察:樣品充分干燥后,進行掃描電鏡觀察。
1.2.9.2 透射電鏡測試
取樣:取大量樣品離心(轉速 3 000~4 000 r/min),去除上清液,加入適當 pH(7.2~7.4)的0.1 mol/L PBS清洗3遍;清洗時菌體溫柔懸浮。固定:2.5%戊二醛固定3 h,用PBS清洗2遍,每遍10 min。再用純水清洗2遍。梯度脫水。用乙醇的水溶液按體積分數為 30%、50%、70%、80%、90%的梯度對樣品進行脫水,每步 15 min,之后在100%乙醇的水溶液中脫水15 min×2次;再將樣品置于乙醇和叔丁醇 1∶1(V∶V)混合液中15 min;最后置樣品于叔丁醇中15 min×2次。之后進行電鏡觀察。
1.3 數據處理與分析
所有數據均平行測定3次,使用SPSS19.0軟件進行ANOVA方差分析,采用 ANOVA 進行方差分析,采用鄧肯氏多重比較方法進行顯著性分析。
2 結果與討論
2.1 生長曲線
42 ℃條件下培養,每隔2 h在600 nm處測定菌液的吸光度值。它能夠顯示細菌生長繁殖的4個時期,即調整期、對數期、穩定期和衰亡期[17-18]。通過利用紫外分光光度計來測定菌液生長曲線能夠實時監控菌體的生長情況[19]。從表1和圖1可以看出,航天誘變得到的突變菌株B1-5、B2-1和B2-4生長狀況與野生菌株G2大致相似,并沒有發生明顯改變,但是B1-1、B1-2、B1-3、B2-2、B2-5、B2-6和B2-7 OD600顯著低于野生菌株G2。因此,將B1-5、B2-1和B-4作為后續試驗待測菌株。
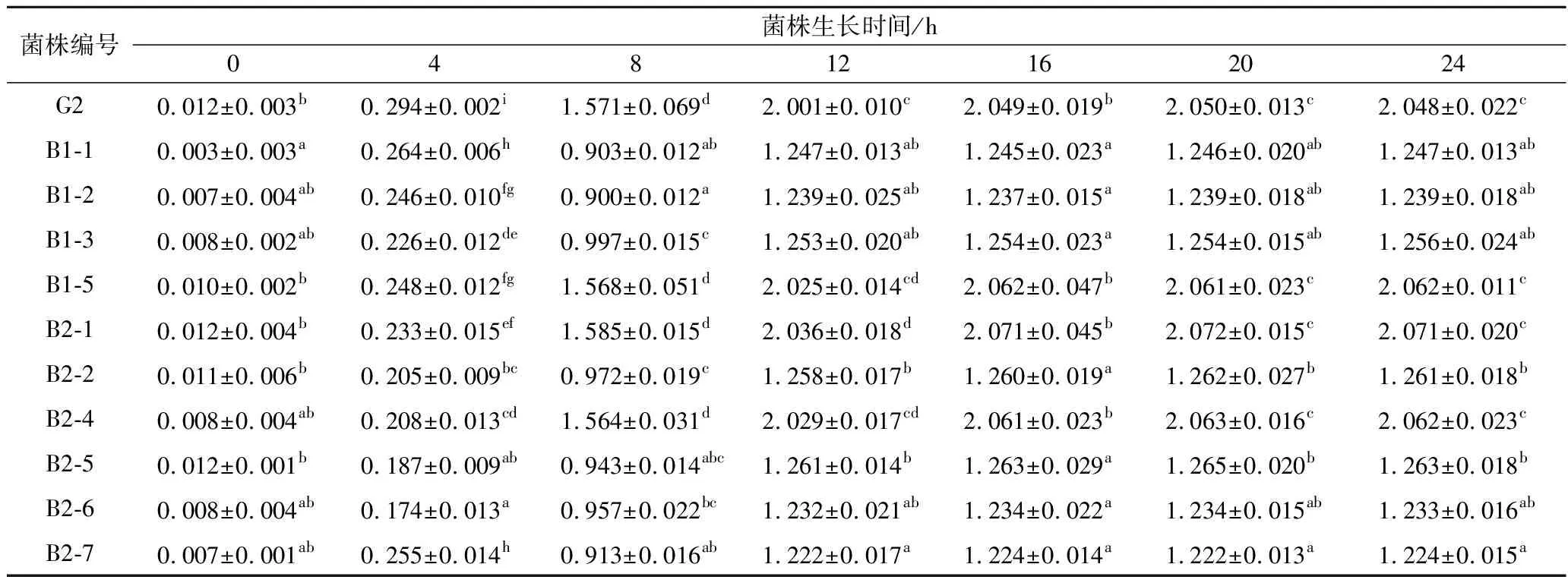
表1 搭載菌株生長曲線測定(OD600)Table 1 OD600 value within 24 h of Streptococcus thermophiles
注:同列字母不同,表示差異顯著(p<0.05)。
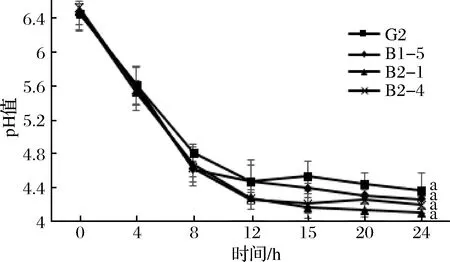
圖1 四株嗜熱鏈球菌發酵期間pH值的變化Fig.1 Change in pH during fermentation
2.2 pH值測定
嗜熱鏈球菌作為常用的乳酸菌發酵劑之一,能夠利用脫脂乳中的乳糖進行同型發酵產生乳酸,從而使發酵乳中的pH降低,滴定酸度升高。由圖2可知,在發酵前4 h內突變株與野生株的pH變化不大,主要是由于在4 h內菌株正在處于延滯期,菌體活力較低,還沒有開始生長[20]。從8 h開始,各菌株pH有所差異。當發酵到12 h時,G2發酵乳平均pH值從pH 6.46下降到pH 4.46,B1-5、B2-1和B2-4發酵乳的平均pH值分別從pH 6.45、pH 6.48和pH 6.52分別下降到pH 4.66、pH 4.27和pH 4.25,其中B2-1和B2-4的發酵乳平均pH值顯著低于野生菌株G2(p<0.05);到達發酵終點24 h時,G2發酵乳平均pH值下降到pH 4.35,3株突變株發酵乳平均pH值下降到pH 4.25、pH 4.09和pH 4.18,與野生株均沒有顯著性差異(p<0.05)。
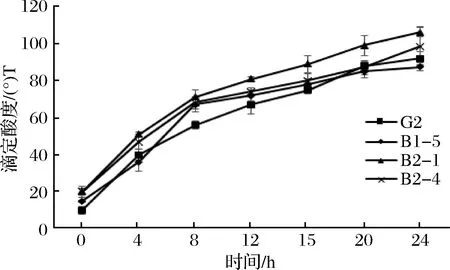
圖2 四株嗜熱鏈球菌發酵期間滴定酸度的變化Fig.2 Change in sample acidity during fermentation
2.3 滴定酸度測定
由圖3可知,在發酵4 h時,野生株G2的滴定酸度從10 °T上升到40 °T,突變株B1-5、B2-1和B2-4的滴定酸度分別從15、20、20 °T升高到36、51、47 °T,且在4 h時發酵乳開始凝乳,利用乳糖生成乳酸使得酸度開始積累。當達到發酵終點24 h時,G2的滴定酸度達到92 °T,而突變株的滴定酸度分別是87.5、106和98.5 °T,且各菌株之間滴定酸度具有顯著性差異(p<0.05)。同時,從表2可知,B2-1的產酸速率最大,達到3.58 °T/h。
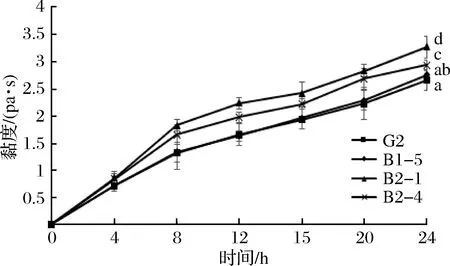
圖3 四株嗜熱鏈球菌發酵期間黏度的變化Fig.3 Change in sample viscosity during fermentation

表2 嗜熱鏈球菌發酵終點滴定酸度及產酸速率Table 2 Titration acidity at the end of the fermentation and acid-producing rate of Streptococcus thermophilus
注:同列字母不同,表示差異顯著(p<0.05)。
2.4 活菌數測定
活菌數是評價發酵乳制品的重要指標之一,同時也是篩選優良發酵劑的重要標準之一[21]。當乳酸菌的活菌數大于106CUF/mL時,才會有乳酸菌在腸道中存活而發揮其保健作用[22]。從表3看出,嗜熱鏈球菌在發酵至24 h期間活菌數都有不同程度的上升,說明在發酵期內,菌株活力良好。在發酵至16 h時,嗜熱鏈球菌數量基本保持穩定。
2.5 黏度測定
在酸乳發酵過程中,嗜熱鏈球菌可以通過酶的作用利用脫脂乳中的糖類形成一種活性物質胞外多糖(EPS),它是酸乳中天然的增稠劑,它與EPS達到含量呈正相關[23]。圖4可以看出,黏度隨著發酵時間的增加而增加,在發酵0~4 h期間,pH和滴定酸度變化較小,黏度變化不大,當發酵8 h時,其pH下降到4.6左右,酪蛋白達到了等電點開始發生變性,酪蛋白分子團的直徑變大,黏度開始上升[24]。從圖中看可以看出,突變株B2-1和B2-4的黏度顯著高于野生株G2。
表3 菌株發酵期間活菌數的變化Table 3 Changes in viable cell count during fermentation
注:同列字母不同,表示差異顯著(p<0.05)。
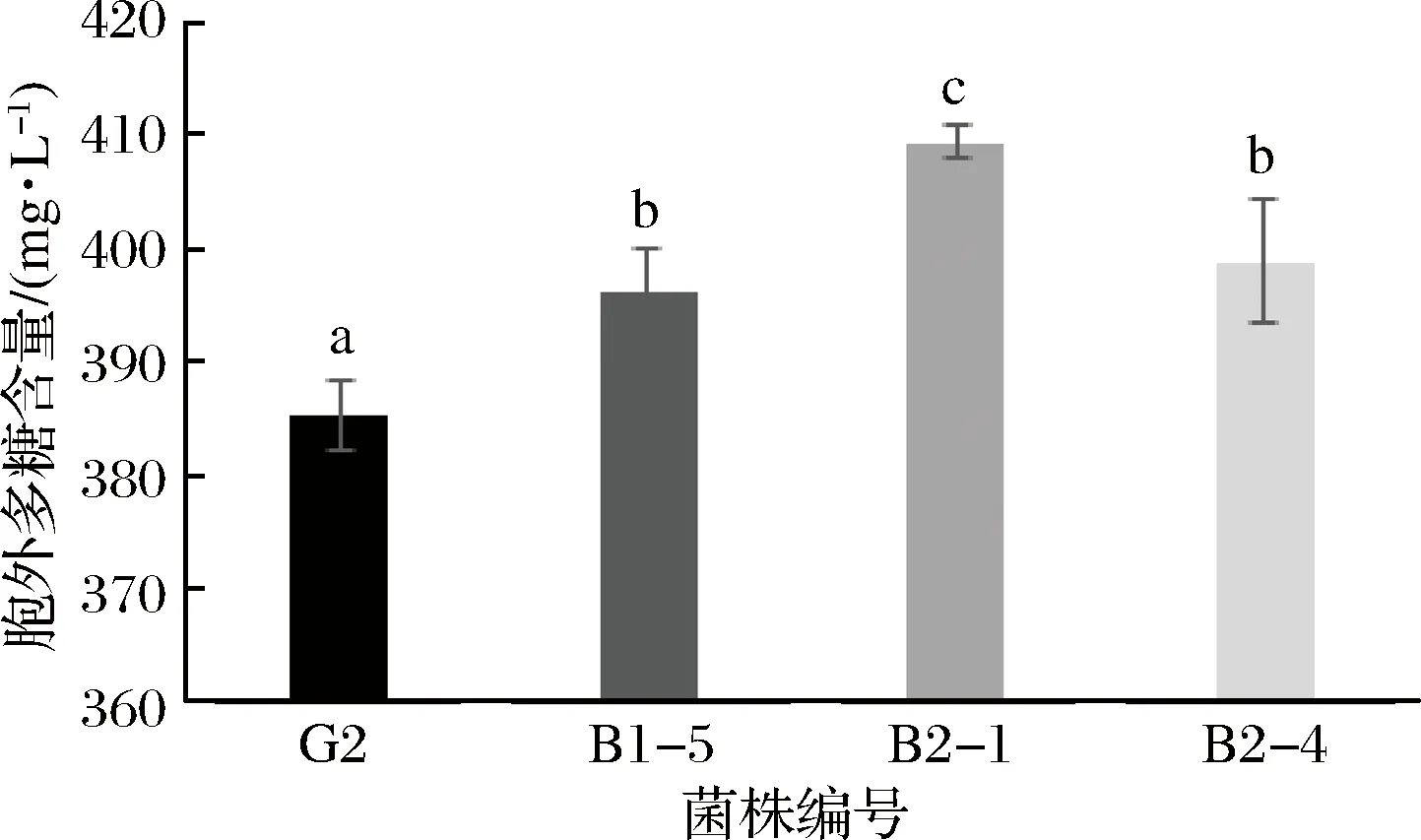
圖4 三株嗜熱鏈球菌胞外多糖含量Fig.4 Contents of EPS in Streptococcus thermophiles
2.6 胞外多糖含量測定
有報道稱胞外多糖具有改善腸道微環境、增強人體免疫力等多種生理功能,能夠提高產品的營養保健功能[25-26]。而嗜熱鏈球菌是酸乳發酵過程中主要的產多糖菌株[27]。從圖5中可知,突變株B1-5、B2-1和B2-4中的胞外多糖含量為396.14、409.35和398.80 mg/L,顯著高于野生株G2的含量385.11 mg/L(p<0.05)。胞外多糖能夠使酪蛋白分子之間更容易形成大分子,使分子直徑變大,從而增加黏度,改善酸乳品質[24]。
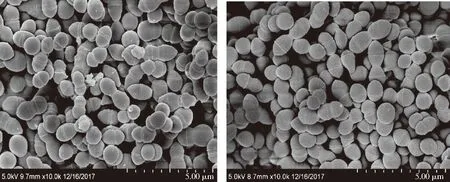
圖5 野生株(左)與突變株(右)掃描電鏡(SEM)形態學觀察Fig.5 Microcopic observation under scanning electron microscopy

圖6 野生株(左)與突變株(右)透射電鏡(TEM)形態學觀察Fig.6 Microcopic observation under transmission electron microscopy
2.7 電鏡測試
嗜熱鏈球菌菌落表面比較光滑,為白色或者淡黃色,革蘭氏染色均呈陽性。通過掃描電鏡和透射電鏡可以看到,嗜熱鏈球菌以2個卵圓型為1對的球菌連成長鏈。本試驗中的野生株與突變株在形態上沒有明顯差異。
3 結論
通過對來自航天誘變的10株嗜熱鏈球菌進行篩選并進行脫脂乳培養基42 ℃ 24 h發酵試驗,測定發酵期間的pH值、滴定酸度、活菌數、黏度及胞外多糖含量等指標,分析了4株嗜熱鏈球菌在發酵過程中的產酸特性,初步篩選出1株優良性狀的嗜熱鏈球菌。在42 ℃發酵期間,4株均在發酵開始后pH值迅速下降,達到發酵終點的時間約在12 h;其中突變株B2-1的pH值下降到4.09,滴定酸度為106 °T,且產酸速率最快,黏度及胞外多糖含量也顯著高于野生菌株G2,但是在發酵期間活菌數變化不大。因此,通過航天誘變有可能改變嗜熱鏈球菌的發酵性能,從而得到具有優良性狀的菌株,為乳制品開發利用提供理論基礎。

