不同表達模式組合對谷氨酸棒狀桿菌中腦鈉肽蛋白表達的影響
彭楓,劉秀霞,陳靜,楊艷坤,白仲虎*
1(江南大學 生物工程學院,江蘇 無錫,214122) 2(江南大學,糧食發酵工藝與技術國家工程實驗室,江蘇 無錫,214122)3(江南大學,工業生物技術教育部重點實驗室,江蘇 無錫,214122)
谷氨酸棒狀桿菌(Corynebacteriumglutamicum)是一種革蘭氏陽性細菌,已被廣泛用于谷氨酸、賴氨酸等氨基酸的生產,以及食品工業、動物飼料和醫藥開發等領域,是一種普遍認為安全(generally recognized as safe, GRAS)的表達宿主[1]。由于其無內毒素無致病性,可以分泌正確折疊的活性蛋白直接到胞外上清液中等優點,近年來C.glutamicum也被開發作為一種新的外源蛋白表達宿主[2]。同時,隨著發酵過程優化來提高生物反應器中產物產量以及遺傳學改造來增強宿主蛋白合成能力等技術被開發運用[3-4],也使得C.glutamicum越來越多地應用于重組蛋白表達。近十年來已有多種外源真核及原核蛋白在C.glutamicum中被高效表達的報道和應用。例如葡萄球菌核酸酶、轉谷氨酰胺酶、人源抗體片段和胰島素等[5-6]。
目前C.glutamicum中,外源蛋白的表達系統依據啟動子作用方式分為誘導型及組成型表達系統,誘導型系統在表達對細胞有毒害作用的蛋白時有很好的效果,組成型表達可以得到很高的表達量[7-8]。外源蛋白表達系統按照蛋白表達后的去向可分為胞內表達和分泌型兩種表達策略,細胞分泌較少的宿主細胞蛋白到胞外,分泌型表達可降低下游純化難度[9]。然而,因為信號肽的不同選擇以及分泌過程中斷裂的影響,分泌表達有時會得到不正確折疊的蛋白。胞內表達可以提供蛋白正確折疊的內環境,但胞內蛋白酶較胞外多,會造成更多的外源蛋白降解[10]。所以,利用谷氨酸棒桿菌表達系統表達目標蛋白時需要解決的一個重要問題就是選擇哪種表達模式組合能夠達到最優的表達效果。本研究試圖在C.glutamicum中找到表達腦鈉肽(BNP)的最優表達模式。
BNP是一種肽類激素,它具有排鈉利尿、舒張血管以及抗腎素的作用[11]。BNP屬于一個結構相似的肽類激素家族,此家族還包括心房肽(atrial natriuretic peptide, ANP)、C型腦鈉肽(C-type natriuretic peptide, CNP)和尿擴張素。BNP分子由32個氨基酸殘基組成,在第10位半胱氨酸和第26位半胱氨酸之間有1個二硫鍵[12]。
BNP是腦鈉肽前體原(pro-brain natriuretic peptide, proBNP)的蛋白酶裂解產物。BNP以及沒有分解的proBNP都被分泌到血液中并在血液中循環[13]。已確定proBNP的合成隨著心壁的張力上升而增加,繼而導致血液中BNP和proBNP濃度的升高[14]。這兩種多肽濃度在心力衰竭、急性冠狀動脈綜合癥、心肌病、心臟瓣膜疾病、心房纖維性顫動和心臟淀粉樣變性等不同的心臟病患者樣品中都有升高[15]。心衰患者血液中這兩種多肽的濃度與疾病的嚴重程度成正比。因此,血液中此種肽的檢測被廣泛用于鑒定心衰患者和檢測心衰的嚴重程度[16]。BNP蛋白作為心血管檢查試劑盒中的標準品和校準品,目前尚未有用C.glutamicum表達BNP蛋白的相關報道,而作為GRAS菌株生產的蛋白在藥品審批時比非安全菌株會更有優勢。
本研究基于pXMJ19質粒骨架,整合Ptac啟動子、gfp基因、Ncgl0949信號肽等基因表達元件,構建了一套高效的谷氨酸棒狀桿菌表達系統,該系統分為誘導型胞內表達、組成型胞內表達、誘導型分泌表達、組成型分泌表達4種表達模式組合,同時這4種模式組合被用來研究BNP在谷氨酸棒狀桿菌中的最適表達模式。研究結果將對以谷氨酸棒狀桿菌作為宿主快速表達外源蛋白具有重要指導意義。
1 材料方法
1.1 材料
1.1.1 菌株和質粒
谷氨酸棒狀桿菌C.glutamicumCGMCC1.15647用于外源蛋白的表達,保藏于中國普通微生物菌種保藏管理中心。大腸桿菌E.coliDH5α用于質粒的克隆和構建,本研究室保藏。pXMJ19用于谷氨酸棒狀桿菌中蛋白表達,質粒pEGFP為綠色熒光蛋白表達質粒,均由實驗室保存。
1.1.2 主要的試劑
質粒提取試劑盒,膠回收試劑盒及PCR產物回收試劑盒購自Axygen公司。RNA反轉錄,熒光定量,T4 DNA連接酶及In-Fusion重組試劑購自Takara公司。RNA提取試劑盒和限制性內切酶購自Thermo公司。BNP標準品購自羅氏。氯霉素購自上海生物工程有限公司。引物由蘇州金唯智合成。所用引物見表1。

表1 擴增引物序列Table 1 Primers used in this study
1.1.3 培養基和培養條件
LB培養基用于培養大腸桿菌,培養溫度為37 ℃,LBB培養基(LB培養基中添加1%腦心浸液)用于培養谷氨酸棒狀桿菌,培養溫度為30 ℃。如需添加抗生素,氯霉素在大腸桿菌中的使用終質量濃度為30 mg/L,在谷氨酸棒狀桿菌中的使用終質量濃度為10 mg/L。
1.2 方法
1.2.1 谷氨酸棒狀桿菌組成型表達載體的構建
Ptac啟動子為Lac(乳糖啟動子)與Trp(色氨酸啟動子)結合而成的雜合啟動子,當有lacIq基因產生阻遏蛋白時啟動子為IPTG誘導型啟動子,去掉阻遏蛋白基因時啟動子會成為組成型強啟動子[17]。以pXMJ19 為質粒骨架,利用引物tacF和tacR擴增Ptac啟動子序列Ptac-C,同時在5’端引入EcoRV酶切位點,在3’端引入HindIII酶切位點。利用EcoRV和HindIII酶切pXMJ19,刪除掉載體中的Ptac啟動子及laIq區域,酶切回收后的載體片段與同樣用限制性EcoRV和HindIII消化回收后的Ptac片段連接,構建pXMJ19組成型表達載體pXMJ19C(圖1)。
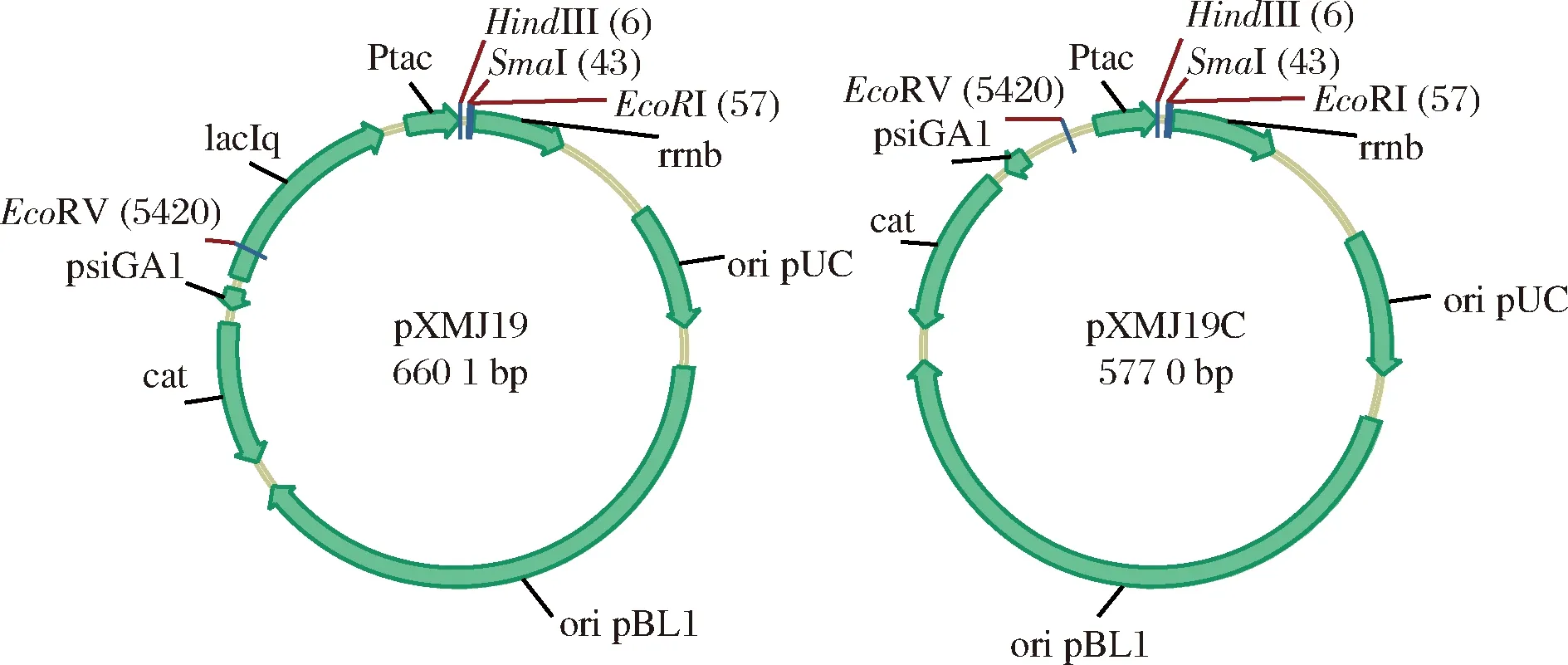
圖1 pXMJ19C組成型表達載體的構建Fig.1 The plasmid construction of pXMJ19C
1.2.2 谷氨酸棒狀桿菌GFP胞內表達載體的構建
以pEGFP質粒為模板利用引物gfpF和gfpR擴增gfp基因,同時在gfp基因ATG之前加上SD(AAAGGAGGACAACTA)序列,在片段的5’端引入HindIII酶切位點,在3’端引入EcoRI酶切位點,擴增的片段經過凝膠電泳分析,利用限制性內切酶HindIII和EcoRI消化回收后,與同樣用HindIII和EcoRI消化回收后的載體pXMJ19連接,連接后產物轉化入大腸桿菌DH5α感受態細胞,轉化液涂布于30 mg/mL氯霉素的LB瓊脂平板過夜培養,再挑取單菌落接種LB液體培養基過夜培養,提取質粒后進行酶切驗證,正確的質粒即為谷氨酸棒狀桿菌中GFP蛋白胞內誘導型表達載體pXMJ19-gfp。
同樣的將擴增的片段經過凝膠電泳分析,限制性內切酶消化回收后,連接到同樣經HindIII和EcoRI酶切消化回收后的組成型表達載體pXMJ19C中,構建GFP胞內組成表達載體pXMJ19C-gfp。
1.2.3 谷氨酸棒狀桿菌GFP分泌型表達載體的構建
以pEGFP為質粒骨架,合成SD序列插入到gfpATG之前,SD序列前插入Ncgl0949信號肽(ATGCAAATAAACCGCCGAGGCTTCTTAAAAGCCACCGCAGGA CTTGCCACTATCGGCGCTGCCAGCATGTTTATGCCAAAGGCCAAC GCCCTTGGAGCA),利用引物0949gfpF和0949gfpR擴增sgfp片段,在5’端引入HindIII酶切位點,在3’端引入EcoRI酶切位點,限制性內切酶HindIII和EcoRI消化回收后,連接到經相同限制性內切酶處理的表達載體pXMJ19及pXMJ19C中,構建成GFP蛋白的誘導型分泌表達載體pXMJ19-sgfp及組成型分泌表達載體pXMJ19C-sgfp。
1.2.4 谷氨酸棒狀桿菌中BNP胞內表達載體的構建
人源的BNP蛋白(GenBank: NP_002512.1)經過谷氨酸棒狀桿菌密碼子優化后合成bnp基因,bnp基因ATG前加入SUMO基因(GenBank: KP405837.1),SUMO多用于融合蛋白的切除,也有報道SUMO具有促進蛋白折疊,促進蛋白可溶的特點[18],本研究中引入SUMO用于促進BNP的表達。SUMO基因前引入組氨酸標簽(CATCATCACCACCACCAC),然后再引入SD序列,以引物bnpF和bnpR擴增bnp片段,最終的片段兩端分別引入pXMJ19載體SmaI位點兩端同源序列,通過同源重組的方法連接到pXMJ19和pXMJ19C中,分別構建BNP蛋白的組成型胞內表達載體pXMJ19-bnp和誘導型的胞內表達載體pXMJ19C-bnp。
1.2.5 谷氨酸棒狀桿菌BNP分泌表達載體
谷氨酸棒狀桿菌密碼子優化后的bnp基因,ATG前加入SUMO基因, SUMO基因前引入組氨酸標簽,組氨酸標簽前加入Ncgl0949信號肽,信號肽前再加入SD序列,以引物0949bnpF和0949bnpR擴增sbnp片段,片段兩端引入pXMJ19載體SmaI位點兩端同源序列,通過同源重組的方法連接到pXMJ19和pXMJ19C 中,構建BNP蛋白的組成型分泌表達載體pXMJ19-sbnp和誘導型分泌表達載體pXMJ19C-sbnp。
1.2.6 轉化谷氨酸棒狀桿菌
谷氨酸棒狀桿菌感受態的制作方法及電擊轉化方法依據文獻報道[19]。
1.2.7 GFP的表達鑒定
為了分析GFP以不同的表達模式組合在谷氨酸棒狀桿菌中的表達情況,將包含有不同GFP表達載體的菌株接種到24孔板中過夜培養,按1∶10的比例轉接到2 mL新鮮培養基中生長24 h, 需要添加誘導劑的在培養8 h時添加濃度為0.01 mmol/L的IPTG。Dark Reader,SDS-PAGE及多功能酶標儀被用來分析GFP的表達量。取2 mL培養液分為2份,于12 000 r/min離心,菌體和上清分開,菌體PBS洗滌2遍后,用Dark Reader 來觀察不同菌株的菌體和發酵上清熒光情況。每份菌體用1 mL PBS重懸,1份菌懸液高通量破碎后,取破碎上清和發酵液上清一起用SDS-PAGE來檢測GFP的表達量。另1份菌懸液取200 μL和200 μL發酵液利用多功能酶標儀測量熒光,熒光測量條件為激發488 nm發射507 nm。
1.2.8 不同表達模式gfp轉錄水平分析
為了分析不同表達模式GFP表達量與轉錄水平的關系,以gfp基因為模板設計熒光定量引物RTgfpF和RTgfpR。不同表達模式GFP表達菌株的培養條件與GFP表達量測定時相同,取樣點選取在加入IPTG前2 h和加入后2 h即培養的6 h和10 h,使用RNA提取試劑盒提取谷氨酸棒狀桿菌的總RNA,反轉錄成cDNA,并使用RT-PCR檢測gfp基因的轉錄水平。以16S rRNA為內參基因,采用2-ΔΔCt方法測定gfp基因的相對表達量。RNA提取,反轉錄及熒光定量體系參考試劑盒說明書。
1.2.9 BNP的表達鑒定
為了分析BNP在不同表達模式下的表達情況,將包含有BNP表達質粒的菌株接種到24孔板中,培養過夜后按1∶10的比例轉接于新鮮的2 mL培養基中,需要添加誘導劑的在培養8 h后添加濃度0.01 mm的IPTG,培養至24 h。SDS-PAGE,Western Bolt,化學發光法被用來分析BNP的表達。收獲后的細胞 1 mL 12 000 r/min 離心10 min,分別收集發酵液上清和菌體。菌體PBS洗滌2遍后冰上超聲波破碎。破碎后的上清,發酵液上清都通過SDS-PAGE來檢測。 同時通過Western Blot來分析BNP的表達。化學發光法利用雙抗體夾心法,通過光子數來指示BNP的表達量,具體操作方法參考文獻[11]。
1.2.10 BNP的純化
包含有BNP表達載體的菌株接種到20 mL LBB培養基中30 ℃過夜培養,然后按1∶10稀釋到200 mL培養基中30 ℃培養24 h,細胞收獲后4 ℃ 4 000 r/min 離心去上清,菌體用PBS洗滌2次,冰上超聲破碎。BNP利用AKTA純化儀并利用HisTrap HP進行純化,純化后的蛋白利用SDS-PAGE進行檢測,并利用BCA蛋白定量試劑盒進行定量。
2 結果與分析
2.1 谷氨酸棒狀桿菌中GFP不同表達模式菌株的構建
組合誘導型、組成型、胞內以及分泌4種表達方式,外源蛋白表達系統可分為誘導型胞內表達、組成型胞內表達、誘導型分泌表達及組成型分泌表達4種模式。為了在谷氨酸棒狀桿菌中快速構建這4種表達系統,研究中選取GFP作為模式蛋白,結合SD序列,利用Ptac誘導型啟動子和Ptac-C組成型啟動子分別構建了 GFP誘導型胞內表達載體pXMJ19-gfp和組成型胞內表達載體pXMJ19C-gfp; 同時結合SD序列,Ncgl0949信號肽構建成誘導型分泌表達載體pXMJ19-sgfp和組成型分泌表達載體pXMJ19C-sgfp。構建完成的表達載體通過酶切、PCR和測序來驗證(圖2)。正確的載體轉化谷氨酸棒狀桿菌即構建成相應的GFP表達菌株。
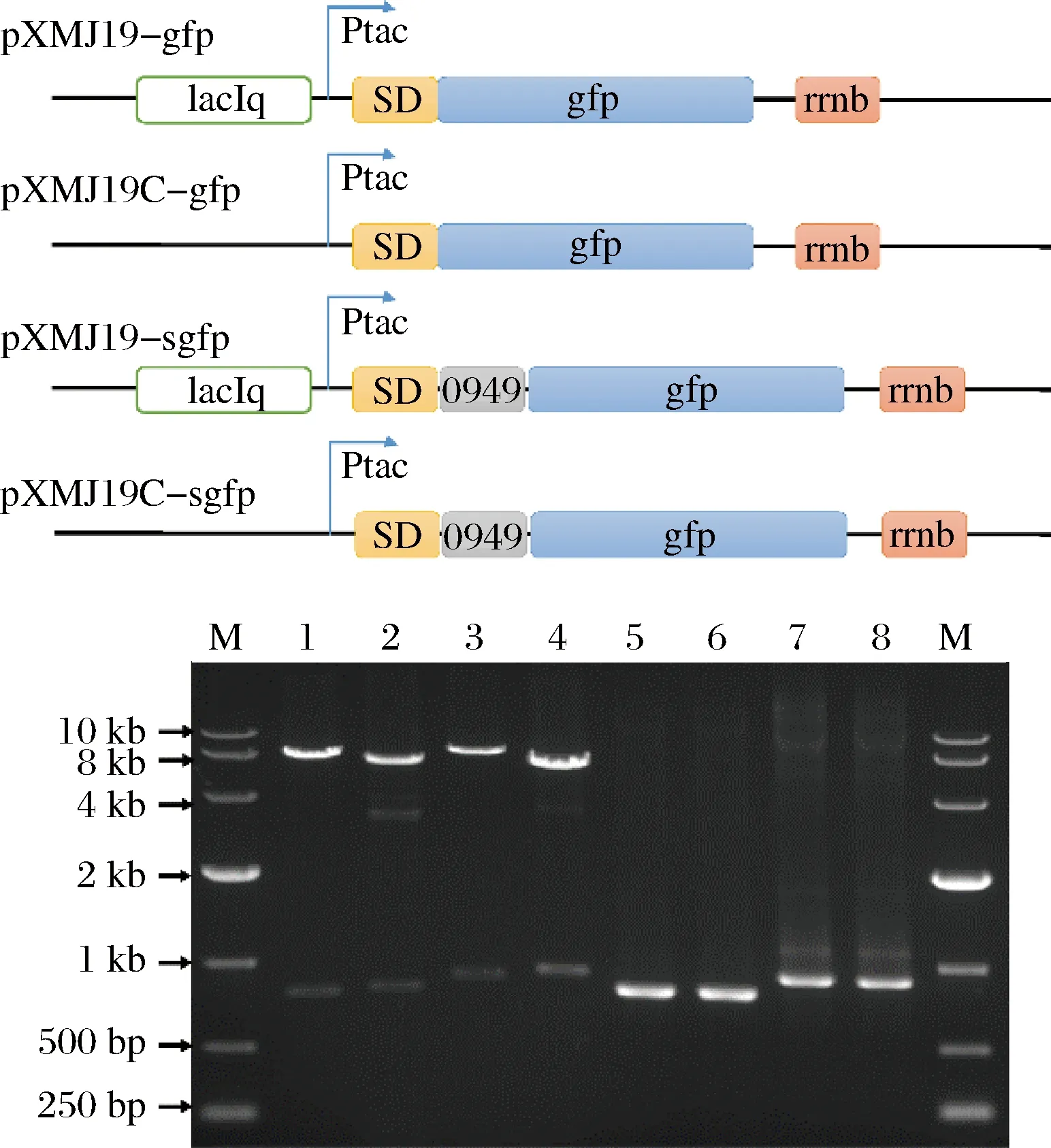
M-DL10 000 marker;1,2,3,4分別為質粒pXMJ19-gfp,pXMJ19C-gfp,pXMJ19-sgfp和pXMJ19C-sgfp的酶切驗證結果,5,6,7,8分別為PCR驗證結果圖2 GFP表達載體的構建Fig.2 Construction of plasmids for GFP expression
2.2 GFP在谷氨酸棒狀桿菌中的表達分析
為了驗證所構建的4種表達系統在谷氨酸棒狀桿菌中是否可行,以GFP作為模式蛋白,分析了GFP在這4種表達系統中的表達量差異。以含有pXMJ19 的谷氨酸棒狀桿菌轉化子作為陰性對照,利用24孔板培養不同類型GFP表達菌株,利用SDS-PAGE,多功能酶標儀及Dark Reader來分析不同表達模式下GFP的表達水平。Darker Reade結果表明,胞內表達的只在菌體中有熒光,分泌表達的只在上清中有熒光,分泌表達的誘導型比組成型菌株熒光強度高(圖3-a,圖3-b)。培養液的菌體和上清分別用SDS-PAGE 和多功能酶標儀來檢測。結果表明GFP的組成型胞內表達量是誘導型胞內表達的1.2倍,是誘導型分泌表達的1.9倍,是組成型分泌表達的2.9倍(圖3-c,圖3-d)。說明4種表達模式都能在谷氨酸棒狀桿菌中成功表達外源蛋白,但對于GFP蛋白,組成型胞內表達是更好的表達方式。
2.3 不同表達模式下gfp轉錄水平分析
為了分析不同表達模式對轉錄水平的影響,本研究以16S rRNA作為內參基因,使用RT-PCR測定了4種表達模式下gfp的轉錄水平。結果可以看出,組成型的胞內表達及誘導型的胞內表達具有相似的轉錄水平,明顯高于組成型分泌表達及誘導型分泌表達模式下的gfp轉錄水平。說明分泌型表達元件的加入影響了gfp基因的轉錄。同時,組成型分泌表達模式和誘導型分泌表達模式下都能觀察到gfp的轉錄,說明這2種表達模式GFP表達量的差異不是發生在轉錄水平上(圖4)。
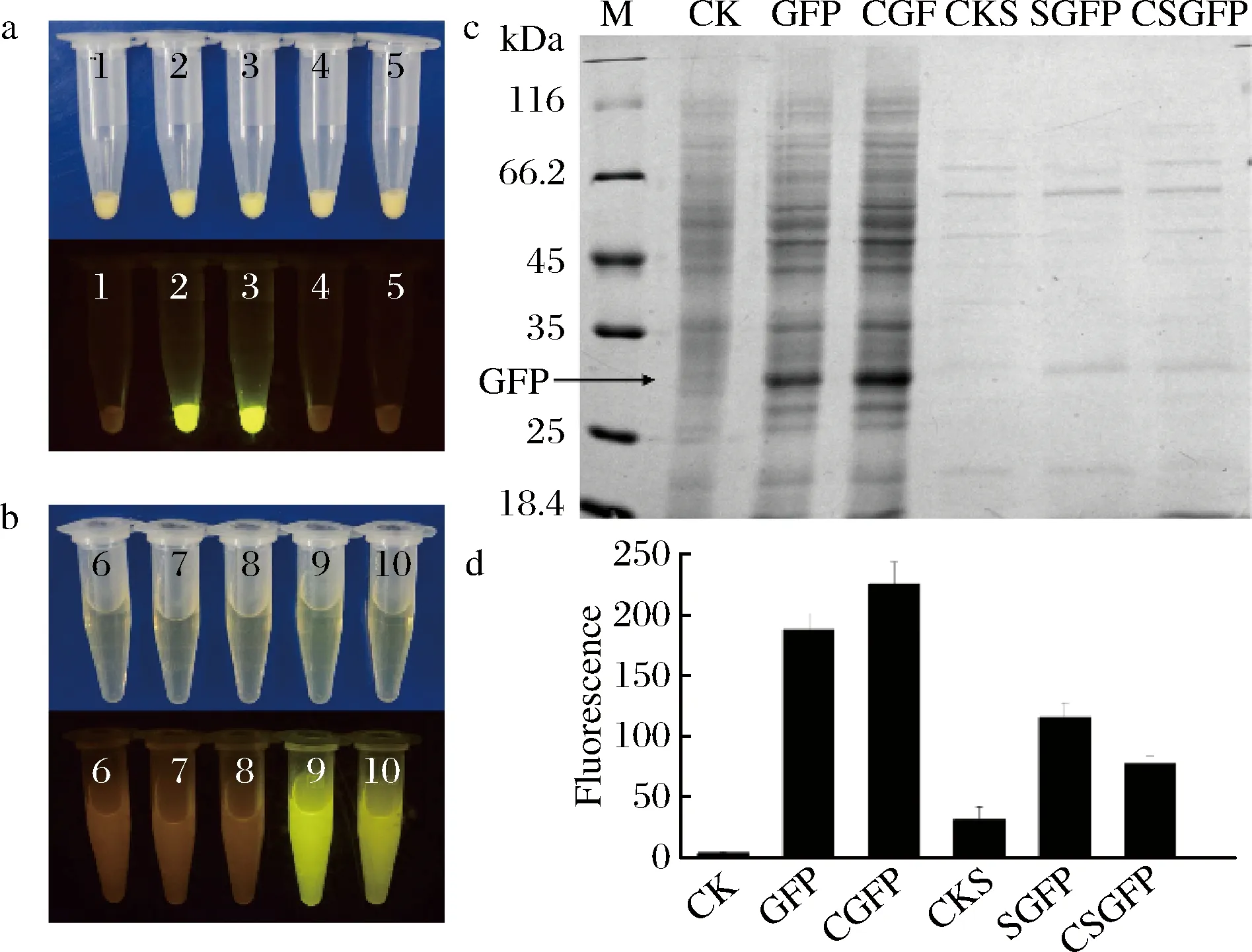
a-Darker Reade分析不同菌株菌體的熒光強度;b-Darker Reade分析不同菌株培養液上清的熒光強度;c-SDS-PAGE分析不同菌株GFP表達水平;d-多功能酶標儀分析不同菌株GFP的表達水平;1-菌體陰性對照;2-誘導型胞內表達的菌體;3-組成型胞內表達的菌體;4-誘導型分泌表達的菌體;5-組成型分泌表達的菌體;6-上清陰性對照;7-誘導型胞內表達的上清;8-組成型胞內表達的上清;9-誘導型分泌表達的上清;10-組成型分泌表達的上清;M-蛋白marker;CK-菌體陰性對照;GFP-誘導型胞內表達的菌體;CGFP-組成型胞內表達的菌體;CKS-上清陰性對照;SGFP-誘導型分泌表達的上清;CSGFP-組成型分泌表達的上清圖3 GFP表達量的檢測Fig.3 Detection of the expression of GFP
2.4 谷氨酸棒狀桿菌中BNP不同表達模式菌株的構建
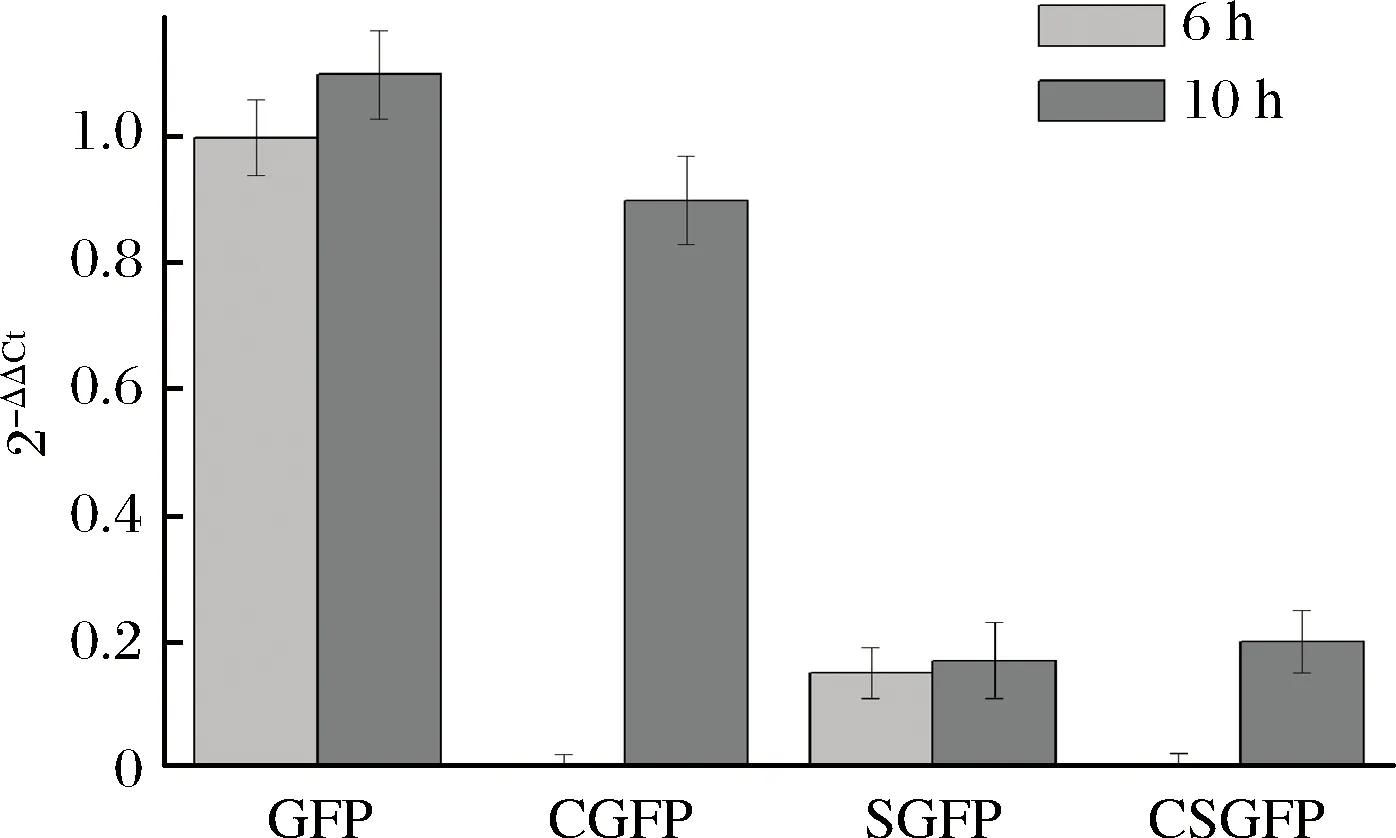
GFP-誘導型胞內表達;CGFP-組成型胞內表達; SGFP-誘導型分泌表達;CSGFP-組成型分泌表達圖4 gfp轉錄水平分析Fig.4 Relative quantification of gfp gene mRNA level
為了在谷氨酸棒狀桿菌中表達BNP蛋白,同時探究BNP表達的最佳模式組合。本研究組裝Ptac誘導型及Ptac-C組成型啟動子,SD序列,SUMO基因,bnp基因等表達元件分別構建成BNP誘導型胞內表達載體pXMJ19-bnp和組成型胞內表達載體pXMJ19C-bnp。同時,組裝SD序列,Ncgl0949信號肽,SUMO基因,bnp基因及Ptac誘導型和組成型啟動子分別構建成BNP誘導型分泌表達載體pXMJ19-sbnp和組成型分泌表達載體pXMJ19C-sbnp。載體通過酶切,RCR基因和測序驗證。驗證正確的質粒轉化谷氨酸棒狀桿菌構建成相應的BNP表達菌株(圖5)。
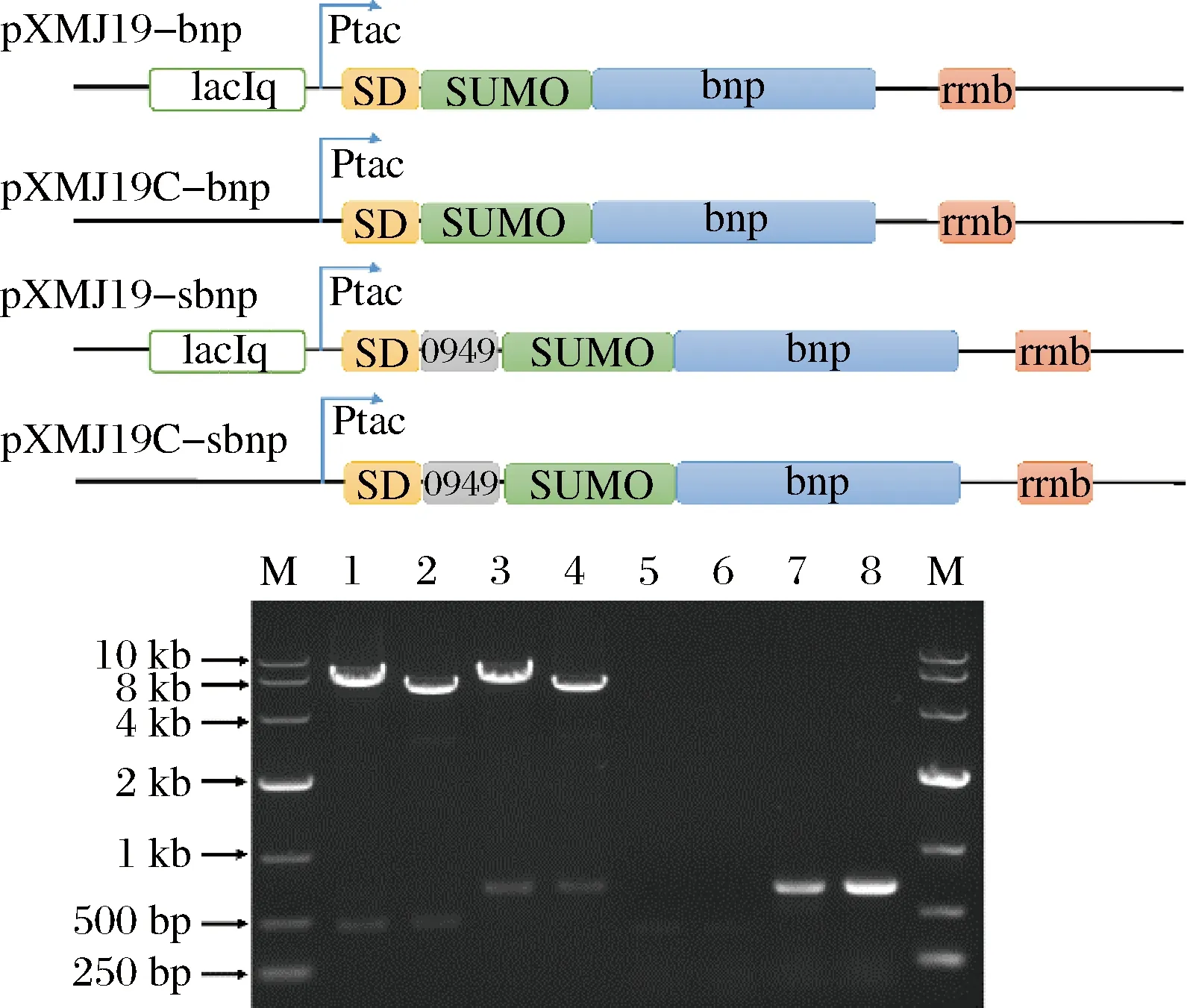
M-DL10000 marker;1,2,3,4分別為質粒pXMJ19-bnp,pXMJ19C-bnp,pXMJ19-sbnp和pXMJ19C-sbnp的酶切驗證結果,5,6,7,8分別為PCR驗證結果圖5 BNP表達載體的構建Fig.5 Construction of plasmids for BNP expression
2.5 BNP蛋白在谷氨酸棒狀桿菌中的表達分析
為了檢測BNP以不同表達模式在谷氨酸棒狀桿菌中的表達情況,以含有pXMJ19轉化子作為陰性對照,利用24孔板培養包含有不同的BNP表達載體的菌株。1 mL培養液離心后,分別取上清和菌體通過SDS-PAGE 和Western Bolt 來分析不同菌株BNP的表達情況。結果表明,胞內表達的組成型和誘導型都可以觀察到BNP的表達。誘導型分泌表達的上清中可以觀察到BNP的表達,組成型分泌觀察不到BNP蛋白的表達(圖6-a,圖6-b)。同時通過化學發光法檢測BNP的表達量,BNP的表達量組成型胞內表達是誘導型胞內表達的1.3倍,是誘導型分泌表達的3.3倍。組成型分泌表達并不能觀察到BNP蛋白的表達(圖6-c)。表明BNP不適合組成型分泌表達,組成型胞內表達為最佳的表達模式。
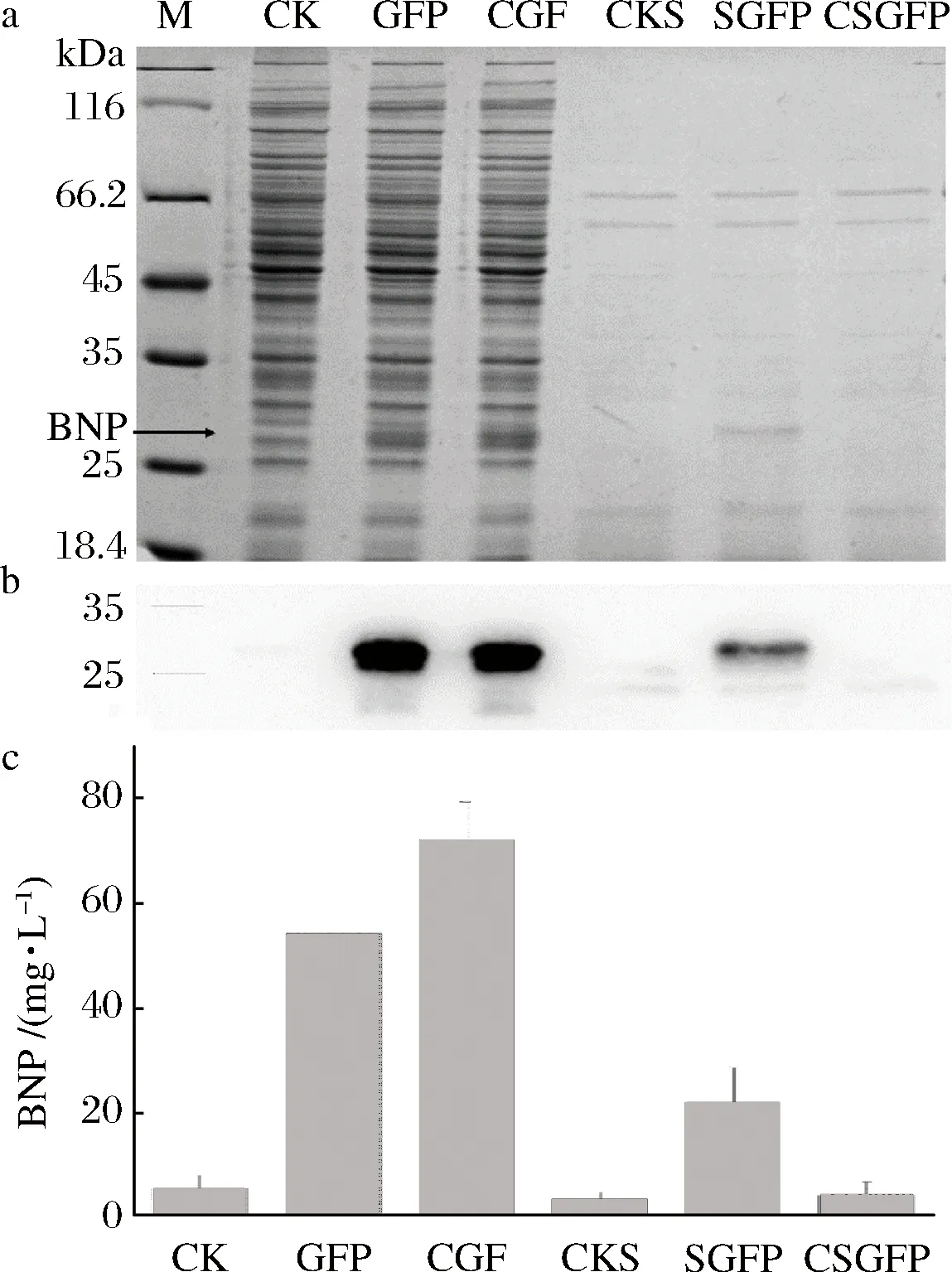
a-SDS-PAGE分析不同菌株BNP表達水平;b-Western Bolt分析不同菌株BNP表達水平;c-化學發光法分析不同菌株BNP表達水平;M-蛋白marker;CK-菌體陰性對照;BNP-誘導型胞內表達的菌體;CBNP-組成型胞內表達的菌體;CKS-上清陰性對照;SBNP-誘導型分泌表達的上清;CSBNP-組成型分泌表達的上清圖6 BNP表達量的檢測Fig.6 Detection of the expression of BNP
2.6 BNP的純化及抗原特性分析
經過不同表達模式分析,組成型胞內表達為BNP最優的表達選擇。為了進一步得到大量純化后的BNP蛋白,利用200 mL搖瓶培養,培養液通過AKATA純化系統純化,純化產物通過SDS-PAGE檢測及通過BCA蛋白定量試劑盒定量。通過一步純化,最終從1 L培養產物中分離純化得到235.5 mg BNP蛋白,通過SDS-PAGE檢測,純化效率可到90%以上(圖7-a)。取純化后的BNP(SUMO-BNP)及購買的BNP標品分別稀釋成不同的梯度,利用化學發光法分析純化后的BNP抗原特性。結果顯示純化后的BNP與標品相比具有同樣的抗原特性(圖7-b)。
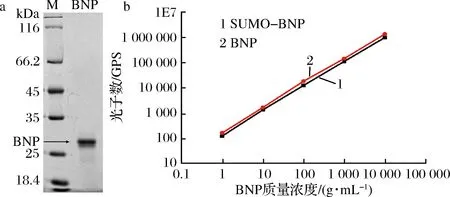
a-SDS-PAGE檢測純化后BNP的純度;b-化學發光法分析純化后的BNP抗原特性圖7 BNP蛋白的純化及抗原特性分析Fig.7 Analysis of purified of BNP
3 討論
谷氨酸棒狀桿菌越來越多的被應用于合成生物學領域表達高附加值的化合物[20],同時也被開發用來表達外源蛋白。外源蛋白在谷氨酸棒狀桿菌中表達可分為誘導型胞內表達、組成型胞內表達、誘導型分泌表達、組成型分泌表達幾種模式[7-9],本研究利用GFP構建了一套快速探索外源蛋白在谷氨酸棒狀桿菌中表達模式的方法,同時利用這套方法探索了BNP蛋白的最適表達模式。
BNP蛋白被廣泛運用于體外診斷行業,不經糖基化修飾的BNP反而比糖基化修飾后的BNP具有更好的檢測效果[14]。至今尚未有在谷氨酸棒狀桿菌中成功表達BNP的相關報道。研究發現,BNP可以在胞內組成型表達,同時也可以分泌形式表達,但分泌表達表達量非常低,組成型分泌表達甚至檢測不到BNP的表達(圖6)。雖然谷氨酸棒狀桿菌具有胞外蛋白酶少的特點,分泌表達將會簡化提純步驟,但就目前的分泌信號肽,啟動子,終止子的組合,胞內表達是最理想的表達策略。以后的工作也會繼續研究不同的信號肽等表達元件的組合,探尋最佳的分泌表達模式。
BNP蛋白具有分子量小結構簡單的特點,等電點分析表明BNP蛋白的等電點為10.95,研究中嘗試直接表達BNP蛋白,但檢測不到蛋白的表達。SUMO等電點為4.66,多用于融合蛋白的切除,也有報道SUMO具有促進蛋白折疊,促進蛋白可溶的特點[18]。當SUMO與融合BNP蛋白后,融合的蛋白等電點為6.59,偏近中性,推測可能會有助于蛋白的表達。最終結果也表明,BNP融合SUMO后,才可以檢測到BNP蛋白的表達,這也為在谷氨酸棒狀桿菌中表達高等電點蛋白提供了一種表達思路。

